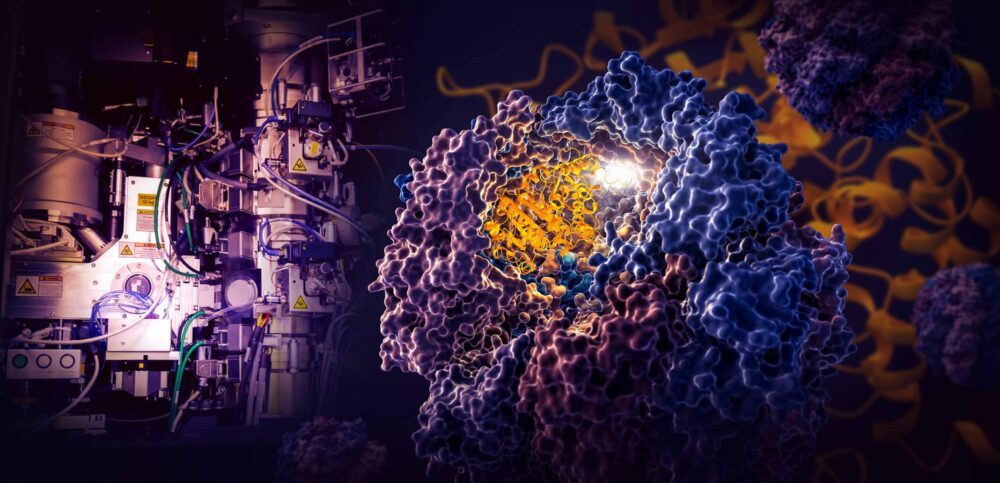
En landemerkestudie utført av forskere ved Department of Energys SLAC National Accelerator Laboratory og Stanford University avslører hvordan en liten cellulær maskin kalt TRiC styrer foldingen av tubulin, et menneskelig protein som er byggesteinen i mikrotubuli som fungerer som cellens stillas og transportsystem .
Inntil nå har forskere trodd at TRiC og lignende maskiner, kjent som chaperoniner, passivt gir et miljø som bidrar til å folde seg, men deltar ikke direkte i det.
Opptil 10 % av proteinene i cellene våre, så vel som i planter og dyr, får praktisk hjelp fra disse små kamrene til å brette seg til deres endelige, aktive former, estimerte forskerne.
Mange av proteinene som foldes ved hjelp av TRiC er nært knyttet til menneskelige sykdommer, inkludert visse kreftformer og nevrodegenerative lidelser som Parkinsons, Huntingtons og Alzheimers sykdommer, sa Stanford Professor Judith Frydman, en av studiens hovedforfattere.
Faktisk, sa hun, er mange anti-kreftmedisiner designet for å forstyrre tubulin og mikrotubulene det danner, som er veldig viktige for celledeling. Så målretting mot den TRiC-assisterte tubulinfoldingsprosessen kan gi en attraktiv anti-kreftstrategi.
Teamet rapporterte resultatene av deres tiår lange studie i en artikkel publisert i Cell i dag.
"Dette er den mest spennende proteinstrukturen jeg har jobbet med i min 40 år lange karriere," sa SLAC/Stanford professor Wah Chiu, en pioner innen utvikling og bruk av kryogen elektronmikroskopi (cryo-EM) og direktør for SLACs kryo-EM og bioimaging divisjon.
"Da jeg møtte Judith for 20 år siden," han sa, "Vi snakket om hvorvidt vi kunne se proteiner folde seg. Det er noe folk har prøvd å gjøre i årevis, og nå har vi gjort det.»
Forskerne fanget fire distinkte trinn i den TRiC-rettede foldeprosessen med nær-atomisk oppløsning med cryo-EM, og bekreftet det de så med biokjemiske og biofysiske analyser.
På det mest grunnleggende nivået, sa Frydman, løser denne studien den langvarige gåten om hvorfor tubulin ikke kan foldes uten TRiCs hjelp: "Det er virkelig en game changer i å endelig bringe en ny måte å forstå hvordan proteiner folder seg i den menneskelige cellen."
Brett spaghetti til blomster
Proteiner spiller viktige roller i praktisk talt alt en celle gjør, og å finne ut hvordan de folder seg inn i deres endelige 3D-tilstander er en av de viktigste oppdragene innen kjemi og biologi.
Som Chiu sier det, "Et protein starter som en streng av aminosyrer som ser ut som spaghetti, men det kan ikke fungere før det er foldet til en blomst med akkurat riktig form."
Siden midten av 1950-tallet har vårt bilde av hvordan proteiner folder blitt formet av eksperimenter gjort med små proteiner av National Institutes of Health-forsker Christian Anfinsen. Han oppdaget at hvis han brettet ut et lite protein, ville det spontant springe tilbake til samme form, og konkluderte med at instruksjonene for å gjøre det var kodet i proteinets aminosyresekvens. Anfinsen delte Nobelprisen i 1972 kjemi for denne oppdagelsen.
Tretti år senere oppdaget forskere at spesialiserte cellulære maskiner hjelper proteiner med å folde seg. Men det utbredte synet var at deres funksjon var begrenset til å hjelpe proteiner med å utføre sin spontane folding ved å beskytte dem mot å bli fanget eller glomming sammen.
En type hjelpemaskin, kalt chaperonin, inneholder et fatlignende kammer som holder proteiner inne mens de brettes. TRiC passer inn i denne kategorien.
TRiC-kammeret er unikt ved at det består av åtte forskjellige underenheter som danner to stablede ringer. En lang, tynn tråd av tubulinprotein leveres inn i åpningen av kammeret av et hjelpemolekyl formet som en manet. Deretter lukkes kammerets lokk og brettingen begynner. Når det er ferdig, åpnes lokket og de ferdige, brettede tubulinbladene.
Siden tubulin ikke kan foldes uten TRiC, så det ut til at TRiC kan gjøre mer enn passivt hjelpe tubulin til å folde seg spontant. Men hvordan fungerer det egentlig? Denne nye studien svarer på det spørsmålet og viser at, i det minste for proteiner som tubulin, gjelder ikke konseptet "spontan folding". I stedet orkestrerer TRiC direkte foldeveien som fører til det riktig formede proteinet.
Selv om nyere fremskritt innen kunstig intelligens, eller AI, kan forutsi den ferdige, foldede strukturen til de fleste proteiner, sa Frydman, viser AI ikke hvordan et protein oppnår sin riktige form. Denne kunnskapen er grunnleggende for å kontrollere folding i cellen og utvikle terapier for foldesykdommer. For å oppnå dette målet må forskerne finne ut de detaljerte trinnene i bretteprosessen når den skjer i cellen.
Et cellulært kammer tar ansvaret
For ti år siden bestemte Frydman, Chiu og deres forskerteam seg for å gå dypere inn i hva som foregår i TRIC-kammeret.
"Sammenlignet med de enklere foldekamrene med chaperoniner i bakterier, er TRiC i menneskelige celler en veldig interessant og komplisert maskin," sa Frydman. "Hver av de åtte underenhetene har forskjellige egenskaper og har en distinkt overflate inne i kammeret, og dette viser seg å være veldig viktig."
Forskerne oppdaget at innsiden av dette unike kammeret styrer foldeprosessen på to måter.

(Yanyan Zhao/Stanford University)
Når kammerets lokk lukkes over et protein, vises områder med elektrostatisk ladning på dets indre vegger. De tiltrekker seg motsatt ladede deler av tubulinproteinstrengen og fester dem i hovedsak til veggen for å skape riktig form og konfigurasjon for neste trinn i foldingen. I mellomtiden griper TRiC-underenhetens "haler" som dingler fra kammerveggen tubulinproteinet til bestemte tider og steder for å forankre og stabilisere det.
Til å begynne med hektes den ene enden av tubulinstrengen inn i en liten lomme i veggen og bretter seg. Deretter festes den andre enden på et annet sted, og skaper en stor løkke. Løkken brettes på en måte som bringer den rett ved siden av det første brettede området.
I trinn tre foldes en del av midtseksjonen for å danne kjernen til proteinet, sammen med lommer der GTP, et molekyl som lagrer og frigjør energi for å drive cellens arbeid, kan plugges inn.
Til slutt folder den gjenværende proteindelen. Tubulinmolekylet er nå klart for handling.
"Disse strukturelle øyeblikksbildene av mellomstadier i foldesekvensen har aldri blitt sett før ved kryo-elektronmikroskopi," sa Frydman.
En kraftig blanding av teknikker
Teamet hennes bekreftet foldesekvensen med en utfordrende serie med biokjemiske og biofysiske tester som krevde mange års arbeid.
Å tolke disse resultatene tillot forskerne å bygge et bilde av tubulinets skiftende form når det brettes inne i TRiC-kammeret, som samsvarte med bildene generert av cryo-EM.
"Det er veldig kraftig å kunne gå frem og tilbake mellom disse teknikkene, for da kan du virkelig vite at det du ser gjenspeiler det som skjer i cellen," sa Frydman.
"Vitenskapen har overrasket oss med en veldig interessant løsning som jeg ikke ville ha forutsett."
Studien gir også ledetråder for å forstå hvordan dette foldesystemet utviklet seg i eukaryote celler, som utgjør planter, dyr og mennesker, men ikke i enklere celler som bakterier og archaea. Etter hvert som proteiner ble mer og mer komplekse for å dekke behovene til eukaryote celler, antyder forskerne at de på et tidspunkt ikke kunne brette seg til formene de trengte for å utføre mer kompliserte jobber uten litt hjelp. Eukaryote proteiner og deres chaperoninkammer utviklet seg sannsynligvis sammen, muligens startet med den siste felles stamfaren til alle de eukaryote organismene for rundt 2.7 milliarder år siden.
På grunn av kompleksiteten i analysene og det pandemiske mellomspillet pågikk studien så lenge at mange av de som jobbet med den har gått videre til andre jobber. De inkluderer postdoktorale forskere Daniel Gestaut og Miranda Collier fra Frydmans gruppe, som utførte den biokjemiske delen av prosjektet og presset det videre, og Yanyan Zhao, Soung-Hun Roh, Boxue Ma og Greg Pintilie fra Chius gruppe, som utførte kryoen. -EM analyser. Ytterligere bidragsytere inkluderer Junsun Park, en student i Rohs gruppe, og Alexander Leitner fra ETH i Zürich, Sveits.
Arbeidet ble støttet av tilskudd til Wah Chiu og Judith Frydman fra NIH og tilskudd til Soung-Hun Roh, som nå er assisterende professor ved Seoul National University, fra Korean National Research Foundation og Suh Kyungbae Foundation (SUHF).
Journal Reference
- Daniel Gestaut et al., Strukturell visualisering av tubulinfoldingsveien rettet av human chaperonin TRiC/CCT. Cell, 8. desember 2022 DOI: 10.1016 / j.cell.2022.11.014