Nevroner kommuniserer med hverandre ved veikryss kalt synapser. Når kalsiumioner beveger seg inn i "aktive soner", som er fylt med vesikler som inneholder kjemiske meldinger, begynner de å "kommunisere". Vesikler "smelter sammen" til de presynaptiske nevronenes ytre membraner på grunn av det elektrisk ladede kalsiumet, og frigjør deres kommunikasjonskjemiske last til den postsynaptiske cellen.
En ny studie fra Picower Institute for Learning and Memory kl MIT avslører hvordan nevroner setter opp og opprettholder denne vitale infrastrukturen.
Kalsiumkanaler er en avgjørende del av motoren på den presynaptiske siden som transformerer elektriske signaler til kjemisk synaptisk overføring siden de er den primære determinanten for kalsiumtilstrømning, som deretter forårsaker vesikkelfusjon. Hvordan de akkumuleres i aktive soner var imidlertid uklart.
Denne nye studien gir ledetråder om hvordan aktive soner akkumuleres og regulerer mengden av kalsiumkanaler.
Troy Littleton, en seniorforfatter av den nye studien og Menicon-professor i nevrovitenskap ved MITs avdelinger for biologi og hjerne og kognitiv vitenskap, sa: "Modulering av funksjonen til presynaptiske kalsiumkanaler er kjent for å ha betydelige kliniske effekter. Det er viktig å forstå grunnlinjen for hvordan disse kanalene er regulert."
Er kalsiumkanaler avgjørende for at aktive soner skal utvikles?
Forskere ønsket å finne svaret på dette spørsmålet i larver. Det bør bemerkes at fluekalsiumkanalgenet (kalt "kakofoni" eller Cac) er så viktig at de ikke kan leve uten det.
I stedet for å slå ut Cac over hele flua, brukte forskere en teknikk for å eliminere Cac i bare én populasjon av nevroner. De demonstrerte at aktive soner regelmessig utvikler seg selv uten Cac ved å gjøre dette.
De brukte også en annen teknikk som kunstig forlenger fluens larvestadium. De fant ut at gitt ekstra tid vil den aktive sonen fortsette å bygge opp sin struktur med et protein kalt BRP, men Cac-akkumulering opphører etter de normale seks dagene.
Det ble også funnet at moderate økninger eller reduksjoner i tilførselen av tilgjengelig Cac i nevronet ikke påvirket hvor mye Cac som havnet i hver aktiv sone. Til deres overraskelse fant de ut at selv om antallet Cac ble skalert med størrelsen på hver aktive sone, endret det seg knapt hvis de reduserte BRP betydelig i den aktive sonen. Faktisk så det ut til at nevronet etablerte et konstant tak på mengden Cac tilstede for hver aktive sone.
MIT postdoc Karen Cunningham sa, "Det var avslørende at nevronet hadde veldig forskjellige regler for de strukturelle proteinene i den aktive sonen som BRP som fortsatte å akkumulere over tid, kontra kalsiumkanalen som var tett regulert og hadde begrenset overflod."
Foruten Cac-tilførsel eller endringer i BRP, må andre faktorer også regulere Cac-nivåene så tett. De vendte seg til alpha2delta.
Ved å genetisk manipulere uttrykket av mengden, fant forskerne at alfa2delta-nivåer direkte bestemte hvor mye Cac akkumulerte i aktive soner. Ytterligere eksperimenter avslørte også at nevronens samlede Cac-forsyning overvåker alpha2deltas evne til å opprettholde Cac-nivåer.
Det antyder at i stedet for å kontrollere Cac-mengden i aktive soner ved å stabilisere den, fungerte alpha2delta sannsynligvis oppstrøms, under Cac-trafikk, for å forsyne og gjenforsyne Cac til aktive soner.
Ved å bruke to forskjellige teknikker observerte de denne gjenforsyningen. De genererte også målinger av den og timingen.
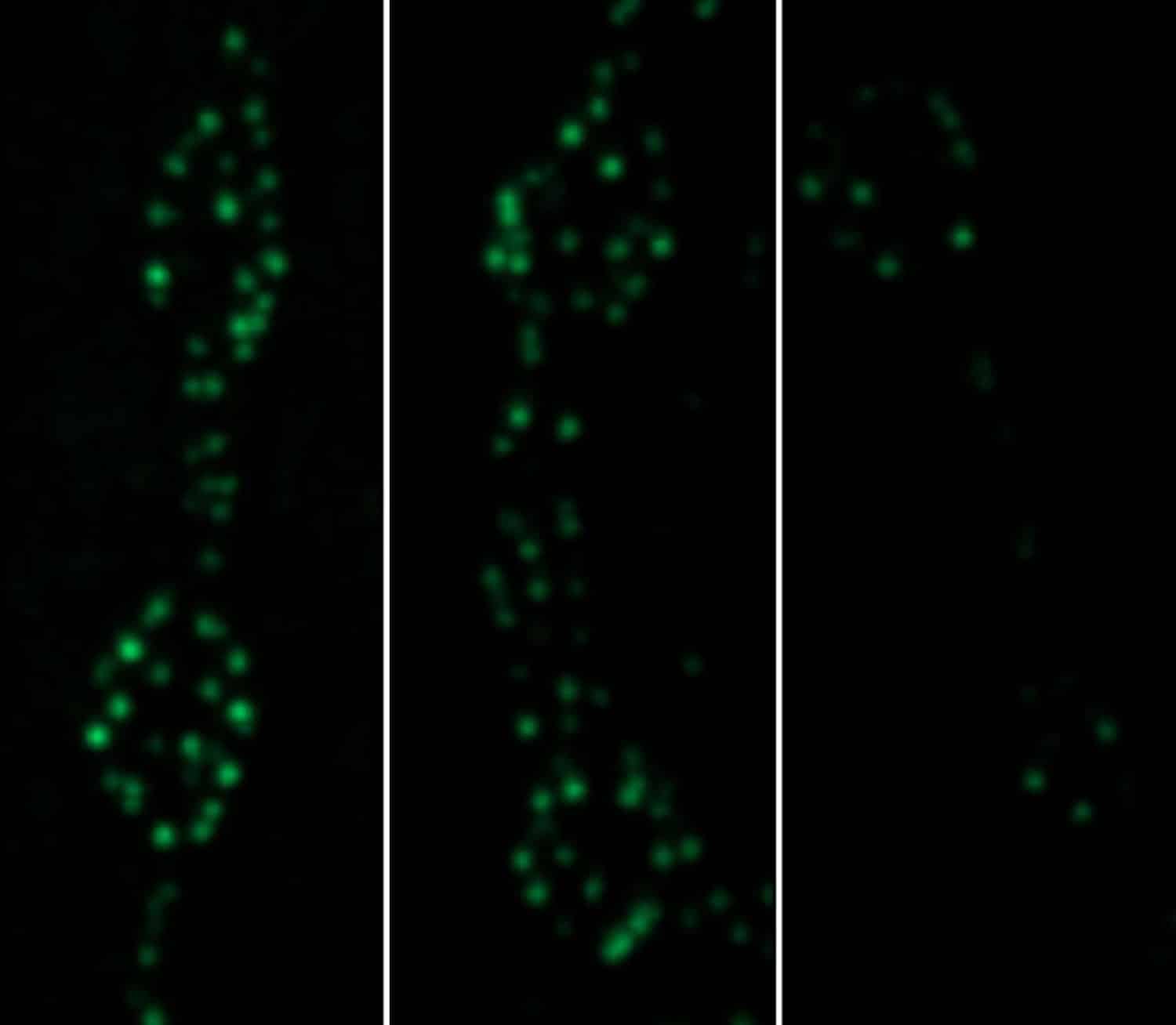
Cunningham valgte et øyeblikk etter noen dager med utvikling å avbilde aktive soner og målte Cac-overflod for å fastslå landskapet. Så bleket hun ut den Cac-fluorescensen for å slette den. Etter 24 timer visualiserte hun Cac-fluorescens på nytt for å fremheve bare den nye Cac-en som ble levert til aktive soner i løpet av de 24 timene.
Hun observerte at Cac ble levert gjennom nesten alle aktive soner den dagen. Likevel var den ene dags arbeid faktisk ubetydelig i forhold til opphopningen fra tidligere dager. Hun så også at større aktive soner akkumulerte mer Cac enn mindre. I tillegg var det knapt noen ny Cac-levering i de endrede alpha2delta-fluemodellene.
Den neste oppgaven var å bestemme i hvilket tempo Cac-kanaler fjernes fra aktive soner. For å gjøre det brukte forskerne en fargeteknikk med et fotokonverterbart protein kalt Maple merket med Cac-proteinet. Dette tillot dem å endre fargen med et lysglimt på hennes valgte tidspunkt.
Å gjøre det viser hvor mye Cac som er akkumulert innen en bestemt tid (vist i grønt), og deretter blinker lyset for å gjøre den Cac rød. Etter fem dager hadde nesten 30 prosent av den røde Cac blitt erstattet med ny grønn Cac. Denne Cac-omsetningen stoppet da Cac-leveringsnivåene ble redusert ved å mutere alpha2 delta eller redusere Cac-biosyntesen.
Cunningham sa: "Det betyr at en betydelig mengde Cac omsettes hver dag i aktive soner, og at omsetningen skyldes ny Cac-levering."
Littleton sa, "Nå som reglene for kalsiumkanaloverflod og påfyll er klare, vil jeg vite hvordan de skiller seg når nevroner gjennomgår plastisitet - for eksempel når ny innkommende informasjon krever at nevroner justerer kommunikasjonen for å skalere opp eller ned synaptisk kommunikasjon."
"Jeg er også ivrig etter å spore individuelle kalsiumkanaler når de lages i cellekroppen og deretter bevege meg nedover det nevrale aksonet til de aktive sonene, og han ønsker å finne ut hvilke andre gener som kan påvirke Cac-overflod."
Tidsreferanse:
- Karen L Cunningham, Chad W Sauvola, Sara Tavana, J Troy Littleton. Regulering av presynaptisk Ca2+-kanaloverflod i aktive soner gjennom en balanse mellom levering og omsetning. Neuroscience. GJØR JEG: 10.7554 / eLife.78648