Glejak wielopostaciowy (GBM) jest najbardziej śmiercionośną i najbardziej agresywną postacią raka mózgu. Prawie wszystkie nowotwory po leczeniu nawracają, ponieważ komórki, które przeżyły, z czasem przekształcają się w bardziej odporne formy, odporne na dalsze terapie. Aby sprostać temu wyzwaniu, naukowcy z Uniwersytet w Leeds zaprojektowali nowatorską nanopipetę o podwójnym cylindrze i wykorzystali ją do badania trajektorii poszczególnych żywych komórek GBM w miarę ich zmian w odpowiedzi na leczenie.
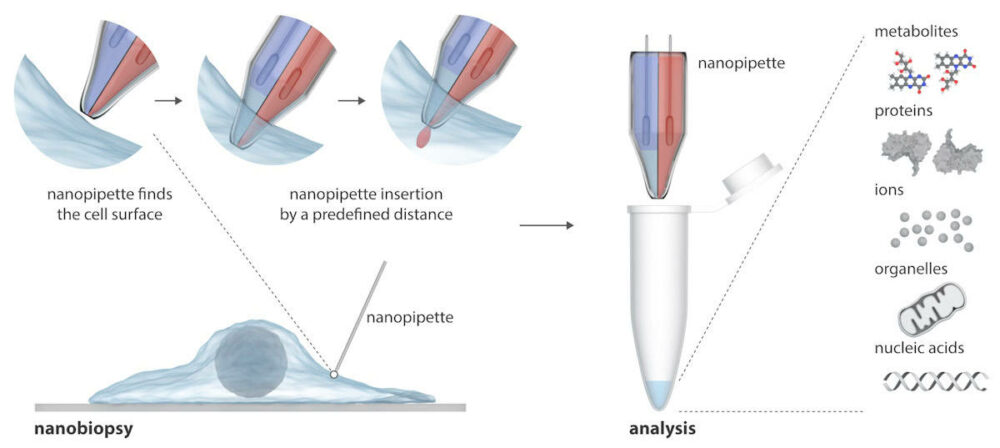
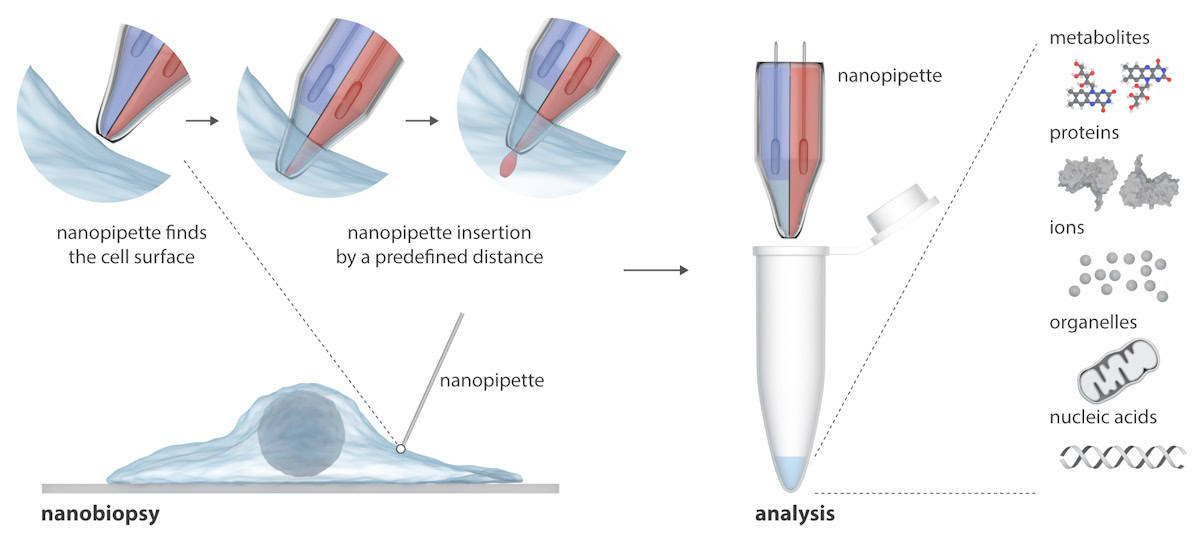
Nanopipeta składa się z dwóch nanoskopowych igieł, które mogą jednocześnie wstrzykiwać egzogenne cząsteczki do komórki i pobierać próbki cytoplazmy z komórki. Nanopipeta jest zintegrowana ze skaningowym mikroskopem przewodnictwa jonowego (SICM) w celu wykonywania nanobiopsji żywych komórek w hodowli. W przeciwieństwie do istniejących technik badania pojedynczych komórek, które zwykle niszczą komórkę, nanopipeta może wykonywać wielokrotne biopsje żywej komórki bez jej zabijania, umożliwiając podłużne badania zachowania pojedynczej komórki w czasie.
Pisanie w Postępy naukinaukowcy wyjaśniają, że SICM działa poprzez pomiar prądu jonowego pomiędzy elektrodą umieszczoną w szklanej nanopipecie a elektrodą odniesienia zanurzoną w roztworze elektrolitu zawierającym ogniwa. Nanobiopsję wykonuje się, gdy prąd jonowy przepływa przez nanopor na końcu nanopipety po przyłożeniu napięcia pomiędzy dwiema elektrodami. W ich dwubębenkowej nanopipecie jedna beczka działa jak elektrochemiczna strzykawka do przeprowadzania ekstrakcji cytoplazmatycznej; druga zawiera wodny roztwór elektrolitu, który zapewnia stabilny prąd jonowy do precyzyjnego pozycjonowania i nanoiniekcji przed nanobiopsją.
Półautomatyczna platforma umożliwia ekstrakcję femtolitrowych objętości cytoplazmy i jednoczesne wstrzykiwanie do poszczególnych komórek. Platforma zapewnia automatyczne pozycjonowanie nanopipety wykorzystując kontrolę sprzężenia zwrotnego (prąd jonowy spada w momencie zbliżenia nanopipety do próbki), a wykrycie poszczególnych sygnatur prądu wskazuje na pomyślną penetrację błony pojedynczej komórki.
Badania podłużne
Aby potwierdzić koncepcję możliwości platformy, naukowcy przeprowadzili podłużną nanobiopsję komórki GBM (i jej potomstwa), profilując zmiany ekspresji genów w ciągu 72 godzin. Przeprowadzili nanobiopsję przed terapią, w trakcie radioterapii i chemioterapii oraz po leczeniu.
„Nasza metoda jest solidna i powtarzalna, umożliwia penetrację błon i nanoiniekcję do różnych typów komórek o różnych właściwościach mechanicznych” – piszą współkierownicy badaczy Lucy Steady i Paolo Actisa. „Średni wskaźnik powodzenia nanoiniekcji wynosi 0.89 ± 0.07. Następnie ekstrahuje się wewnątrzkomórkowy mRNA.”
Naukowcy zbadali reakcję komórek GBM na standardowe leczenie 2 Gy promieniowania i 30 µM temozolomidu. Wizualnie śledzili poszczególne komórki i ich potomstwo przez 72 godziny, przy czym 98% z nich pozostawało w tym czasie w polu widzenia mikroskopu, co było ważnym czynnikiem przy przeprowadzaniu analizy podłużnej.
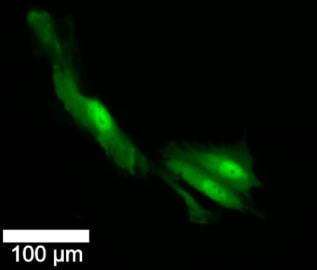
Pierwszego dnia naukowcy wykonali biopsję, wstrzyknęli barwnik fluorescencyjny i zobrazowali każdą komórkę. Drugiego dnia połowa komórek została poddana napromienianiu i chemioterapii, pozostałe służyły jako kontrola. Wszystkie komórki obrazowano w dniu 1 i 2, a następnie poddano biopsji i wstrzyknięto ponownie w dniu 2.
W komórkach poddanych nanobiopsjom pierwszego dnia przeżycie było podobne w przypadku komórek leczonych i nieleczonych, a tempo podziału komórek było porównywalne w obu grupach. Po 1 godzinach przeżyło 72% nietraktowanych komórek kontrolnych (niepoddanych biopsji) w porównaniu z 63% traktowanych komórek poddanych biopsji. Nie było różnicy w częstości zgonów z powodu podtypów komórek w dniu 25, niezależnie od leczenia. Jednakże znacznie większa część nieleczonych komórek z czasem zmieniła podtyp lub wytworzyła potomstwo o innym podtypie niż komórki leczone.
„To sugeruje, że komórki nietraktowane są znacznie bardziej plastyczne w ciągu trzech dni niż komórki poddane działaniu” – piszą naukowcy. „Wyniki fenotypu komórek w parach próbek z pierwszego dnia i próbek podłużnych ujawniły, że komórki poddane leczeniu mają tendencję do utrzymywania tego samego fenotypu podczas terapii, podczas gdy komórki nieleczone częściej zmieniają stan transkrypcyjny w ciągu 1 godzin, co sugeruje, że leczenie albo indukuje, albo selekcjonuje wysoką stabilność transkrypcyjną w tej ustalonej linii komórkowej GBM.”
„To znaczący przełom” – mówi Stead. „Po raz pierwszy dysponujemy technologią, dzięki której możemy faktycznie monitorować zmiany zachodzące po leczeniu, a nie tylko je zakładać. Tego typu technologia zapewni poziom zrozumienia, jakiego po prostu nigdy wcześniej nie mieliśmy. A to nowe zrozumienie i wgląd doprowadzą do powstania nowej broni w naszym arsenale przeciwko wszelkim rodzajom raka”.
Nanochirurgia mechaniczna atakuje agresywnego raka mózgu
Zespół jest przekonany, że zdolność tych wszechstronnych nanosond do dostępu do środowiska wewnątrzkomórkowego przy minimalnych zakłóceniach może potencjalnie „zrewolucjonizować diagnostykę molekularną oraz terapie genowe i komórkowe”.
„Nasze przyszłe prace skupią się na zwiększeniu przepustowości technologii, aby umożliwić analizę większej liczby komórek” – mówi Actis Świat Fizyki. „Pracujemy nad udoskonaleniem protokołów analizy RNA ekstrahowanego z komórek, aby można było zebrać więcej informacji biologicznych. Jesteśmy również bardzo zainteresowani badaniem bardziej zaawansowanych modeli biologicznych raka mózgu w oparciu o komórki i organoidy pochodzące od pacjentów”.
- Dystrybucja treści i PR oparta na SEO. Uzyskaj wzmocnienie już dziś.
- PlatoData.Network Pionowe generatywne AI. Wzmocnij się. Dostęp tutaj.
- PlatoAiStream. Inteligencja Web3. Wiedza wzmocniona. Dostęp tutaj.
- PlatonESG. Węgiel Czysta technologia, Energia, Środowisko, Słoneczny, Gospodarowanie odpadami. Dostęp tutaj.
- Platon Zdrowie. Inteligencja w zakresie biotechnologii i badań klinicznych. Dostęp tutaj.
- Źródło: https://physicsworld.com/a/single-cell-nanobiopsy-explores-how-brain-cancer-cells-adapt-to-resist-treatment/
- :Jest
- :nie
- :Gdzie
- 07
- 1
- 30
- 72
- 89
- a
- zdolność
- AC
- dostęp
- w poprzek
- Dzieje Apostolskie
- faktycznie
- przystosować
- adres
- zaawansowany
- Po
- potem
- ponownie
- przed
- agresywny
- Cel
- Wszystkie kategorie
- Pozwalać
- prawie
- również
- an
- Analizować
- analiza
- i
- Stosowanie
- awanse
- SĄ
- AS
- założyć
- At
- Ataki
- zautomatyzowane
- średni
- na podstawie
- BE
- zanim
- zachowanie
- pomiędzy
- Mózg
- rak mózgu
- przełom
- by
- CAN
- Rak
- Komórki nowotworowe
- komórka
- Komórki
- wyzwanie
- zmiana
- Zmiany
- kliknij
- porównywalny
- w porównaniu
- przeprowadzone
- składa się
- zawiera
- kontrola
- kontroli
- przekonany
- Kurs
- kultura
- Aktualny
- dzień
- Śmierć
- zaprojektowany
- zniszczyć
- Wykrywanie
- diagnostyka
- różnica
- różne
- Zakłócać
- Zakłócenie
- odrębny
- podzielony
- podział
- Krople
- podczas
- barwnik
- każdy
- bądź
- elektrolit
- Umożliwia
- umożliwiając
- Środowisko
- ustanowiony
- Przede wszystkim system został opracowany
- Wyjaśniać
- odkrywa
- wyrażenie
- wyciąg
- ekstrakcja
- czynnik
- informacja zwrotna
- i terminów, a
- pierwszy raz
- Przepływy
- Skupiać
- W razie zamówieenia projektu
- wytrzymałość
- Nasz formularz
- formularze
- FRAME
- od
- dalej
- przyszłość
- zebrane
- szkło
- będzie
- Grupy
- miał
- Pół
- Have
- Wysoki
- posiada
- W jaki sposób
- Jednak
- HTTPS
- obraz
- zdjęcia
- zanurzony
- ważny
- podnieść
- in
- wzrastający
- wskazuje
- indywidualny
- indukuje
- infografika
- Informacja
- wstrzykiwać
- wgląd
- zintegrowany
- najnowszych
- badać
- Śledczy
- niezależny
- problem
- IT
- JEGO
- jpg
- właśnie
- Zapalony
- zabicie
- większe
- warstwa
- prowadzić
- Prawdopodobnie
- Linia
- życie
- utrzymać
- Maksymalna szerokość
- zmierzenie
- mechaniczny
- metoda
- Mikroskop
- minimalny
- modele
- Cząsteczkowa
- monitor
- jeszcze
- większość
- mRNA
- dużo
- nanopory
- nigdy
- Nowości
- Nie
- powieść
- of
- on
- ONE
- koncepcja
- or
- Pozostałe
- ludzkiej,
- koniec
- sparowany
- szczególny
- ścieżki
- penetracja
- wykonać
- wykonywane
- Fizyka
- Świat Fizyki
- Miejsce
- Plastikowy
- Platforma
- Platformy
- plato
- Analiza danych Platona
- PlatoDane
- pozycjonowanie
- Post
- potencjał
- precyzyjny
- Wcześniejszy
- Wytworzony
- Profilowanie
- niska zabudowa
- odsetek
- protokoły
- zapewniać
- zapewnia
- Radioterapia
- Kurs
- ceny
- raczej
- Odebrane
- odniesienie
- pozostały
- powtórzony
- Badacze
- sprężysty
- odpowiedź
- Ujawnił
- RNA
- krzepki
- taki sam
- próba
- mówią
- skanowanie
- nauka
- Naukowcy
- wyniki
- druga
- wybiera
- służył
- seans
- Podpisy
- znaczący
- znacznie
- podobny
- po prostu
- jednocześnie
- pojedynczy
- So
- rozwiązanie
- specyficzny
- Stabilność
- stabilny
- standard
- Stan
- Struktury
- badania naukowe
- Badanie
- Studiowanie
- kolejny
- sukces
- udany
- Wskazuje
- przetrwanie
- Przetrwał
- Przełącznik
- przełączane
- Brać
- biorąc
- kierowania
- zespół
- technika
- Techniki
- Technologia
- mówi
- Tendencję
- niż
- że
- Połączenia
- ich
- Im
- następnie
- terapie
- terapia
- Tam.
- Te
- one
- to
- trzy
- trzy dni
- Przez
- wydajność
- miniatur
- czas
- typ
- do
- Przekształcać
- leczony
- leczenie
- prawdziwy
- drugiej
- rodzaj
- typy
- Uk
- zrozumienie
- przeszedł
- uniwersytet
- w odróżnieniu
- używany
- zastosowania
- za pomocą
- zazwyczaj
- wszechstronny
- początku.
- naocznie
- Napięcie
- kłęby
- była
- we
- Bronie
- były
- jeśli chodzi o komunikację i motywację
- który
- Podczas
- będzie
- w
- bez
- Praca
- pracujący
- działa
- świat
- napisać
- zefirnet