Termoradioterapia to leczenie raka, w którym hipertermia – podgrzanie guza do temperatury powyżej temperatury ciała – jest stosowana w celu zwiększenia skuteczności radioterapii. Wielkość tego wzmocnienia jest wyrażona jako EQDRTrównoważną dawkę promieniowania potrzebną do osiągnięcia tego samego efektu terapeutycznego bez ogrzewania.
Badania kliniczne wykazały, że takie podejście może znacznie poprawić wyniki leczenia kilku typów nowotworów, bez zwiększania toksyczności dla normalnej tkanki. Wcześniejsze badania wykazały również, że zarówno osiągnięta temperatura, jak i odstęp czasu między radioterapią a hipertermią mają wpływ na wynik kliniczny.
Aby dokładniej zrozumieć ten proces i pomóc zoptymalizować leczenie, naukowcy z UMC w Amsterdamie wykorzystali modelowanie biologiczne do zbadania wpływu maksymalnej temperatury i przedziału czasu na EQDRT. Opisując swoje ustalenia w International Journal of Radiation Oncology Biology Physicsdonoszą, że zarówno wysokie temperatury, jak i krótkie odstępy czasu są niezbędne do maksymalizacji wzmocnienia terapeutycznego.
Model biologiczny
Aby przeprowadzić termoradioterapię, klinicyści używają urządzenia o częstotliwości radiowej lub mikrofalowego do ogrzewania guza raz lub dwa razy w tygodniu, przed lub po sesji radioterapii. Temperatura guza jest utrzymywana poniżej 45°C, aby zapobiec nagrzaniu normalnej tkanki, ale czasami mogą wystąpić niechciane (i bolesne) gorące punkty, które ograniczają maksymalny tolerowany poziom mocy, jaki można zastosować podczas leczenia hipertermią.
Pierwszy autor Petra Kok i współpracownicy opracowali oprogramowanie do modelowania biologicznych skutków radioterapii i hipertermii pod względem równoważnych rozkładów dawek. Model, który uwzględnia hamowanie naprawy DNA przez hipertermię, a także bezpośrednią cytotoksyczność indukowaną ciepłem, umożliwia ocenę jakości połączonych planów leczenia przy użyciu standardowych histogramów dawka-objętość.
Aby uzyskać podstawowy wgląd w wpływ parametrów hipertermii, zespół najpierw obliczył wzmocnienie standardowego rozkładu dawki 23 × 2 Gy przez jednorodne temperatury między 37 a 43 ° C, w przedziałach czasowych od 0 do 4 godzin.
Model pokazał, że EQDRT znacznie wzrastała zarówno wraz ze wzrostem temperatury, jak i malejącym przedziałem czasu. Na przykład dla 1-godzinnego przedziału czasu przewidywał EQDRT wzrost o 2–15 Gy dla temperatur od 39 do 43°C. Odkrycia te podkreślają znaczenie osiągnięcia najwyższej tolerowanej temperatury guza w celu optymalizacji wyników klinicznych.
Wpływ przedziału czasowego był najbardziej wyraźny w wyższych temperaturach (powyżej 41°C). W typowej temperaturze hipertermicznej 41.5°C, EQDRT wzrost o około 10 Gy uzyskano w odstępie czasu 0 h. Zmniejszyło się to do wzmocnienia około 4 Gy w odstępie 4 godzin, co wskazuje, że wraz ze wzrostem przedziału czasu potrzebna jest wyższa temperatura, aby uzyskać ten sam efekt.
Przypadki kliniczne
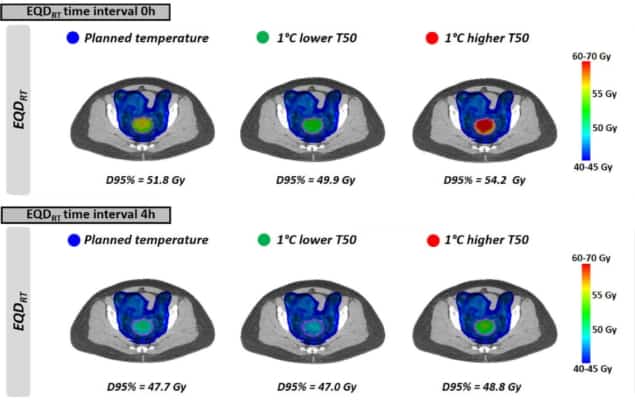
Następnie naukowcy ocenili realistyczne scenariusze leczenia w oparciu o niejednorodne rozkłady temperatur i kliniczne plany radioterapii. Obliczyli EQDRT dla 10 pacjentek z miejscowo zaawansowanym rakiem szyjki macicy. Wszyscy pacjenci otrzymywali 23 × 2 Gy terapii łukiem modulowanym objętościowo (VMAT), z hipertermią stosowaną co tydzień w trakcie leczenia.
Jak widać przy jednolitych temperaturach, EQDRT była największa dla najmniejszego przedziału czasu. Gdy hipertermię stosowano bezpośrednio przed lub po radioterapii (przedział czasu 0 h), średni EQDRT do 95% objętości (D95%) wyniosło 51.7 Gy – wzrost o 6.3 Gy w stosunku do samego promieniowania. Wydłużenie odstępu czasowego do 4 h zmniejszyło ten przyrost do 2.2 Gy.
Model przewidywał, że większość zwiększenia dawki zostanie utracona w ciągu pierwszej godziny. Dlatego w zastosowaniach klinicznych czas między radioterapią a podaniem hipertermii powinien być jak najkrótszy – najlepiej w przypadku pacjentów otrzymujących oba rodzaje leczenia w tym samym szpitalu. Zespół zauważa, że chociaż kolejność dwóch zabiegów nie ma znaczenia klinicznego, ponieważ ogrzanie guza wymaga czasu, zastosowanie najpierw hipertermii może pozwolić na znacznie krótsze odstępy czasowe, nawet bliskie 0 godzin.
Na koniec naukowcy modelowali wpływ osiągnięcia nieco niższych temperatur guza niż planowano, ze względu na występowanie ograniczających leczenie gorących punktów. Wpływ na EQDRT była najbardziej widoczna w krótkim odstępie czasu między radioterapią a hipertermią. Na przykład dla temperatury niższej o 1°C i przedziału czasu 0 h, średnia przewidywana EQDRT(D95%) zmniejszyła się o 1.8 Gy (z 51.7 do 49.9 Gy); w odstępie 4 godzin spadek wyniósł około 0.7 Gy.
Radioterapia jest skuteczniejsza w guzach rozgrzanych
W przypadkach, gdy nie pojawiają się żadne gorące punkty, może być możliwe zwiększenie mocy wyjściowej i osiągnięcie wyższej temperatury niż planowano. Po raz kolejny korzyści z osiągnięcia wyższej temperatury były największe w krótszych odstępach czasu, przy czym dokładne wzmocnienie zależało od rzeczywistych osiągniętych temperatur.
„Modelowanie biologiczne zapewnia odpowiedni wgląd w związek między parametrami leczenia a oczekiwaną EQDRT”, podsumowują Kok i współpracownicy. „Zarówno wysokie temperatury, jak i krótkie odstępy czasu są niezbędne do maksymalizacji EQDRT.