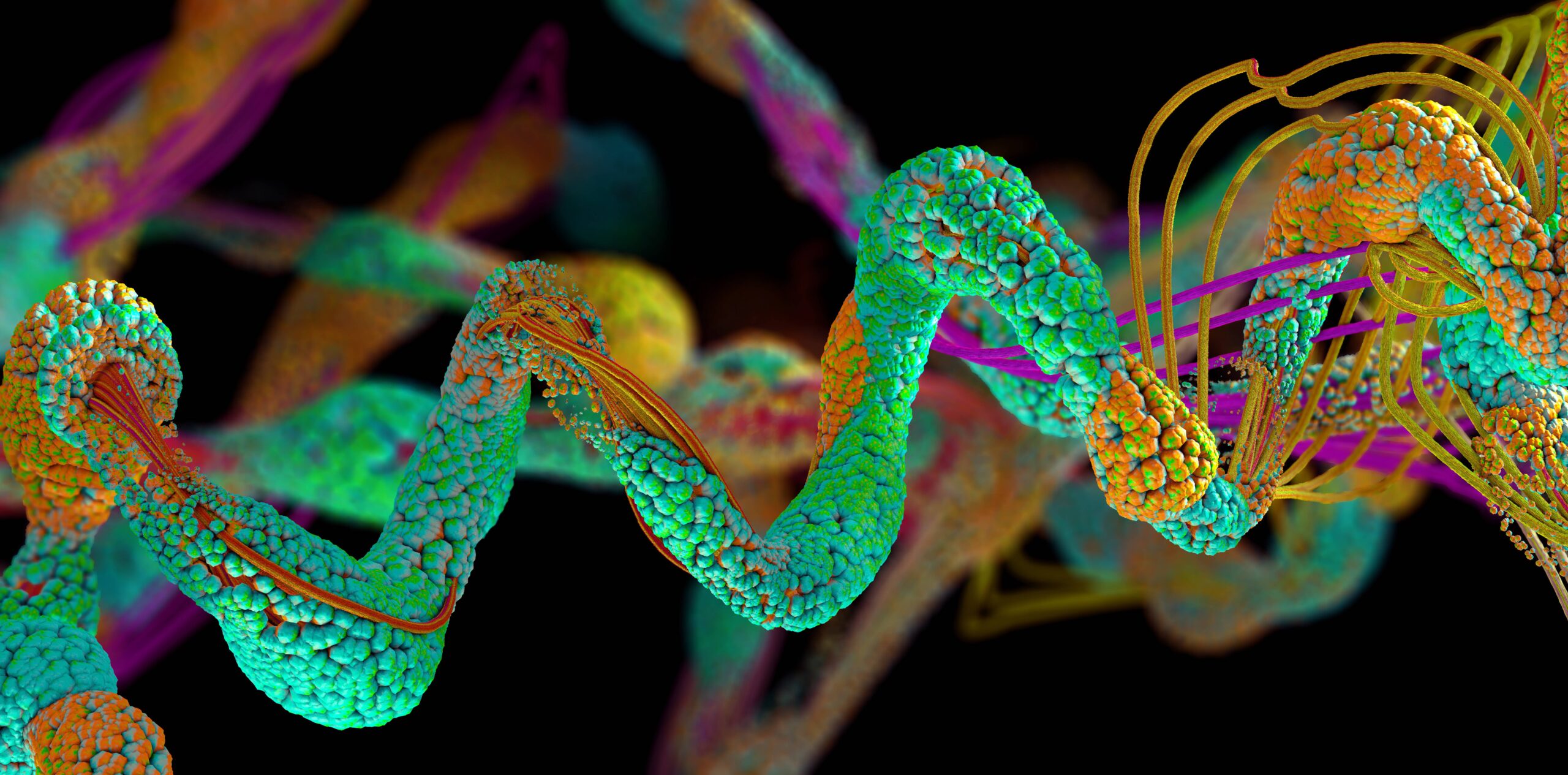
Oparty na sztucznej inteligencji model fałdowania białek AlphaFold przewidział ponad 200 milionów białek, prawie wszystkie takie struktury znane nauce, powiedział DeepMind w czwartek.
Białka to złożone cząsteczki biologiczne wytwarzane w żywych organizmach na podstawie instrukcji przechowywanych w DNA. Zbudowane z aż 20 rodzajów aminokwasów, te łańcuchy w skali nano wykonują ważne zadania komórkowe, aby wykonywać wszelkiego rodzaju funkcje organizmu. Znajomość trójwymiarowej formy białek jest ważna, ponieważ ich fizyczna struktura dostarcza wskazówek, jak się zachowuje i jakiemu celowi służy, co pomaga nam robić takie rzeczy, jak opracowywanie leków i tworzenie białek kopiujących dla tych, którzy ich nie mają.
Niektóre białka są pomocne, na przykład te zaangażowane w trawienie żywności, podczas gdy inne mogą być szkodliwe, na przykład te zaangażowane w rozwój nowotworów. Jednak odgadnięcie ich skomplikowanych, wijących się kształtów jest trudne. Biolodzy molekularni mogą spędzić lata na przeprowadzaniu eksperymentów w celu rozszyfrowania struktury białka, a AlphaFold może to zrobić w ciągu kilku minut, w zależności od wielkości cząsteczki na podstawie składu aminokwasów.
AlphaFold został przeszkolony na setkach tysięcy znanych struktur białkowych i poznał relacje między składowymi aminokwasami a ostatecznymi kształtami ogólnymi. Biorąc pod uwagę dowolną wejściową sekwencję aminokwasową, model może przewidzieć strukturę białka 3D. Teraz model przewidział prawie wszystkie struktury białkowe znane nauce.
Współpracując z Europejskim Instytutem Bioinformatyki, DeepMind rozszerzył swoją Baza danych struktur białek AlphaFold zawierać ponad 200 milionów trójwymiarowych kształtów białek od zwierząt po rośliny, od bakterii po wirusy – ponad 3-krotny wzrost z prawie miliona cząsteczek do co najmniej 200 milionów cząsteczek w ciągu zaledwie roku.
„Mieliśmy nadzieję, że ten przełomowy zasób pomoże przyspieszyć badania naukowe i odkrycia na całym świecie oraz że inne zespoły będą mogły uczyć się i wykorzystywać postępy, które poczyniliśmy w AlphaFold, aby tworzyć kolejne przełomy” – Demis Hassibis, współzałożyciel i dyrektor generalny DeepMind, powiedziany w oświadczeniu czwartek.
„Ta nadzieja stała się rzeczywistością znacznie szybciej, niż odważyliśmy się marzyć. Zaledwie dwanaście miesięcy później do AlphaFold skorzystało ponad pół miliona naukowców i wykorzystano je do przyspieszenia postępów w ważnych rzeczywistych problemach, od zanieczyszczenia plastikiem po oporność na antybiotyki”.
Rejestr poprosił DeepMind o dalszy komentarz.
AlphaFold wykazał również duży potencjał w zakresie projektowania nowych leków. Struktury pomagają naukowcom w określeniu związków chemicznych, które mogą wiązać się z docelowymi białkami, aby leczyć je lub uniemożliwiać im wykonywanie patologicznych funkcji. Firmy, w tym Insilco Medicine, mają eksperymentować z modelem odkrywania nowych leków; CEO Alex Zhavoronkov powiedział Rejestr że proces jest znacznie bardziej skomplikowany niż mogłoby się wydawać i obejmuje kilka kroków.
Nie jest jasne, jak dokładne są przewidywania AlphaFold. Struktura przypominająca wstążkę białka często zmienia kształt, gdy wchodzi w interakcję z lekiem, w czym AlphaFold nie może pomóc naukowcom, ponieważ nie jest w tym przeszkolony. Zhavoronkov powiedział, że model jest „dość niezwykłym przełomem”, ale uważał na cały szum.
„Dopóki nie zobaczymy struktury nowego celu w dużej chorobie uzyskanej za pośrednictwem AlphaFold bez żadnych dodatkowych eksperymentów, cząsteczkę zaprojektowaną przy użyciu sztucznej inteligencji – lub innych metod – przy użyciu tej przewidywanej struktury, zsyntetyzowaną i przetestowaną przez cały czas, a następnie opublikowaną w wysokim czasopiśmie – [możemy] wtedy świętować.”
Duża farmacja chce, aby cząsteczki zaprojektowane za pomocą narzędzi AI, takich jak AlphaFold, były rzeczywiście testowane na myszach i ludziach. „Czyste osiągnięcia algorytmiczne nie są cenne dla firm farmaceutycznych, a zwłaszcza dla pacjentów” – dodał Zhavoronkov.
Fabio Urbina, starszy naukowiec w Collaboration Pharmaceuticals, startupie wykorzystującym algorytmy uczenia maszynowego do opracowywania leków na rzadkie choroby genetyczne, powiedział, że AlphaFold nie okazał się jeszcze przydatny w jego badaniach. Urbina wykorzystuje inną technikę i skupia się bardziej na strukturze potencjalnego nowego leku niż na docelowym białku.
Nie wiadomo jeszcze, czy struktury białkowe będą wystarczająco przydatne… aby pomóc nam odkryć nowe potencjalne leki na rzadkie choroby
„Dzieje się tak z kilku powodów; struktury białkowe dla wielu celów leków często nie były łatwo dostępne dla naukowców, a informacje o białkach nie wydawały się pomagać wczesnym modelom uczenia maszynowego poprawić ich moc predykcyjną o znaczny margines” – powiedział Rejestr.
„Jestem ostrożnym optymistą, że AlphaFold zasadniczo„ rozwiązał ” pierwszy problem, ale jeszcze nie wiadomo, czy struktury białkowe będą wystarczająco przydatne dla naszego dalszego zastosowania poprawy zdolności predykcyjnej uczenia maszynowego, aby pomóc nam odkryć nowe potencjalne leki na rzadkie choroby. Jednak coraz częściej zauważamy, że informacje o strukturze białek są brane pod uwagę w ramach nowszych metod uczenia maszynowego i myśleliśmy o zrobieniu tego samego”.
Utworzenie bazy danych z prawie wszystkimi znanymi strukturami białkowymi, jak obiecał DeepMind, oznacza, że więcej naukowców będzie miało zasoby do eksperymentowania i budowania potężniejszych modeli AI, powiedział Urbina. „Jestem ostrożnym optymistą, ale biorąc pod uwagę całą dostępną bibliotekę struktur białkowych, powiedziałbym, że istnieje duża szansa, że struktury AlphaFold zostaną włączone do niektórych naszych modeli uczenia maszynowego i mogą ostatecznie pomóc nam odkryć nowe terapie. ” ®
- AI
- ai sztuka
- generator sztuki ai
- masz robota
- sztuczna inteligencja
- certyfikacja sztucznej inteligencji
- sztuczna inteligencja w bankowości
- robot sztucznej inteligencji
- roboty sztucznej inteligencji
- oprogramowanie sztucznej inteligencji
- blockchain
- konferencja blockchain ai
- pomysłowość
- sztuczna inteligencja konwersacyjna
- konferencja kryptograficzna
- Dall's
- głęboka nauka
- google to
- uczenie maszynowe
- plato
- Platon Ai
- Analiza danych Platona
- Gra Platona
- PlatoDane
- platogaming
- skala ai
- składnia
- Rejestr
- zefirnet