Introducere
Descoperirea din timpul Proiectului Genomului Uman, la începutul anilor 2000, că noi, oamenii, avem doar aproximativ 20,000 de gene care codifică proteine - cam la fel de multe ca micul vierme nematod care locuiește în sol și mai puțin de jumătate decât planta de orez - a fost un șoc. . Această lovitură adusă mândriei noastre a fost atenuată, totuși, de ideea că genomul uman este bogat în conexiuni de reglementare. Genele noastre interacționează într-o rețea densă, în care bucăți de ADN și moleculele pe care le codifică (ARN și proteine) controlează „expresia” altor gene, influențând dacă acestea își produc ARN-ul și proteinele respective. Pentru a înțelege genomul uman, trebuia să înțelegem acest proces de reglare a genelor.
Această sarcină, totuși, se dovedește a fi mult mai dificilă decât decodarea secvenței genomului.
Inițial, s-a bănuit că reglarea genelor a fost o simplă chestiune a unui produs genetic care acționează ca un comutator pornit/oprit pentru o altă genă, în mod digital. În anii 1960, biologii francezi François Jacob și Jacques Monod au elucidat pentru prima dată un proces de reglare a genelor în detaliu mecanic: În Escherichia coli bacterii, atunci când o proteină represoare se leagă de un anumit segment de ADN, blochează transcripția și traducerea unei suită adiacente de gene care codifică enzime pentru digerarea zahărului lactozei. Acest circuit de reglementare, pe care Monod și Jacob l-au numit lac operon, are o logică îngrijită, transparentă.
Dar reglarea genelor în metazoare complexe - animale precum oamenii, cu celule eucariote complexe - nu pare să funcționeze în general în acest fel. În schimb, implică o grupă de molecule, inclusiv proteine, ARN-uri și bucăți de ADN din întregul cromozom, care colaborează cumva pentru a controla expresia unei gene.
Nu este doar faptul că acest proces de reglare la eucariote are mai mulți jucători decât se vede în mod obișnuit în bacterii și alte celule simple, procariote; pare a fi un proces categoric diferit și unul mai tulbure.
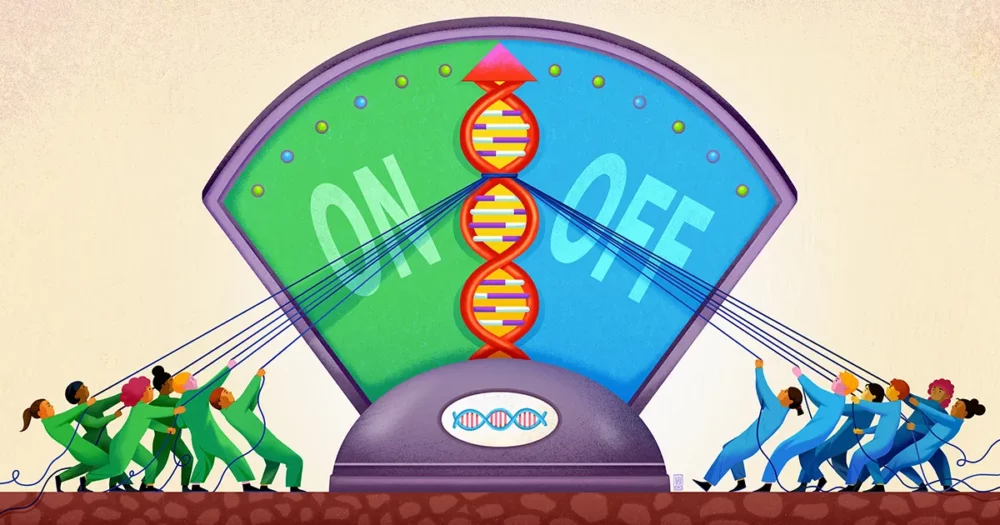
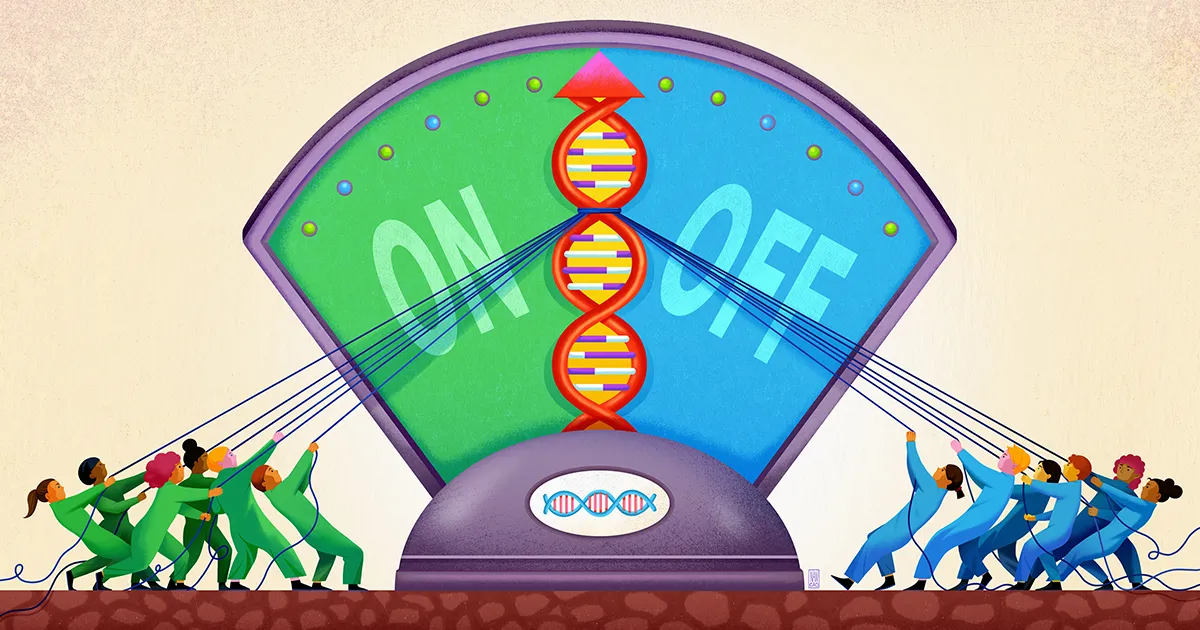
O echipă de la Universitatea Stanford, condusă de biofizician și bioinginer Polly Fordyce, pare să fi descoperit acum o componentă a acestui mod neclar de reglare a genelor. Munca lor, publicat în septembrie anul trecut în Ştiinţă, sugerează că ADN-ul din apropierea unei gene acționează ca un fel de fântână superficială pentru captarea diverselor molecule de reglementare, menținându-le pregătite pentru acțiune, astfel încât, atunci când este necesar, să își poată adăuga vocea la decizia cu privire la activarea genei.
Introducere
Aceste puțuri de reglare sunt făcute din porțiuni de ADN cu totul ciudate. Ele constau din secvențe în care o porțiune scurtă de ADN, lungă de la una până la șase perechi de baze, se repetă de mai multe ori. Zeci de copii ale acestor „repetări scurte în tandem” (STR) pot fi înșirate împreună în aceste secvențe, ca același „cuvânt” mic scris din nou și din nou.
STR-urile sunt abundente în genomul uman: ele cuprind aproximativ 5% din tot ADN-ul nostru. Se credeau cândva că sunt exemple clasice de ADN „nedorit”, deoarece un „text” ADN repetitiv format doar din STR-uri nu poate conține aproape la fel de multe informații semnificative ca, de exemplu, succesiunea neregulată de litere care alcătuiesc o propoziție în acest articol. articol.
Și totuși, STR-urile nu sunt în mod clar nesemnificative: au fost legate de afecțiuni precum boala Huntington, atrofia musculară spinobulbară, boala Crohn și unele tipuri de cancer. În ultimele două decenii, s-au acumulat dovezi că acestea pot îmbunătăți sau inhiba cumva reglarea genelor. Misterul era cum puteau fi atât de puternici cu atât de puțin conținut de informații.
Controale complexe pentru celule complexe
Pentru a înțelege cum se încadrează STR-urile în imaginea de ansamblu a reglării genelor, să facem un pas înapoi. Genele sunt în mod obișnuit flancate de bucăți de ADN care nu codifică ARN sau proteine, dar au funcții de reglare. Genele bacteriene au regiuni „promotoare” în care enzimele polimerazei se pot lega pentru a începe transcripția ADN-ului adiacent în ARN. De asemenea, au în mod obișnuit regiuni „operatoare”, unde proteinele represoare se pot lega pentru a bloca transcripția, dezactivând o genă, ca în cazul lac operon.
La oameni și la alte eucariote, secvențele de reglare pot fi mai numeroase, mai diverse și mai nedumerite. Regiunile numite amplificatori, de exemplu, afectează probabilitatea ca o genă să fie transcrisă. Amplificatorii sunt adesea ținte pentru proteine numite factori de transcripție, care se pot lega pentru a stimula sau inhiba expresia genelor. În mod ciudat, unii amplificatori se află la zeci de mii de perechi de baze de genele pe care le reglează și sunt apropiați de ele doar prin rearanjarea fizică a buclelor de ADN dintr-un cromozom compact.
Reglarea genelor eucariote implică în mod obișnuit aceste multe blocuri de reglementare diverse ale ADN-ului, împreună cu unul sau mai mulți factori de transcripție și alte molecule, toate adunându-se în jurul unei gene ca un comitet reunit pentru a decide ce ar trebui să facă. Se adună într-un grup dens și liber.
Adesea, participanții moleculari, de asemenea, nu par să interacționeze prin perechile extrem de selective „blocare și cheie” comune în biologia moleculară. În schimb, sunt mult mai puțin pretențioși, interacționând destul de slab și neselectiv, de parcă rătăcesc și inițiază conversații scurte unul cu celălalt.
De fapt, modul în care factorii de transcripție se leagă de ADN la eucariote a fost un mister. S-a presupus mult timp că o parte a unui factor de transcripție trebuie să se potrivească îndeaproape cu o secvență „motiv” obligatorie din ADN, ca piesele unui puzzle. Dar, deși unele astfel de motive au fost identificate, prezența lor nu se corelează întotdeauna foarte bine cu locul în care oamenii de știință găsesc factori de transcripție lipiți de ADN-ul din celule. Uneori, factorii de transcripție persistă în regiuni fără niciun motiv, în timp ce unele motive care par să se lege puternic de factorii de transcripție rămân goale.
„În mod tradițional, în genomică, scopul a fost de a clasifica site-urile genomice într-un mod [binar] ca „legat” sau „nelegat” prin factori de transcripție, a spus Fordyce. „Dar imaginea este mult mai nuanțată decât atât.” Membrii individuali ai acelor „comitete” de reglementare a genelor nu par să fie în mod invariabil prezenți sau absenți de la întâlnirile lor, ci mai degrabă au probabilități diferite de a fi acolo sau nu.
Tendința reglării genelor la eucariote de a se baza pe atât de multe interacțiuni slabe diverse între complexe moleculare mari „este unul dintre lucrurile care face notoriu de dificil să se abordeze teoretic”, a spus biofizicianul. Thomas Kuhlman de la Universitatea din California, Riverside, care a scris un comentariu pe hârtia laboratorului Fordyce pentru Ştiinţă. Este un puzzle profund cum, din acest proces aparent haotic, ies decizii precise cu privire la activarea și dezactivarea genelor.
Dincolo de logica neclară misterioasă a procesului de decizie, există și întrebarea cum toți membrii comitetului își găsesc chiar drumul către camera potrivită - și apoi rămân acolo. Moleculele se mișcă, în general, în jurul celulei prin difuzie, lovite de toate celelalte molecule din jur, cum ar fi apa, și rătăcind în direcții aleatorii. Ne-am putea aștepta ca aceste comitete libere să se despartă prea repede pentru a-și face treaba de reglementare.
Acesta, cred Fordyce și colegii ei, este locul unde intervin STR-urile. STR-urile sunt izbitor de comune în cadrul site-urilor de amplificare de pe ADN. În lucrarea lor, cercetătorii susțin că STR-urile acționează ca pete lipicioase care convoacă factorii de transcripție și îi împiedică să se rătăcească.
Reglarea fină a aderenței
Grupul lui Fordyce a investigat sistematic modul în care diferențele în secvența STR influențează lipirea factorilor de transcripție de un motiv de legare. Ei au analizat doi factori - unul de la drojdie, unul de la oameni - care se lipesc de un anumit motiv de șase baze. Cercetătorii au măsurat atât puterea (sau afinitatea) acelui legare, cât și rata la care factorii de transcripție devin blocați și deblocați (cinetica) atunci când motivul este flancat de un STR în loc de o secvență aleatorie. Pentru comparație, ei s-au uitat la cât de ușor se leagă factorii de STR singur și de o secvență de ADN complet aleatorie.
„Una dintre cele mai mari provocări ale acestui domeniu este de a dezlega nenumăratele variabile care influențează legarea [factorului de transcripție] la o anumită poziție a genomului”, a spus David Suter, biolog molecular la Institutul Federal Elvețian de Tehnologie Lausanne din Elveția. Forma ADN-ului, apropierea de alte segmente de ADN și tensiunea fizică din moleculele de ADN pot juca toate un rol în legarea factorului de transcripție. Valorile acestor parametri diferă probabil la fiecare poziție a genomului și poate, de asemenea, între tipurile de celule și într-o singură celulă de-a lungul timpului la o anumită poziție. „Acesta este un spațiu vast de variabile necunoscute care sunt foarte greu de cuantificat”, a spus Suter.
Introducere
De aceea, experimente bine controlate precum cele ale echipei Stanford sunt atât de utile, a adăugat Kuhlman. De obicei, atunci când cercetătorii trebuie să măsoare interacțiuni slabe ca acestea, au două opțiuni: pot face câteva măsurători foarte detaliate, extrem de precise și pot generaliza din ele, sau pot lua o mulțime de măsurători rapide și murdare și pot folosi complexe matematice. metode statistice pentru deducerea rezultatelor. Dar Fordyce și colegii ei, a spus Kuhlman, au folosit o procedură automată, bazată pe cip microfluidic, pentru a efectua măsurători precise în timpul experimentelor de mare debit „pentru a obține tot ce este mai bun din ambele lumi”.
Echipa de la Stanford a descoperit că diferite secvențe STR pot modifica afinitățile de legare ale factorilor de transcripție la ADN cu un factor de până la 70; ele au uneori mai mult impact asupra legării factorului de transcripție decât schimbarea secvenței motivului de legare în sine. Și efectele au fost diferite pentru cei doi factori de transcripție diferiți pe care i-au analizat.
Deci, STR-urile par capabile să ajusteze capacitatea factorilor de transcripție de a se andoca la un site ADN și, astfel, de a regla o genă. Dar cum, mai exact?
O sală de așteptare lângă o genă
Cercetătorii s-au gândit că partea unui factor de transcripție care leagă ADN-ul ar putea interacționa slab cu un STR, cu puterea exactă a acelei afinități în funcție de secvența STR. Deoarece o astfel de legare este slabă, nu va avea prea multă specificitate. Dar dacă un factor de transcripție este înțeles și eliberat de un STR din nou și din nou, efectul cumulativ este de a menține factorul de transcripție în vecinătatea genei, astfel încât este mai probabil să se lege în siguranță de regiunea motivului dacă este necesar.
Fordyce și colegii ei au prezis că STR-urile acționează astfel ca un „lobby” sau un bun în care factorii de transcripție se pot aduna, oricât de tranzitori, în apropierea unui site de legare de reglementare. „Natura repetitivă a unui STR amplifică efectul slab al oricărui loc de legare unic din care este format”, a spus Connor Horton, primul autor al studiului, care acum este doctorand la Universitatea din California, Berkeley.
În schimb, a adăugat el, unele STR pot de asemenea să acționeze pentru a îndepărta factorii de transcripție de secvențele de reglementare, absorbind factorii de transcripție în altă parte, ca un burete. În acest fel, ele pot inhiba expresia genelor.
Lucrarea, a spus Suter, „demonstrează în mod convingător că STR-urile influențează direct legarea factorilor de transcripție in vitro”. În plus, echipa de la Stanford a folosit un algoritm de învățare automată pentru a arăta că efectele observate în experimentele lor in vitro par să apară și în celulele vii (adică in vivo).
dar Robert Tjian, un biochimist la Berkeley și un investigator la Institutul Medical Howard Hughes, consideră că ar putea fi prea devreme pentru a fi sigur ce influență are o anumită combinație de factor de transcripție STR asupra expresiei genelor în celulele reale.
Tjian, Xavier Darzacq și colegii lor din laboratorul pe care îl conduc împreună la Berkeley sunt de acord că STR-urile par să ofere o modalitate de concentrare a factorilor de transcripție în apropierea site-urilor de reglementare a genelor. Cu toate acestea, fără a ști cât de apropiați trebuie să fie factorii pentru a activa transcripția, este dificil de înțeles semnificația funcțională a acestui rezultat. Tjian a spus că ar dori să vadă dacă introducerea unui STR într-o celulă vie influențează în mod previzibil expresia unei gene țintă. În prezent, a spus el, „nu este convins că STR-urile vor fi neapărat un aspect major al mecanismelor [de reglementare] in vivo”.
O gramatică combinatorie
Un puzzle persistent este modul în care un astfel de mecanism oferă în mod fiabil tipul de reglare precisă a genelor de care au nevoie celulele, deoarece atât puterea, cât și selectivitatea legării factorului de transcripție în godeurile STR sunt slabe. Fordyce crede că o astfel de specificitate de influență ar putea proveni din multe surse - nu doar din diferențele dintre secvențele STR, ci și din interacțiunile de cooperare dintre factorii de transcripție și alte proteine implicate în reglare.
Având în vedere toate acestea, a spus Horton, nu este clar că va fi simplu să se prezică efectul unei anumite combinații de factor de transcripție STR asupra expresiei unei gene. Logica procesului este într-adevăr neclară. Iar „gramatica” influenței este probabil combinatorie, a adăugat Horton: Rezultatul depinde de diferite combinații de factori de transcripție și alte molecule.
Echipa de la Stanford crede că poate 90% dintre factorii de transcripție sunt sensibili la STR, dar că există mult mai multe tipuri de factori de transcripție în genomul uman decât există tipuri de STR. „Mutarea unei secvențe STR ar putea afecta legarea a 20 de factori de transcripție diferiți în acel tip de celulă, ceea ce duce la o scădere generală a transcripției acelei gene din apropiere, fără a implica niciun factor de transcripție specific”, a spus Horton.
Deci, de fapt, echipa de la Stanford este de acord cu Tjian că reglarea genelor în celulele vii nu va fi condusă de un singur mecanism simplu. Mai degrabă, factorii de transcripție, situsurile lor de legare la ADN și alte molecule de reglementare se pot asambla în adunări dense care își exercită influența în mod colectiv.
„Acum există mai multe exemple care susțin ideea că elementele ADN pot aglomera factorii de transcripție până la punctul în care formează condensate cu cofactori”, a spus. Richard Young, biolog celular la Institutul Whitehead al Institutului de Tehnologie din Massachusetts. Amplificatorii leagă mulți factori de transcripție pentru a produce acea aglomerare. STR-urile pot fi un ingredient care ajută la strângerea factorilor de transcripție să se grupeze lângă o genă, dar nu vor fi toată povestea.
De ce să reglezi genele în acest mod complicat, mai degrabă decât să te bazezi pe tipul de interacțiuni puternice și specifice dintre proteinele de reglare și situsurile ADN care domină la procariote? Este posibil ca o astfel de neclaritate să fie ceea ce a făcut posibil metazoare complexe mari.
Pentru a fi specii viabile, organismele trebuie să fie capabile să evolueze și să se adapteze circumstanțelor în schimbare. Dacă celulele noastre s-ar baza pe o rețea uriașă, dar strâns prescrisă de interacțiuni de reglare a genelor, ar fi dificil să-i facem modificări fără a perturba întregul dispozitiv, la fel cum un ceas elvețian se va opri dacă înlăturăm (sau chiar înlocuim ușor) orice de nenumăratele sale roți dințate. Dacă interacțiunile moleculare de reglementare sunt laxe și destul de nespecifice, totuși, există o slăbiciune utilă în sistem - la fel cum un comitet poate lua, în general, o decizie bună, chiar dacă unul dintre membrii săi este bolnav.
Fordyce observă că în procariote precum bacteriile, poate fi relativ ușor pentru factorii de transcripție să își găsească locurile de legare, deoarece genomul care trebuie căutat este mai mic. Dar asta devine mai greu pe măsură ce genomul devine mai mare. În genomul mare al eucariotelor, „nu mai poți tolera riscul ca să fii blocat temporar într-un loc de legare „greșit””, a spus Fordyce, deoarece asta ar compromite capacitatea de a răspunde rapid la condițiile de mediu în schimbare.
În plus, STR-urile în sine sunt foarte evolutive. O prelungire sau scurtare a secvenței lor, sau o modificare a mărimii și adâncimii „factorului de transcripție bine”, poate apărea cu ușurință prin accidentări în replicarea sau repararea ADN-ului sau prin recombinarea sexuală a cromozomilor. Pentru Fordyce, acesta sugerează că STR-urile „pot servi, prin urmare, drept materie primă pentru dezvoltarea de noi elemente de reglementare și pentru ajustarea modulelor de reglementare existente pentru programele transcripționale sensibile”, cum ar fi cele care guvernează dezvoltarea animalelor și plantelor.
Puterea interacțiunilor slabe
Astfel de considerații îi determină pe biologi moleculari să acorde mult mai multă atenție interacțiunilor slabe și relativ neselective din genom. Multe dintre acestea implică proteine care, în loc să aibă o structură fixă și precisă, sunt libere și flexibile - „dezordonate intrinsec”, după cum spun biochimiștii. Dacă proteinele ar funcționa doar prin domenii structurale rigide, a explicat Young, ar constrânge nu numai cât de bine ar putea evolua sistemele de reglementare, ci și tipurile de reglementare dinamică observate în viață. „Nu veți găsi un organism viu – sau chiar un virus – care funcționează doar cu elemente structurale stabile precum cele dintr-un ceas elvețian”, a spus Young.
Poate că evoluția tocmai a dat peste STR ca o componentă a unei astfel de soluții complexe, dar în cele din urmă mai eficiente pentru reglarea genelor la eucariote. STR-urile în sine pot apărea în mai multe moduri - de exemplu, prin erori în replicarea ADN-ului sau prin activitatea segmentelor de ADN numite elemente transpozabile care fac copii ale lor în întregul genom.
„S-a întâmplat că interacțiunile slabe care rezultă între proteine și secvențele repetitive ar putea … oferi un avantaj selectiv celulelor în care a avut loc”, a spus Kuhlman. Presupunea lui este că această neclaritate a fost probabil forțată asupra eucariotelor, dar că „au fost ulterior capabili să o exploateze în beneficiul lor”. Bacteriile și alte procariote se pot baza pe o logică de reglementare „digitală” bine definită, deoarece celulele lor tind să existe doar în câteva stări simple, distincte, cum ar fi deplasarea și replicarea.
Dar diferitele stări ale celulelor pentru metazoare sunt „mult mai complexe și uneori apropiate de un continuum”, a spus Suter, astfel încât acestea sunt mai bine servite de o reglementare „analogică” mai neclară.
„Sistemele de reglare a genelor din bacterii și eucariote par să fi divergit destul de substanțial”, a fost de acord Tjian. În timp ce se spune că Monod a remarcat odată că „ceea ce este adevărat pentru E. coli este valabil pentru elefant”, se pare că nu este întotdeauna așa.
- Distribuție de conținut bazat pe SEO și PR. Amplifică-te astăzi.
- PlatoData.Network Vertical Generative Ai. Împuterniciți-vă. Accesați Aici.
- PlatoAiStream. Web3 Intelligence. Cunoștințe amplificate. Accesați Aici.
- PlatoESG. carbon, CleanTech, Energie, Mediu inconjurator, Solar, Managementul deșeurilor. Accesați Aici.
- PlatoHealth. Biotehnologie și Inteligență pentru studii clinice. Accesați Aici.
- Sursa: https://www.quantamagazine.org/a-lobby-where-a-molecule-mob-tells-genes-what-to-do-20240214/
- :are
- :este
- :nu
- :Unde
- ][p
- $UP
- 000
- 20
- 70
- a
- capacitate
- Capabil
- Despre Noi
- absent
- abundent
- acumulate
- act
- actorie
- Acțiune
- activa
- activitate
- Acte
- adapta
- adăuga
- adăugat
- adiacent
- Avantaj
- afecta
- afinitate
- din nou
- de acord
- este de acord
- Algoritmul
- TOATE
- singur
- de-a lungul
- de asemenea
- Cu toate ca
- mereu
- printre
- amplifică
- an
- și
- animale
- O alta
- Orice
- separat
- SUNT
- argumenta
- apărea
- în jurul
- articol
- AS
- aspect
- asumat
- At
- atenţie
- autor
- Automata
- departe
- înapoi
- Bacteriile
- de bază
- BE
- deoarece
- deveni
- fost
- începe
- fiind
- beneficia
- Berkeley
- CEL MAI BUN
- Mai bine
- între
- Mare
- Imagine de ansamblu
- mai mare
- Cea mai mare
- lega
- legare
- biologie
- Bloca
- Blocuri
- sufla
- a stimula
- atât
- adus
- dar
- by
- California
- denumit
- a venit
- CAN
- celulă
- Celule
- sigur
- provocări
- Modificări
- schimbarea
- alegeri
- Cromozomii
- împrejurări
- clasic
- Clasifica
- clar
- clar
- Închide
- îndeaproape
- Grup
- colabora
- colegii
- colectiv
- combinaţie
- combinaţii
- cum
- comitet
- Comun
- comparație
- complex
- complicat
- component
- compromis
- Condiții
- Conexiuni
- Considerații
- conţinut
- continuum
- Control
- controale
- conversații
- cooperativă
- ar putea
- Cuplu
- mulţime
- zeci de ani
- decide
- decizie
- Deciziile
- Decodare
- scădea
- În funcție
- depinde de
- adâncime
- detaliu
- detaliat
- Dezvoltare
- diferi
- diferenţele
- diferit
- dificil
- difuziune
- digital
- moda digitală
- direct
- descoperire
- Boală
- distinct
- diferit
- ADN-ul
- do
- Doc
- Nu
- domenii
- Domina
- Dont
- condus
- numit
- în timpul
- dinamic
- Devreme
- cu ușurință
- uşor
- efect
- Eficace
- efecte
- oricare
- element
- elefant
- în altă parte
- apărea
- spori
- de mediu
- Erori
- Chiar
- Fiecare
- dovadă
- evoluţie
- evolua
- evoluție
- exact
- exemplu
- exemple
- exista
- existent
- aștepta
- experimente
- a explicat
- Exploata
- expresie
- extrem
- fapt
- factor
- factori
- Modă
- federal
- puțini
- camp
- imaginat
- Găsi
- First
- potrivi
- fixată
- Pentru
- forțat
- formă
- găsit
- Franceză
- din
- funcțional
- funcționare
- funcții
- Bandă
- aduna
- culegere
- adunări
- în general
- genomica
- obține
- devine
- dat
- scop
- merge
- bine
- guvernare
- mare
- grup
- ghici
- Jumătate
- manipula
- sa întâmplat
- Greu
- Mai tare
- Avea
- având în
- he
- ajută
- ei
- extrem de
- lui
- deţine
- Cum
- Totuși
- HTML
- HTTPS
- mare
- uman
- Oamenii
- idee
- identificat
- if
- Impactul
- in
- Inclusiv
- într-adevăr
- individ
- influență
- influențarea
- informații
- nesemnificativ
- in schimb
- Institut
- interacţiona
- interacționând
- interacţiuni
- în
- introducerea
- invariabil
- implica
- implicat
- implică
- IT
- ESTE
- în sine
- Iacov
- Jigsaw
- Loc de munca
- doar
- A pastra
- păstrare
- Copil
- tipurile
- Cunoaștere
- de laborator
- mare
- Nume
- conducere
- învăţare
- Led
- mai puțin
- Viaţă
- ca
- Probabil
- legate de
- mic
- viaţă
- logică
- Lung
- mai lung
- uitat
- maşină
- masina de învățare
- făcut
- revistă
- major
- face
- FACE
- manieră
- multe
- Massachusetts
- Institutul de tehnologie din Massachusetts
- Meci
- material
- matematic
- materie
- Mai..
- poate
- semnificativ
- măsura
- măsurători
- mecanism
- mecanisme
- medical
- reuniuni
- Membri actuali
- Metode
- ar putea
- MIT
- mod
- Module
- molecular
- moleculă
- mai mult
- muta
- în mişcare
- mult
- multiplu
- trebuie sa
- imensitate
- misterios
- Mister
- Natură
- În apropiere
- aproape
- în mod necesar
- Nevoie
- necesar
- reţea
- Nu.
- notițe
- acum
- nuantat
- numeroși
- avea loc
- a avut loc
- care apar
- of
- de pe
- oferi
- de multe ori
- on
- dată
- ONE
- afară
- or
- Altele
- al nostru
- afară
- Rezultat
- peste
- global
- propriu
- împachetat
- împerecherilor
- perechi
- Hârtie
- parametrii
- parte
- participanţi
- special
- trecut
- Patch-uri
- Plătește
- poate
- convins
- fizic
- imagine
- piese
- Plante
- Plato
- Informații despre date Platon
- PlatoData
- Joaca
- jucători
- Punct
- poziţie
- posibil
- putere
- puternic
- precis
- prezice
- a prezis
- prezenţă
- prezenta
- mândrie
- probabil
- procedură
- proces
- produce
- Produs
- profund
- Programe
- proiect
- Proteină
- Proteine
- furniza
- furnizează
- dovedind
- publicat
- pune
- puzzle
- întrebare
- repede
- cu totul
- aleator
- rată
- mai degraba
- Crud
- uşor
- gata
- real
- regiune
- regiuni
- Reglementa
- Regulament
- autoritățile de reglementare
- relativ
- eliberat
- se bazează
- bazându-se
- rămâne
- a remarcat
- scoate
- repara
- repetitiv
- replică
- cercetători
- respectiv
- Răspunde
- rezultat
- rezultând
- REZULTATE
- Orez
- Bogat
- dreapta
- rigid
- Risc
- Riverside
- ARN
- Rol
- Cameră
- în mod obișnuit
- Alerga
- Said
- acelaşi
- Spune
- oamenii de stiinta
- în siguranță,
- vedea
- părea
- aparent
- pare
- văzut
- segment
- segmente
- acapara
- selectiv
- sensibil
- propoziție
- Septembrie
- Secvenţă
- servi
- servit
- câteva
- Sexual
- superficial
- Modela
- Pantaloni scurți
- să
- Arăta
- semnificație
- simplu
- întrucât
- singur
- teren
- Centre de cercetare
- SIX
- Mărimea
- moale
- mai mici
- So
- soluţie
- unele
- oarecum
- ceva
- uneori
- Surse
- Spaţiu
- specific
- specificitate
- stabil
- stanford
- Universitatea Stanford
- Statele
- statistic
- şedere
- Pas
- lipirea
- lipicios
- Stop
- Poveste
- simplu
- rezistenţă
- puternic
- tare
- structural
- structura
- student
- Studiu
- Ulterior
- substanţial
- astfel de
- zahăr
- sugerează
- suită
- a sustine
- sigur
- Înconjurător
- Elvețian
- Intrerupator
- Elveția
- sistem
- sisteme
- Lua
- Tandem
- Ţintă
- obiective
- Sarcină
- echipă
- Tehnologia
- spune
- Tind
- zeci
- decât
- acea
- lor
- Lor
- se
- apoi
- Acolo.
- prin urmare
- Acestea
- ei
- lucruri
- crede
- -Crede
- acest
- aceste
- deşi?
- gândit
- mii
- Prin
- de-a lungul
- Prin urmare
- strans
- timp
- ori
- la
- împreună
- de asemenea
- Traducere
- transparent
- capcane
- adevărat
- Cotitură
- Două
- tip
- Tipuri
- tipic
- ukr
- în cele din urmă
- neacoperit
- înţelege
- universitate
- Universitatea din California
- necunoscut
- pe
- utilizare
- utilizat
- util
- obișnuit
- Valori
- diverse
- Fixă
- foarte
- viabil
- virus
- Voce
- Aşteptare
- a fost
- Ceas
- Apă
- Cale..
- modalități de
- we
- slab
- WebP
- BINE
- bine definit
- Wells
- au fost
- Ce
- cand
- dacă
- care
- în timp ce
- OMS
- întreg
- în întregime
- de ce
- voi
- cu
- în
- fără
- Apartamente
- a lucrat
- lume
- vierme
- ar
- scris
- scris
- încă
- Tu
- tineri
- zephyrnet