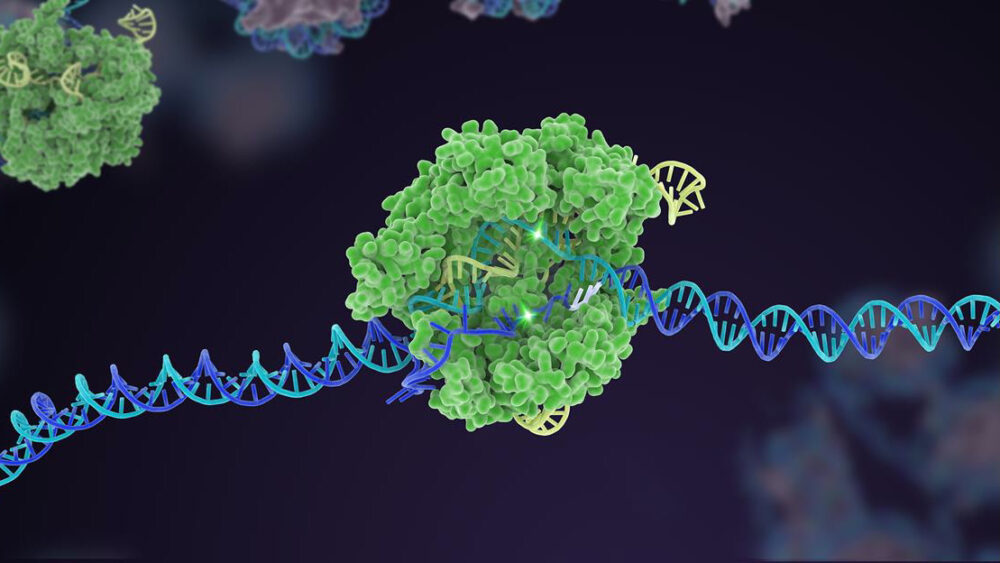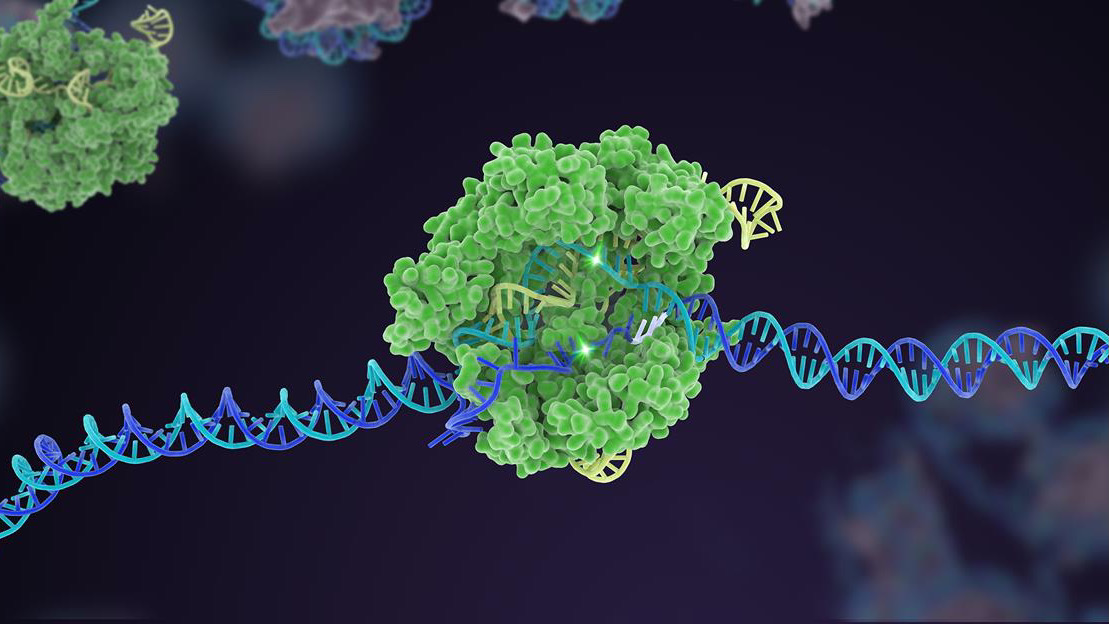
În urmă cu zece ani, un mecanism de apărare bacteriană puțin cunoscut a ajuns vertiginos la faimă ca un puternic editor de genom. În deceniul de după, CRISPR-Cas9 a desprins mai multe variante, extinzându-se într-o cutie de instrumente cuprinzătoare care poate edita codul genetic al vieții.
Departe de o urmărire a turnului de fildeș, utilizările sale practice în cercetare, asistență medicală și agricultură au venit rapid și furioase.
Ați văzut titlurile. FDA a aprobat utilizarea sa în abordarea mutației genetice care stau la baza bolii cu celule falciforme. Unii cercetători celule imunitare editate pentru a lupta împotriva cancerelor de sânge netratabile la copii. Alții au luat transplanturi de organe de la porc la om de la vis la realitate în încercarea de a atenua deficitul de organe donatoare. Lucrările recente urmăresc să ajute milioane de oameni cu colesterol ridicat și, potențial, să aducă maselor terapia genetică bazată pe CRISPR, prin reducându-le șansele de boli de inimă cu o singură injecție.
Dar pentru Dr. Jennifer Doudna, care a câștigat Premiul Nobel în 2020 pentru rolul său în dezvoltarea CRISPR, doar zgâriem suprafața potențialului său. Împreună cu studenta absolventă Joy Wang, Doudna a stabilit o foaie de parcurs pentru următorul deceniu al tehnologiei într-un articol in Ştiinţă.
Dacă anii 2010 s-au concentrat pe stabilirea setului de instrumente CRISPR și pe demonstrarea eficacității acestuia, acest deceniu este atunci când tehnologia își atinge potențialul maxim. De la terapii bazate pe CRISPR și ecrane pe scară largă pentru diagnosticarea bolilor până la inginerie de culturi cu randament ridicat și alimente nutritive, tehnologia „și impactul ei potențial sunt încă în stadiile incipiente”, au scris autorii.
Un deceniu de momente importante
Am vărsat multă cerneală cu privire la avansurile CRISPR, dar merită să revizuim trecutul pentru a prezice viitorul și, eventual, a descoperi problemele pe parcurs.
Un punct culminant timpuriu a fost capacitatea incredibilă a CRISPR de a proiecta rapid modele animale de boli. Forma sa originală îndepărtează cu ușurință o genă vizată dintr-un embrion foarte timpuriu, care, atunci când este transplantat într-un uter, poate genera șoareci modificați genetic în doar o lună, comparativ cu un an folosind metodele anterioare. Versiuni suplimentare CRISPR, cum ar fi editarea de bază – schimbarea unei litere genetice cu alta – și editarea primară – care taie ADN-ul fără a tăia ambele fire – au sporit și mai mult flexibilitatea setului de instrumente la proiectarea organoizilor modificați genetic (gândește-te la mini-creiere) și animale. CRISPR a stabilit rapid zeci de modele pentru unele dintre cele mai devastatoare și perplexe boli ale noastre, inclusiv diferite tipuri de cancer, Alzheimer și distrofia musculară Duchenne - o tulburare degenerativă în care mușchiul se consumă încet. Zeci de studii bazate pe CRISPR sunt acum În lucrări.
De asemenea, CRISPR a accelerat screeningul genetic în era datelor mari. În loc să țintim o genă la un moment dat, acum este posibil să reduceți la tăcere sau să activați mii de gene în paralel, formând un fel de piatră Rosetta pentru a traduce perturbările genetice în modificări biologice. Acest lucru este deosebit de important pentru înțelegerea interacțiunilor genetice, cum ar fi cele în cancer sau îmbătrânire, de care nu eram la curent anterior și pentru obținerea de noi muniții pentru dezvoltarea medicamentelor.
Dar o realizare supremă pentru CRISPR a fost editarea multiplexată. La fel ca atingerea simultană a mai multor taste de pian, acest tip de inginerie genetică vizează mai multe zone specifice ADN-ului, schimbând rapid structura genetică a unui genom dintr-o singură mișcare.
Tehnologia funcționează la plante și animale. Timp de eoni, oamenii au cultivat cu minuțiozitate culturi cu caracteristici dorite - fie că este vorba de culoare, dimensiune, gust, nutriție sau rezistență la boli. CRISPR poate ajuta la selectarea pentru mai multe trăsături sau chiar la domesticirea culturilor noi într-o singură generație. Tauri fără coarne generați de CRISPR, roșii bogate în nutrienți, și animale de fermă hiper-musculare și pești sunt deja realitate. Cu populația mondială atingând 8 miliarde în 2022 și milioane care suferă de foame, Culturile roșite CRISPR pot oferi un colac de salvare, adică dacă oamenii sunt dispuși să accepte tehnologia.
Calea înainte
Unde mergem de aici?
Pentru autori, trebuie să creștem în continuare eficacitatea CRISPR și să construim încredere. Aceasta înseamnă revenirea la elementele de bază pentru a crește acuratețea și precizia editării instrumentului. Aici, platformele pentru a evolua rapid enzimele Cas, componenta „foarfecă” a mașinării CRISPR, sunt critice.
Au existat deja succese: o versiune Cas, de exemplu, acționează ca o balustradă pentru componenta de țintire - sgRNA „bloodhound”. În CRISPR clasic, sgRNA funcționează singur, dar în această versiune actualizată, se luptă să se lege fără asistență Cas. Acest truc ajută la adaptarea editării la un anumit site ADN și crește precizia, astfel încât tăierea să funcționeze conform prevederilor.
Strategiile similare pot, de asemenea, spori precizia cu mai puține efecte secundare sau pot introduce noi gene în celule, cum ar fi neuronii și altele care nu se mai divid. Deși este deja posibilă cu editarea primară, eficiența acesteia poate fi De 30 ori mai mic decât mecanismele clasice CRISPR.
„Un obiectiv principal pentru editarea primară în următorul deceniu este îmbunătățirea eficienței fără a compromite puritatea produsului de editare – un rezultat care are potențialul de a transforma editarea primară într-unul dintre cele mai versatile instrumente pentru editare de precizie”, au spus autorii.
Dar poate mai important este livrarea, care rămâne un blocaj în special pentru terapii. În prezent, CRISPR este utilizat în general pe celulele din afara corpului care sunt infuzate înapoi - ca în cazul CAR-T - sau, în unele cazuri, legate de un purtător viral sau încapsulate în bule de grăsime și injectate în corp. Au fost succese: în 2021, FDA a aprobat prima fotografie bazată pe CRISPR pentru a aborda o boală genetică a sângelui, amiloidoza cu transtiretină.
Cu toate acestea, ambele strategii sunt problematice: nu multe tipuri de celule pot supraviețui tratamentului CAR-T - murind atunci când sunt reintroduse în organism - și țintirea unor țesuturi și organe specifice rămâne în mare parte la îndemâna terapiilor injectabile.
Un progres cheie pentru următorul deceniu, au spus autorii, este transferul încărcăturii CRISPR în țesutul țintă fără a vătăma și eliberarea editorului de gene în locul dorit. Fiecare dintre acești pași, deși aparent simpli pe hârtie, prezintă propriul său set de provocări care vor necesita atât bioinginerie, cât și inovație pentru a le depăși.
În cele din urmă, CRISPR poate face sinergie cu alte progrese tehnologice, au spus autorii. De exemplu, exploatând imaginile celulare și învățarea automată, am putea în curând să proiectăm editori de genom și mai eficienți. Mulțumită secvențierea ADN-ului mai rapidă și mai ieftină, apoi putem monitoriza cu ușurință consecințele editării genelor. Aceste date pot oferi apoi un fel de mecanism de feedback cu care să creeze editori de genom și mai puternici într-o buclă virtuoasă.
Impact în lumea reală
Deși extinderea în continuare a setului de instrumente CRISPR este pe ordinea de zi, tehnologia este suficient de matură pentru a avea un impact asupra lumii reale în al doilea deceniu, au spus autorii.
În viitorul apropiat, ar trebui să vedem „un număr crescut de tratamente bazate pe CRISPR trecând la etapele ulterioare ale studiilor clinice”. Privind mai departe, tehnologia sau variantele sale ar putea face xenotransplantele de organe de la porc la om de rutină, mai degrabă decât experimentale. Ecranele la scară largă pentru gene care duc la îmbătrânire sau la boli degenerative ale creierului sau ale inimii - cei mai buni ucigași ai noștri astăzi - ar putea produce tratamente profilactice bazate pe CRISPR. Nu este o sarcină ușoară: avem nevoie atât de cunoștințe despre genetica care stau la baza bolilor genetice cu mai multe fațete, adică atunci când intră în joc mai multe gene, cât și de o modalitate de a furniza instrumentele de editare țintei lor. „Dar beneficiile potențiale pot conduce inovarea în aceste domenii cu mult peste ceea ce este posibil astăzi”, au spus autorii.
Cu toate acestea, o putere mai mare vine și o responsabilitate mai mare. CRISPR a avansat cu o viteză vertiginoasă, iar agențiile de reglementare și publicul încă se luptă să ajungă din urmă. Poate cel mai notoriu exemplu a fost cel al Copii CRISPR, unde experimente efectuate împotriva ghidurilor etice globale propulsat un consorțiu internațional pentru a stabili o linie roșie pentru editarea celulelor germinale umane.
În mod similar, organismele modificate genetic (OMG) rămân un subiect controversat. Deși CRISPR este mult mai precis decât instrumentele genetice anterioare, va fi la latitudinea consumatorilor să decidă dacă vor bineveni o nouă generație de alimente dezvoltate de om- atât plante cât și animale.
Acestea sunt conversații importante care necesită un discurs global pe măsură ce CRISPR intră în al doilea deceniu al său. Dar pentru autori, viitorul pare luminos.
„La fel ca în timpul apariției editării genomului CRISPR, o combinație de curiozitate științifică și dorința de a beneficia societatea va conduce următorul deceniu de inovare în tehnologia CRISPR”, au spus aceștia. „Prin continuarea explorării lumii naturale, vom descoperi ceea ce nu poate fi imaginat și vom folosi în lumea reală în beneficiul planetei.”
Credit imagine: NIH
- Distribuție de conținut bazat pe SEO și PR. Amplifică-te astăzi.
- Platoblockchain. Web3 Metaverse Intelligence. Cunoștințe amplificate. Accesați Aici.
- Sursa: https://singularityhub.com/2023/01/25/crisprs-wild-first-decade-only-scratches-the-surface-of-its-potential/
- 2020
- a
- capacitate
- accelerat
- Accept
- precizie
- realizare
- Acte
- Suplimentar
- avansa
- avansat
- avans
- venire
- împotriva
- Agențiile
- agendă
- Îmbătrânire
- agricultură
- înainte
- isi propune
- atenua
- singur
- deja
- Cu toate ca
- Alzheimer
- muniţie
- și
- animal
- animale
- aprobat
- domenii
- Asistență
- Autorii
- înapoi
- de bază
- Noțiuni de bază
- beneficia
- Beneficiile
- Berkeley
- Dincolo de
- Mare
- Datele mari
- Miliard
- lega
- sânge
- Bloomberg
- corp
- a stimula
- amplificat
- Creier
- aduce
- construi
- a cladi increderea
- Rac
- nu poti
- caz
- cazuri
- Captură
- Celule
- provocări
- șansele
- Modificări
- schimbarea
- mai ieftin
- clasic
- clinic
- studii clinice
- cod
- culoare
- combinaţie
- cum
- comparație
- component
- cuprinzător
- compromisor
- Consecințele
- consorţiu
- Consumatorii
- continuarea
- controversat
- conversații
- ar putea
- credit
- CRISPR
- critic
- culturilor
- curiozitate
- În prezent
- Tăiat
- tăiere
- de date
- deceniu
- Apărare
- livra
- livrare
- în curs de dezvoltare
- Dezvoltare
- descoperi
- Boală
- boli
- ADN-ul
- jos
- zeci
- vis
- conduce
- medicament
- în timpul
- fiecare
- Devreme
- cu ușurință
- editor
- eficacitate
- efecte
- eficiență
- eficient
- încapsulată
- inginer
- Inginerie
- intră
- mai ales
- stabilit
- stabilirea
- etic
- Chiar
- evolua
- exemplu
- extinderea
- explora
- FAME
- fermă
- FAST
- fda
- feedback-ul
- luptă
- First
- Flexibilitate
- concentrat
- alimente
- formă
- din
- Complet
- mai mult
- viitor
- câștigă
- în general
- genera
- generaţie
- ingineriei genetice
- genetică
- Caritate
- Go
- scop
- merge
- absolvent
- mai mare
- orientări
- Prima pagină
- de asistență medicală
- inimă
- ajutor
- ajută
- aici
- Înalt
- Evidențiați
- HTTPS
- uman
- Imaging
- Impactul
- important
- îmbunătățirea
- in
- Inclusiv
- Crește
- a crescut
- Creșteri
- incredibil
- Inovaţie
- interacţiuni
- Internațional
- IT
- Jennifer
- doar unul
- Cheie
- chei
- ucigași
- Copil
- cunoştinţe
- pe scară largă
- conduce
- învăţare
- a împrumuta
- scrisoare
- Viaţă
- Linie
- mai lung
- cautati
- Se pare
- maşină
- masina de învățare
- mașini
- Principal
- face
- machiaj
- multe
- matur
- mijloace
- mecanism
- Metode
- milioane
- Modele
- modificată
- monitor
- Lună
- mai mult
- mai eficient
- cele mai multe
- în mişcare
- multifacetică
- multiplu
- Natural
- Natură
- În apropiere
- Nevoie
- neuronii
- Nou
- următor
- NHS
- NIH
- Premiul Nobel
- notoriu
- număr
- ONE
- original
- Altele
- Altele
- exterior
- Învinge
- propriu
- Hârtie
- Paralel
- trecut
- cale
- țară
- oameni
- poate
- planetă
- Plante
- Platforme
- Plato
- Informații despre date Platon
- PlatoData
- mulțime
- populație
- posibil
- potenţial
- potenţial
- putere
- puternic
- Practic
- Precizie
- prezice
- a prezis
- cadouri
- precedent
- în prealabil
- Prim
- premiu
- probleme
- Produs
- furniza
- public
- pune
- repede
- ajunge
- aTINGE
- real
- lumea reală
- Realitate
- recent
- Roșu
- autoritățile de reglementare
- eliberaţi
- rămâne
- rămășițe
- necesita
- cercetare
- cercetători
- elasticitate
- responsabilitate
- Bogat
- foaie de parcurs
- Rol
- Said
- Ştiinţă
- cercetaș
- screening-ul
- ecrane
- Al doilea
- set
- deficit
- să
- parte
- Tăcere
- simplu
- simultan
- întrucât
- singur
- teren
- Mărimea
- Încet
- So
- Societate
- unele
- specific
- viteză
- Loc
- tors
- Stadiile
- paşi
- Încă
- PIATRA
- strategii
- luptele
- Incercand
- student
- astfel de
- suferinţă
- Suprafață
- supravieţui
- Ţintă
- vizate
- direcționare
- obiective
- Sarcină
- tehnologic
- Tehnologia
- Noțiuni de bază
- lumea
- lor
- terapeutică
- mii
- timp
- ori
- la
- astăzi
- împreună
- Toolbox
- Unelte
- top
- subiect
- Turn
- studii
- Încredere
- ÎNTORCĂ
- Tipuri
- UN
- care stau la baza
- înţelegere
- actualizat
- utilizare
- diverse
- multilateral
- versiune
- bun venit
- Ce
- Ce este
- dacă
- care
- în timp ce
- OMS
- Sălbatic
- voi
- dispus
- fără
- Castigat
- Apartamente
- fabrică
- lume
- an
- ani
- Randament
- zephyrnet