Новый тип компьютерной модели, способной выявить радиационное повреждение на клеточном уровне, может улучшить результаты лучевой терапии у пациентов с раком легких.
Роман Бауэр, вычислительный нейробиолог из Университет Суррея в Великобритании в сотрудничестве с Отметить во время и Николо Коньо от GSI Helmholtzzentrum für Schwerionenforschung в Германии создали модель, которая имитирует взаимодействие радиации с легкими на клеточном уровне.
Более половины всех больных раком легких лечатся с помощью лучевой терапии. Хотя этот подход эффективен, он оставляет до 30% реципиентов радиационно-индуцированные травмы. Это может вызвать серьезные заболевания, влияющие на дыхание, такие как фиброз, при котором оболочка альвеол (воздушных мешочков) в легких утолщается и укрепляется, и пневмонит, когда стенки альвеол воспаляются.
Чтобы ограничить радиационное повреждение здоровых тканей, при этом убивая раковые клетки, лучевую терапию проводят несколькими отдельными «фракциями». Это позволяет вводить более высокую – и, следовательно, более эффективную – дозу в целом, поскольку некоторые из поврежденных здоровых клеток могут восстанавливаться между каждой фракцией.
В настоящее время схемы фракционирования лучевой терапии выбираются на основе прошлого опыта и обобщенных статистических моделей, поэтому не оптимизированы для отдельных пациентов. Напротив, персонализированная медицина может быть достигнута благодаря этой новой модели, которая, по словам Дуранте, директора Кафедра биофизики GSI объясняет, рассматривает «токсичность в тканях, начиная с основных клеточных реакций, и поэтому [может] предсказать, что происходит с любым пациентом» при выборе различных схем фракционирования.
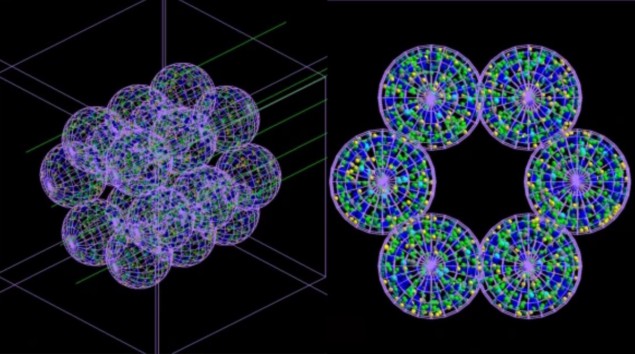
Команда разработала «агентную» модель (ABM), состоящую из отдельных взаимодействующих единиц или агентов – которые в данном случае имитируют клетки легких – в сочетании с симулятором Монте-Карло. ПРО, описанная в Коммуникационная медицина, строит изображение альвеолярного сегмента, состоящего из 18 альвеол диаметром 260 мкм каждая. Затем проводится моделирование облучения этих альвеол методом Монте-Карло в микроскопическом и наноскопическом масштабе, и информация о дозе радиации, доставленной в каждую клетку, и ее распределении возвращается в ABM.
ABM использует эту информацию, чтобы определить, будет ли каждая клетка жить или умереть, и выводит окончательные результаты в виде трехмерного изображения. Важно отметить, что совмещенная модель может имитировать ход времени и, таким образом, показывать тяжесть радиационного повреждения – и прогрессирование заболеваний, которые оно может вызвать – через часы, дни, месяцы или даже годы после лечения.
«Что мне показалось очень интересным, так это то, что эти компьютерные симуляции на самом деле дали результаты, которые совпали с различными экспериментальными наблюдениями из разных групп, лабораторий и больниц. Таким образом, наш вычислительный подход в принципе можно использовать в клинических условиях», — говорит Бауэр, представитель международной организации. Сотрудничество с BioDynaMo, целью которого является внедрение новых вычислительных методов в здравоохранение с помощью пакета программного обеспечения, используемого для построения этой модели.
Бауэр начал работать над вычислительными моделями рака после того, как его близкий друг умер от этой болезни в возрасте всего 34 лет. «Каждый рак индивидуален, и каждый человек уникален, с органами разной формы, генетической предрасположенностью и образом жизни», — объясняет он. Он надеется, что информация, полученная при сканировании, биопсии и других тестах, может быть включена в новую модель, чтобы получить представление о каждом человеке. Затем можно было бы создать протокол терапии с помощью искусственного интеллекта, который позволил бы разработать тщательно адаптированный план лечения, повышающий шансы пациента на выживание.
Планирование для конкретного пациента может улучшить результаты лучевой терапии
В настоящее время Бауэр ищет сотрудников из других дисциплин, включая физику, чтобы помочь продвинуться к клиническим испытаниям на пациентах с раком легких в течение нескольких лет. Тем временем команда намерена расширить использование модели и в других областях медицины.
Дуранте, например, надеется изучить вирусную инфекцию с помощью этой модели легких, поскольку она «может предсказать пневмонит, вызванный инфекцией COVID-19». Тем временем Бауэр начал моделировать развитие цепей в мозгу недоношенных детей с целью лучше понять, «в какой момент времени вмешаться и как».
- SEO-контент и PR-распределение. Получите усиление сегодня.
- PlatoData.Network Вертикальный генеративный ИИ. Расширьте возможности себя. Доступ здесь.
- ПлатонАйСтрим. Интеллект Web3. Расширение знаний. Доступ здесь.
- ПлатонЭСГ. Углерод, чистые технологии, Энергия, Окружающая среда, Солнечная, Управление отходами. Доступ здесь.
- ПлатонЗдоровье. Биотехнологии и клинические исследования. Доступ здесь.
- Источник: https://physicsworld.com/a/modelling-lung-cells-could-help-personalize-radiotherapy/
- :имеет
- :является
- :нет
- $UP
- 135
- 3d
- a
- в состоянии
- О нас
- AC
- достигнутый
- на самом деле
- вводить
- влиять на
- После
- в возрасте
- агенты
- Цель
- AIR
- Все
- позволяет
- Несмотря на то, что
- an
- и
- любой
- подхода
- МЫ
- области
- AS
- At
- назад
- основанный
- основной
- основа
- BE
- , так как:
- становиться
- начал
- начал
- Лучшая
- между
- дыхание
- приносить
- строить
- строит
- by
- CAN
- рак
- Раковые клетки
- проводятся
- случаев
- Вызывать
- ячейка
- Клетки
- шансы
- выбранный
- Клинический
- Закрыть
- тесно
- сотрудничество
- сотрудники
- вычислительный
- компьютер
- Условия
- Состоящий из
- контраст
- может
- соединенный
- Covid-19.
- создали
- в решающей степени
- В настоящее время
- повреждение
- Дней
- поставляется
- Кафедра
- описано
- развитый
- Развитие
- Умереть
- умер
- различный
- директор
- дисциплин
- Болезнь
- распределение
- дозировать
- каждый
- Эффективный
- Даже
- Каждая
- захватывающий
- Расширьте
- опыт
- экспериментальный
- Объясняет
- ФРС
- окончательный
- после
- Что касается
- форма
- найденный
- доля
- друг
- от
- обобщенный
- генетический
- Germany
- цель
- Группы
- Половина
- происходит
- he
- здравоохранение
- здоровый
- помощь
- высший
- его
- надежды
- надеясь
- больницы
- ЧАСЫ
- Как
- HTTPS
- i
- улучшать
- улучшается
- in
- В том числе
- individual
- информация
- травмы
- пример
- намерен
- взаимодействующий
- взаимодействует
- Мультиязычность
- вмешиваться
- в
- вопрос
- IT
- ЕГО
- JPG
- всего
- убийство
- Labs
- уровень
- образ жизни
- ОГРАНИЧЕНИЯ
- подкладка
- жить
- ВЗГЛЯДЫ
- соответствует
- макс-ширина
- Май..
- Между тем
- основным медицинским
- медицина
- методы
- микроскопический
- модель
- моделирование
- Модели
- месяцев
- БОЛЕЕ
- двигаться
- природа
- Новые
- следующий
- of
- on
- оптимизированный
- or
- заказ
- Другое
- наши
- внешний
- Результаты
- выходной
- выходы
- за
- общий
- прохождение
- мимо
- пациент
- пациентов
- человек
- Олицетворять
- Персонализированные
- Физика
- Мир физики
- картина
- план
- планирование
- Платон
- Платон Интеллектуальные данные
- ПлатонДанные
- Точка
- предсказывать
- преждевременный
- принцип
- прогрессия
- протокол
- обеспечивать
- радиотерапия
- реакции
- получатели
- ремонт
- представление
- Итоги
- показывать
- говорит
- Шкала
- сканирует
- схемы
- поиск
- сегмент
- отдельный
- серьезный
- установка
- несколько
- формы
- показывать
- имитировать
- моделирование
- имитатор
- So
- Software
- некоторые
- докладчик
- Начало
- статистический
- По-прежнему
- Кабинет
- такие
- suite
- Surrey
- выживание
- с учетом
- команда
- тестов
- Спасибо
- который
- Ассоциация
- Великобритании
- сами
- тогда
- терапия
- следовательно
- Эти
- этой
- миниатюрами
- Таким образом
- время
- в
- к
- лечение
- лечение
- суд
- вызвать
- правда
- напишите
- Uk
- понимание
- единиц
- использование
- используемый
- использования
- через
- различный
- очень
- с помощью
- вирусный
- Что
- когда
- будь то
- который
- в то время как
- в
- Работа
- разрабатывать
- работает
- Мир
- бы
- лет
- зефирнет