Термолучевая терапия — это лечение рака, при котором гипертермия — нагревание опухоли до температуры выше температуры тела — используется для повышения эффективности лучевой терапии. Величина этого улучшения выражается как EQD.RT, эквивалентная доза облучения, необходимая для достижения того же терапевтического эффекта без нагревания.
Клинические испытания показали, что этот подход может существенно улучшить результаты лечения некоторых типов опухолей без увеличения токсичности для нормальных тканей. Предыдущие исследования также показали, что как достигнутая температура, так и временной интервал между лучевой терапией и гипертермией влияют на клинический результат.
Чтобы понять этот процесс более подробно и помочь оптимизировать лечение, исследователи из Амстердам UMC использовали биологическое моделирование для исследования влияния максимальной температуры и временного интервала на EQDRT. Описывая свои находки в Международный журнал радиационной онкологии Биология Физика, они сообщают, что как высокие температуры, так и короткие интервалы времени необходимы для максимального терапевтического улучшения.
Биологическая модель
Для проведения термолучевой терапии клиницисты используют радиочастотное или микроволновое устройство для нагревания опухоли один или два раза в неделю либо до, либо после сеанса лучевой терапии. Температуру опухоли поддерживают ниже 45°C, чтобы предотвратить нагрев нормальных тканей, но иногда могут возникать нежелательные (и болезненные) горячие точки, которые ограничивают максимально допустимый уровень мощности, который можно использовать во время лечения гипертермией.
Первый автор Петра Кок и его коллеги разработали программное обеспечение для моделирования биологических эффектов лучевой терапии в сочетании с гипертермией с точки зрения распределения эквивалентных доз. Модель, учитывающая ингибирование репарации ДНК гипертермией, а также прямую цитотоксичность, вызванную нагреванием, позволяет оценить качество комбинированных планов лечения с использованием стандартных гистограмм доза-объем.
Чтобы получить общее представление о влиянии параметров гипертермии, команда сначала рассчитала усиление стандартного распределения дозы 23 × 2 Гр однородными температурами от 37 до 43 ° C для временных интервалов от 0 до 4 часов.
Модель показала, что EQDRT значительно увеличивается как с повышением температуры, так и с уменьшением временного интервала. Например, для временного интервала в 1 час он предсказал EQDRT увеличение на 2–15 Гр для температур от 39 до 43°С. Эти результаты подчеркивают важность достижения максимально переносимой температуры опухоли для оптимизации клинических результатов.
Влияние временного интервала было наиболее выражено при более высоких температурах (выше 41°С). При типичной гипертермической температуре 41.5°C ЭКТRT увеличение примерно на 10 Гр было достигнуто с интервалом времени 0 часов. Это уменьшилось примерно до 4 Гр с интервалом в 4 часа, что указывает на то, что по мере увеличения временного интервала для реализации того же эффекта требуется более высокая температура.
Клинические случаи
Затем исследователи оценили реалистичные сценарии лечения, основанные на неоднородном распределении температуры и планах клинической лучевой терапии. Они рассчитали EQDRT у 10 больных местнораспространенным раком шейки матки. Все пациенты получали объемно-модулированную дуговую терапию (VMAT) 23 × 2 Гр с еженедельным применением гипертермии в течение курса лечения.
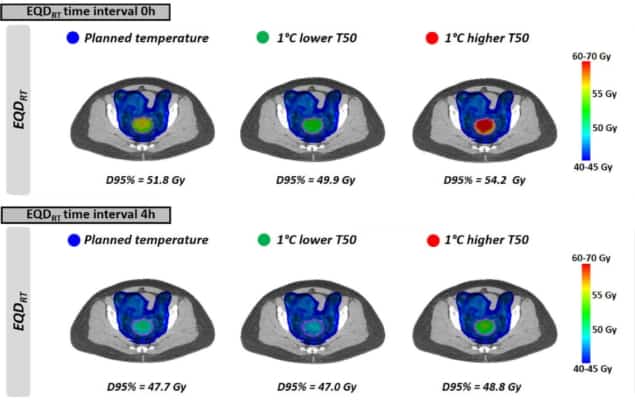
Как видно из однородных температур, EQDRT был наибольшим для наименьшего временного интервала. Когда гипертермия применялась непосредственно до или после лучевой терапии (интервал времени 0 ч), среднее значение EQDRT до 95% объема (D95%) составляла 51.7 Гр — увеличение на 6.3 Гр по сравнению с одним только облучением. Увеличение временного интервала до 4 часов уменьшило это усиление до 2.2 Гр.
Модель предсказала, что большая часть усиления дозы теряется в течение первого часа. Поэтому для клинического применения время между лучевой терапией и гипертермической терапией должно быть как можно короче — в идеале для пациентов, получающих оба вида лечения в одной больнице. Команда отмечает, что, хотя порядок двух процедур не имеет клинического значения, поскольку для нагревания опухоли требуется время, сначала применение гипертермии может обеспечить значительно более короткие временные интервалы, даже близкие к 0 ч.
Наконец, исследователи смоделировали влияние достижения несколько более низкой температуры опухоли, чем планировалось, из-за возникновения горячих точек, ограничивающих лечение. Влияние на EQDRT была наиболее выражена в короткий промежуток времени между лучевой терапией и гипертермией. Например, для температуры на 1°C ниже и временного интервала 0 часов среднее предсказанное EQDRT(D95%) уменьшилась на 1.8 Гр (с 51.7 до 49.9 Гр); за 4-часовой интервал снижение составило около 0.7 Гр.
Лучевая терапия более эффективна при подогретых опухолях.
В тех случаях, когда горячие точки не появляются, можно увеличить выходную мощность и достичь более высокой температуры, чем планировалось. Еще раз, преимущество достижения более высокой температуры было наибольшим для более коротких интервалов времени, при этом точное усиление зависело от фактической достигнутой температуры.
«Биологическое моделирование обеспечивает соответствующее понимание взаимосвязи между параметрами лечения и ожидаемым EQD.RT», — заключают Кок и его коллеги. «Для максимизации EQD необходимы как высокие температуры, так и короткие интервалы времени.RT.