Хирургическая резекция раковой ткани является распространенным методом лечения, используемым для снижения вероятности распространения рака на здоровые ткани. Однако эффективность такой операции сильно зависит от способности хирурга различать раковые и здоровые ткани.
Известно, что метаболическая активность раковой и здоровой ткани существенно различается: раковые ткани часто имеют хаотический кровоток в сочетании с низким уровнем кислорода или гипоксией. С гипоксическими областями, характерными для раковой ткани, точная идентификация гипоксии может помочь отличить раковую ткань от здоровой во время операции.
Исследователи из Инженерная школа Тайера в Дартмуте и Университет Висконсин-Мэдисон исследуют использование флуоресцентных зондов для визуализации локальной концентрации кислорода в тканях в реальном времени во время операции. Они представляют свои выводы в Журнал биомедицинской оптики.
Когда флуоресцентные зонды возбуждаются светом, они возвращаются в основное состояние и излучают свет с другой энергией. Сразу после освещения зонды излучают короткий оптический световой импульс, известный как быстрая флуоресценция. Некоторые зонды также могут генерировать задержанный сигнал флуоресценции через некоторое время после освещения.
Хотя сигналы быстрой и замедленной флуоресценции со временем затухают, сигнал быстрой флуоресценции затухает быстрее по сравнению с длительным затуханием замедленной флуоресценции. Затухание флуоресцентного сигнала с задержкой можно наблюдать и анализировать, чтобы лучше понять метаболическую активность близлежащих тканей.
Оценка оксигенации в режиме реального времени
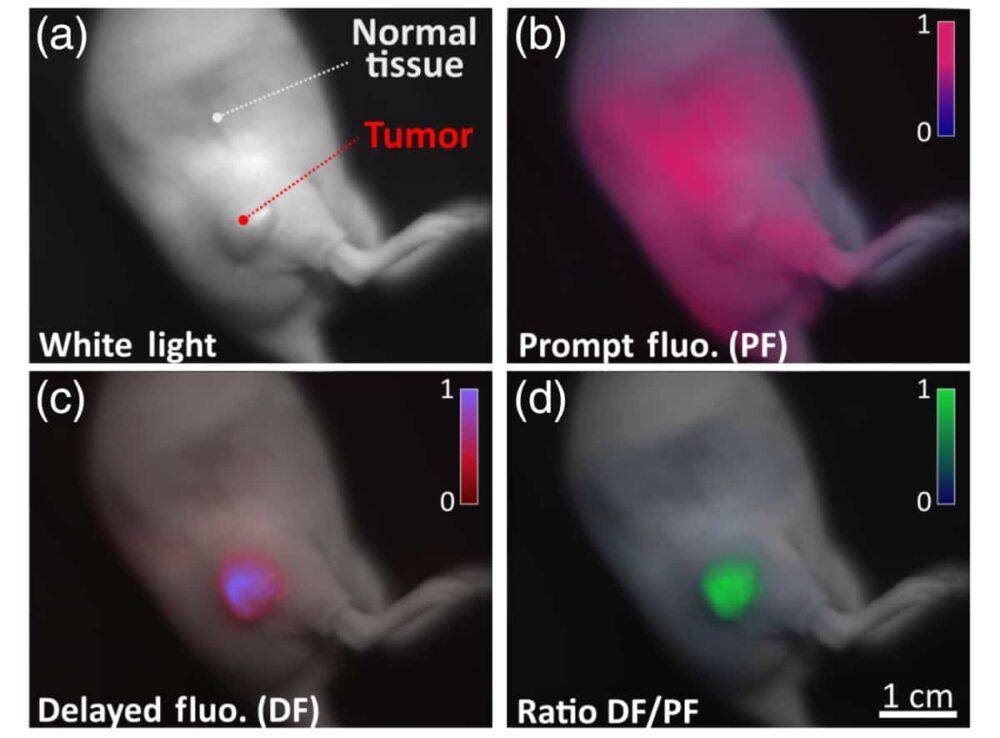
Первый автор Артур Петюссо и его коллеги использовали систему оптической визуализации для мониторинга света, излучаемого эндогенным молекулярным зондом протопорфирином IX (PpIX) в мышиной модели рака поджелудочной железы, где присутствуют гипоксические области.

Исследователи вводили PpIX либо в виде топологической мази, либо путем инъекции в бок животного и генерировали флуоресценцию, используя лазерный диод с модуляцией 635 нм в качестве источника возбуждения. Они обнаружили, что отношение отсроченной флуоресценции к быстрой обратно пропорционально локальному парциальному давлению кислорода в ткани.
Слабая интенсивность сигнала задержанной флуоресценции делает его технически сложным для обнаружения. Чтобы преодолеть это, исследователи использовали систему визуализации с временным стробированием, которая позволяет осуществлять последовательный мониторинг сигнала флуоресценции только в пределах небольших временных окон. Это позволило им уменьшить обнаружение фонового шума и точно отслеживать изменения сигнала задержанной флуоресценции.
Дальнейший анализ показал, что сигнал задержанной флуоресценции, полученный от раковых гипоксических клеток, был в пять раз больше, чем сигнал, полученный от здоровой, хорошо насыщенной кислородом ткани. Кроме того, команда также обнаружила, что сигнал задержанной флуоресценции может быть дополнительно усилен при пальпации тканей (надавливании на кожу во время физического осмотра), что усиливает преходящую гипоксию и обеспечивает временной контраст между двумя сигналами.
«Поскольку в большинстве опухолей присутствует микрорегиональная гипоксия, визуализация сигналов гипоксии от замедленной флуоресценции PpIX позволяет получить превосходный контраст между нормальной тканью и опухолями», — говорит Петюссо.
Мультимодальная спектроскопия выявляет опухоли головного мозга в естественных условиях
Исследователи пришли к выводу, что мониторинг замедленной флуоресценции, возникающей из-за уникального излучения флуоресцентного зонда PpIX в присутствии гипоксии, имеет несколько преимуществ при различении здоровых и раковых тканей во время операции. «Получение как быстрой, так и замедленной флуоресценции в быстром последовательном цикле позволило визуализировать уровни кислорода таким образом, который не зависел от концентрации PpIX», — говорят они.
«Необходимая простая технология и высокая частота кадров в сочетании с низкой токсичностью PpIX делают этот механизм контраста пригодным для человека. Его можно легко использовать в будущем в качестве встроенного механизма контрастирования для онкологического хирургического контроля», — утверждает Петюссо.