Termoradioterapi är en cancerbehandling där hypertermi – uppvärmning av tumören till över kroppstemperatur – används för att förbättra strålbehandlingens effektivitet. Mängden av denna förbättring uttrycks som EQDRT, den ekvivalenta stråldosen som behövs för att uppnå samma terapeutiska effekt utan uppvärmning.
Kliniska prövningar har visat att detta tillvägagångssätt avsevärt kan förbättra behandlingsresultaten i flera tumörtyper, utan att öka normal vävnadstoxicitet. Tidigare studier har också visat att både den uppnådda temperaturen och tidsintervallet mellan strålbehandling och hypertermi påverkar det kliniska resultatet.
För att förstå denna process mer i detalj och hjälpa till att optimera behandlingar, forskare på Amsterdam UMC har använt biologisk modellering för att undersöka effekten av maximal temperatur och tidsintervall på EQDRT. Beskriver deras fynd i International Journal of Radiation Oncology Biology Physics, rapporterar de att både höga temperaturer och korta tidsintervall är avgörande för att maximera terapeutisk förbättring.
Biologisk modell
För att utföra termoradioterapi använder läkare en radiofrekvens- eller mikrovågsapparat för att applicera värme på tumören en eller två gånger i veckan, antingen före eller efter en strålbehandlingssession. Tumörtemperaturen hålls under 45°C för att förhindra uppvärmning av normal vävnad, men ibland kan oönskade (och smärtsamma) heta fläckar uppstå, vilket begränsar den maximala tolererbara effektnivån som kan användas under en hypertermibehandling.
Förste författare Petra Kok och kollegor utvecklade mjukvara för att modellera de biologiska effekterna av strålbehandling plus hypertermi i termer av ekvivalenta dosfördelningar. Modellen, som står för DNA-reparationshämning av hypertermi, såväl som direkt värmeinducerad cytotoxicitet, möjliggör utvärdering av kvaliteten på kombinerade behandlingsplaner med hjälp av standarddos-volymhistogram.
För att få grundläggande insikt om effekterna av hypertermiparametrar, beräknade teamet först förbättringen av en standarddosfördelning på 23 × 2 Gy genom homogena temperaturer på mellan 37 och 43 °C, under tidsintervall mellan 0 och 4 timmar.
Modellen visade att EQDRT ökade markant med både ökande temperatur och minskande tidsintervall. För ett tidsintervall på 1 timme, till exempel, förutspådde den en EQDRT ökning med 2–15 Gy för temperaturer från 39 till 43°C. Dessa fynd betonar vikten av att uppnå den högsta tolererbara tumörtemperaturen för att optimera det kliniska resultatet.
Effekten av tidsintervall var mest uttalad vid högre temperaturer (över 41°C). Vid en typisk hypertermisk temperatur på 41.5°C, en EQDRT ökning med cirka 10 Gy uppnåddes med ett 0 timmars tidsintervall. Detta minskade till cirka 4 Gy förbättring med ett 4 timmars intervall, vilket indikerar att när tidsintervallet ökar krävs en högre temperatur för att uppnå samma effekt.
Kliniska fall
Därefter utvärderade forskarna realistiska behandlingsscenarier baserade på inhomogena temperaturfördelningar och kliniska strålbehandlingsplaner. De beräknade EQDRT för 10 patienter med lokalt avancerad livmoderhalscancer. Alla patienter hade fått 23 × 2 Gy volumetrisk-modulerad bågterapi (VMAT), med hypertermi applicerad varje vecka under behandlingsförloppet.
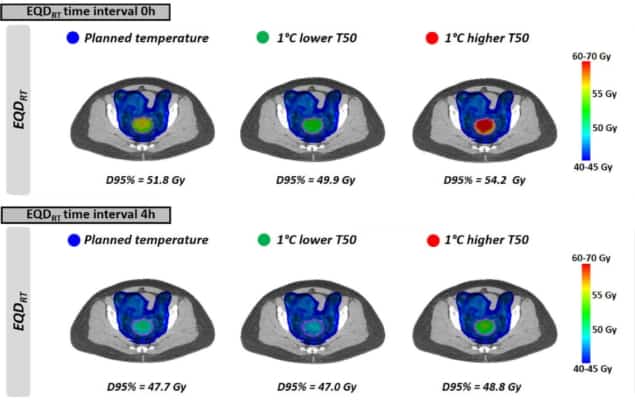
Som ses med de enhetliga temperaturerna, EQDRT var störst för det minsta tidsintervallet. När hypertermi applicerades omedelbart före eller efter strålbehandling (0 timmars tidsintervall), medelvärdet för EQDRT till 95 % av volymen (D95 %) var 51.7 Gy – en vinst på 6.3 Gy över enbart strålning. Ökning av tidsintervallet till 4 timmar minskade denna förstärkning till 2.2 Gy.
Modellen förutspådde att det mesta av dosökningen går förlorad inom den första timmen. För kliniskt bruk bör därför tiden mellan strålbehandling och förlossning av hypertermi vara så kort som möjligt – helst av patienter som får båda behandlingarna på samma sjukhus. Teamet noterar att även om ordningen på de två behandlingarna inte är kliniskt relevant, eftersom det tar tid att värma upp tumören, kan användning av hypertermi först möjliggöra betydligt kortare tidsintervall, till och med nära 0 timmar.
Slutligen modellerade forskarna effekten av att uppnå något lägre tumörtemperaturer än planerat, på grund av förekomsten av behandlingsbegränsande hot spots. Effekten på EQDRT var mest uttalad under ett kort tidsintervall mellan strålbehandling och hypertermi. För en 1°C lägre temperatur och ett 0 timmars tidsintervall, till exempel, den genomsnittliga förutsagda EQDRT(D95%) minskade med 1.8 Gy (från 51.7 till 49.9 Gy); under ett 4 timmars intervall var minskningen cirka 0.7 Gy.
Strålbehandling är effektivare vid uppvärmda tumörer
I de fall inga hot spots uppstår kan det vara möjligt att öka uteffekten och nå en högre temperatur än planerat. Återigen var fördelen med att uppnå en högre temperatur störst under kortare tidsintervall, med den exakta förstärkningen beroende på de faktiska uppnådda temperaturerna.
”Biologisk modellering ger relevant insikt i sambandet mellan behandlingsparametrar och förväntad EQDRT”, avslutar Kok och kollegor. ”Både höga temperaturer och korta tidsintervall är avgörande för att maximera EQDRT.