Möjligheten att slå samman elektronik och optiska sensorer med människokroppen på encellsnivå skulle en dag kunna möjliggöra fjärrövervakning och kontroll av enskilda celler i realtid. Framsteg inom elektroniktillverkning har gjort det möjligt att skapa transistorer och sensorer med upplösning i nanoskala, medan innovativa nanomönstertekniker möjliggör montering av dessa enheter på flexibla substrat. Sådana processer kräver emellertid i allmänhet starka kemikalier, höga temperaturer eller vakuumtekniker som är olämpliga för levande celler och vävnader.
För att övervinna dessa hinder har ett forskarlag vid Johns Hopkins University utvecklat en giftfri, högupplöst och kostnadseffektiv process för att skriva ut guldnanomönster på levande vävnader och celler. Rapportera sina fynd i Nano bokstäver, visar de att den nya tekniken kan "tatuera" levande celler och vävnader med flexibla uppsättningar av guldnanodots och nanotrådar. I slutändan skulle metoden kunna användas för att integrera smarta enheter med levande vävnad för tillämpningar som bionik och biosensing.
"Om vi hade teknik för att spåra hälsan hos isolerade celler skulle vi kanske kunna diagnostisera och behandla sjukdomar mycket tidigare och inte vänta tills hela organet är skadat", förklarar teamledaren David Gracias i ett pressmeddelande. "Vi pratar om att sätta något som en elektronisk tatuering på ett levande föremål som är tiotals gånger mindre än huvudet på en nål. Det är det första steget mot att fästa sensorer och elektronik på levande celler.”
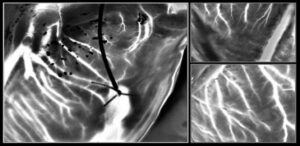
Tack, Luo Gu och kollegor har designat en trestegs nanoöverföringsutskriftsprocess för att binda guldnanomönster till levande celler. I det första steget använde de konventionell nanoimprint litografi (NIL) för att skriva ut arrayer av guld nanodots eller nanotrådar på polymerbelagda kiselwafers. De löste sedan upp polymeren och frigjorde nanoarrayerna för överföring till täckglas.
Därefter funktionaliserade forskarna guldytan med cysteamin och belade guld-NIL-arrayerna med ett alginathydrogelöverföringsskikt. De visade att detta tillvägagångssätt på ett tillförlitligt sätt kunde överföra 8 × 8 mm arrayer av nanodots och nanotrådar från glaset till de mjuka och flexibla hydrogelerna. I det sista steget konjugeras guld-NIL-arrayerna med gelatin för att möjliggöra överföring till levande celler eller vävnad. Att dissociera hydrogelöverföringsskiktet exponerar sedan guldmönstret.
Forskarna undersökte beteendet hos levande fibroblastceller sådda på arrayer av 250 nm-diameter guldprickar (550 nm centrum-till-centrum) eller 300 nm breda guldtrådar (450 nm avstånd) på alginathydrogeler. Cirka 24 timmar efter sådd migrerade cellerna på den nanotrådstryckta hydrogelen företrädesvis parallellt med nanotrådarna, medan de på nanoprickarna uppvisade slumpmässig, men något snabbare, migrering. Celler på nanotrådarna uppvisade också ungefär dubbelt så lång förlängning av de på nanodotterna. Dessa fynd visar förmågan hos guld-NIL-matriserna att styra cellorientering och migration.
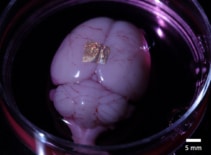
Förutom att vara biokompatibel med celler och vävnader, kan alginathydrogel också överföra guld NIL-arrayer till levande organ och celler. För att visa detta placerade forskarna nanotrådstryckta hydrogeler på hjärnbarken i en hel hjärna och en koronal hjärna skiva.
Efter 2 timmar i odlingsmedia och dissociering av hydrogelen förblev nanotrådarna bundna till ytan av hela hjärnan. Däremot fäste inte nanotrådar på hjärnskivan, vilket tyder på att vidhäftningsstyrkan varierar mellan olika celltyper och odlingsmetoder. Forskarna noterar att ytterligare studier behövs för att karakterisera och optimera vidhäftningsmekanismer för robust långtidsbindning.
Slutligen, för att bedöma bioöverföringsutskrift på encellsnivå, odlade forskarna monolagercellblad på guld NIL-array-tryckta alginathydrogeler. Efter 24 timmar vände de över de fibroblastfröade hydrogelerna på gelatinbelagda täckglas och lät cellerna fästa vid täckglasen över natten.
Efter dissociering av alginathydrogelen visade fluorescensmikroskopi att fibroblaster mönstrade med guldnanodotter hade en livskraft på cirka 97 %, medan de mönstrade med nanotrådar hade en livskraft på cirka 98 %, vilket indikerar att utskriftsprocessen är biokompatibel med levande celler. Reflekterande färger som ses på det mönstrade fibroblastcellarket tyder på att formen på guld-NIL-arrayen bibehölls.
Tillverkningsprocessen är också kompatibel med mikroskala fotolitografi, vilket gjorde det möjligt för forskarna att skapa 200 µm breda hexagonala och triangulära fläckar av guld NIL-arrayer. De biotransfer tryckte sedan ut dessa på cellark, vilket ledde till selektiv tillväxt av fibroblastceller på mikroplåstren. Filmer inspelade under 16 timmar visade att celler med fläckar av nanotrådar tryckta på toppen verkade friska och kunna migrera, med arrayerna kvar på de mjuka cellerna även när de rörde sig.

En liten sensor mäter samtidigt elektrisk och mekanisk aktivitet i hjärtceller
"Vi har visat att vi kan fästa komplexa nanomönster på levande celler, samtidigt som vi ser till att cellen inte dör", säger Gracias. "Det är ett mycket viktigt resultat att cellerna kan leva och röra sig med tatueringarna eftersom det ofta finns en betydande inkompatibilitet mellan levande celler och de metoder ingenjörer använder för att tillverka elektronik."
Gracias och kollegor drar slutsatsen att deras nanomönsterprocess, i kombination med standardmikrotillverkningstekniker, "öppnar möjligheter för utveckling av nya cellodlingssubstrat, biohybridmaterial, bioniska enheter och biosensorer". Därefter planerar de att försöka fästa mer komplexa nanokretsar som kan sitta på plats under längre perioder, samt att experimentera med olika typer av celler.
- SEO-drivet innehåll och PR-distribution. Bli förstärkt idag.
- PlatoData.Network Vertical Generative Ai. Styrka dig själv. Tillgång här.
- PlatoAiStream. Web3 Intelligence. Kunskap förstärkt. Tillgång här.
- Platoesg. Fordon / elbilar, Kol, CleanTech, Energi, Miljö, Sol, Avfallshantering. Tillgång här.
- PlatoHealth. Biotech och kliniska prövningar Intelligence. Tillgång här.
- ChartPrime. Höj ditt handelsspel med ChartPrime. Tillgång här.
- BlockOffsets. Modernisera miljökompensation ägande. Tillgång här.
- Källa: https://physicsworld.com/a/researchers-tattoo-gold-nanopatterns-onto-live-cells/
- : har
- :är
- :inte
- $UPP
- 16
- 200
- 24
- 8
- a
- förmåga
- Able
- Om oss
- aktivitet
- anslutit sig
- framsteg
- Efter
- också
- bland
- an
- och
- syntes
- tillämpningar
- tillvägagångssätt
- cirka
- ÄR
- runt
- array
- AS
- Montage
- bedöma
- At
- bifoga
- BE
- därför att
- Där vi får lov att vara utan att konstant prestera,
- mellan
- kropp
- bindning
- Hjärna
- men
- KAN
- Celler
- karakterisera
- klick
- kollegor
- kombinerad
- kompatibel
- komplex
- avslutar
- Däremot
- kontroll
- konventionell
- kostnadseffektiv
- kunde
- skapa
- kultur
- dag
- demonstrera
- utformade
- utvecklade
- Utveckling
- enheter
- DID
- den
- olika
- sjukdomar
- inte
- Tidigare
- Elektronisk
- Elektronik
- möjliggöra
- aktiverad
- Ingenjörer
- säkerställa
- Hela
- Även
- Förklarar
- snabbare
- slutlig
- resultat
- Förnamn
- flexibel
- För
- från
- ytterligare
- GAO
- allmänhet
- glas
- Gold
- Tillväxt
- styra
- hade
- Har
- huvud
- Hälsa
- friska
- Hjärta
- Hög
- hög upplösning
- hopkins
- Men
- HTTPS
- humant
- bild
- med Esport
- in
- individuellt
- informationen
- innovativa
- integrera
- isolerat
- fråga
- IT
- johns
- Johns Hopkins University
- jpg
- lager
- ledare
- ledande
- Låt
- Nivå
- tycka om
- lever
- levande
- lång sikt
- längre
- gjord
- material
- max-bredd
- kanske
- åtgärder
- mekanisk
- mekanismer
- Media
- Sammanfoga
- metod
- metoder
- Mikroskopi
- migrera
- migrerat
- migration
- övervakning
- mer
- flytta
- rörd
- Filmer
- mycket
- behövs
- Nya
- Nästa
- objektet
- hinder
- of
- Ofta
- on
- ONE
- till
- öppet
- möjligheter
- Optimera
- or
- över
- Övervinna
- natten
- Parallell
- Plåster
- Mönster
- perioder
- Fysik
- Fysikvärlden
- Plats
- Planen
- plato
- Platon Data Intelligence
- PlatonData
- placerad
- möjlig
- tryck
- Skriva ut
- tryckning
- process
- processer
- sätta
- slumpmässig
- RÅTTA
- verklig
- realtid
- registreras
- förblev
- Återstående
- avlägsen
- Rapportering
- kräver
- forskning
- forskare
- Upplösning
- resultera
- avslöjade
- robusta
- ungefär
- säger
- sett
- selektiv
- sensor
- Forma
- ark
- visade
- visas
- signifikant
- Kisel
- samtidigt
- Skiva
- mindre
- smarta
- Mjuk
- något
- standard
- .
- bo
- Steg
- hållfasthet
- studier
- sådana
- föreslå
- yta
- tala
- grupp
- tekniker
- Tekniken
- tiotals
- än
- den där
- Smakämnen
- deras
- sedan
- Dessa
- de
- detta
- de
- miniatyr
- tid
- gånger
- till
- topp
- mot
- spår
- överföring
- behandla
- sann
- prova
- Dubbelt
- typer
- Ytterst
- universitet
- tills
- användning
- Begagnade
- Vakuum
- mycket
- livskraft
- vänta
- var
- we
- VÄL
- medan
- som
- medan
- Hela
- bred
- med
- världen
- zephyrnet