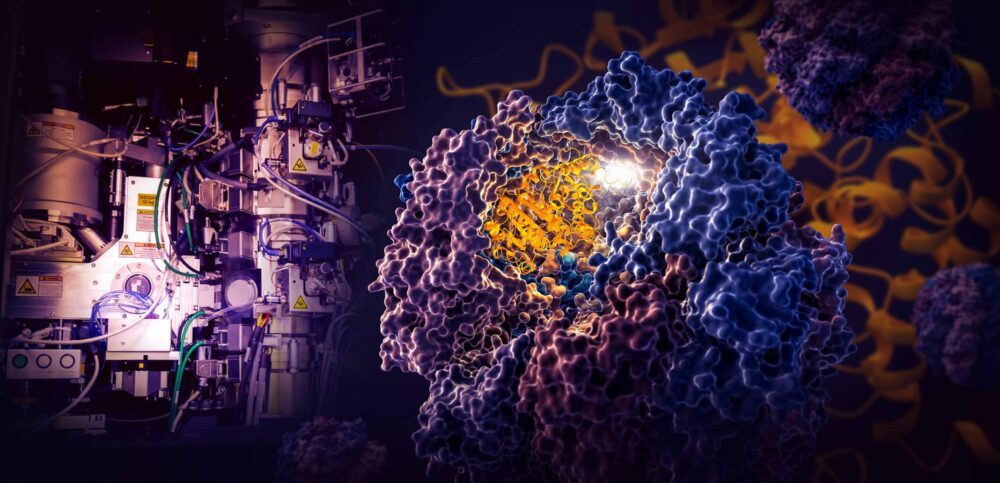
การศึกษาที่สำคัญโดยนักวิจัยจากห้องปฏิบัติการเร่งความเร็วแห่งชาติ SLAC ของกระทรวงพลังงานและมหาวิทยาลัยสแตนฟอร์ดเผยให้เห็นว่าเครื่องเซลล์ขนาดเล็กที่เรียกว่า TRiC กำกับการพับของทูบูลินซึ่งเป็นโปรตีนของมนุษย์ที่เป็นตัวสร้างไมโครทูบูลที่ทำหน้าที่เป็นระบบนั่งร้านและการขนส่งของเซลล์ได้อย่างไร .
จนถึงขณะนี้ นักวิทยาศาสตร์คิดว่า TRiC และเครื่องที่คล้ายกันซึ่งเรียกว่า chaperonins เป็นเพียงสภาพแวดล้อมที่เอื้อต่อการพับ แต่ไม่ได้มีส่วนร่วมโดยตรง
นักวิจัยประเมินว่าโปรตีนในเซลล์ของเรามากถึง 10% เช่นเดียวกับโปรตีนในพืชและสัตว์ ได้รับความช่วยเหลือจากห้องเล็กๆ เหล่านี้ในการพับเป็นรูปร่างสุดท้ายที่ยังเคลื่อนไหวอยู่
โปรตีนหลายชนิดที่พับตัวด้วยความช่วยเหลือของ TRiC มีความเชื่อมโยงอย่างใกล้ชิดกับโรคของมนุษย์ รวมถึงมะเร็งบางชนิดและความผิดปกติทางระบบประสาท เช่น โรคพาร์กินสัน โรคฮันติงตัน และโรคอัลไซเมอร์ ศาสตราจารย์จูดิธ ฟรีดแมน จากมหาวิทยาลัยสแตนฟอร์ด หนึ่งในผู้เขียนหลักของการศึกษากล่าว
เธอกล่าวว่ายาต้านมะเร็งจำนวนมากได้รับการออกแบบมาเพื่อรบกวน tubulin และ microtubules ที่เกิดขึ้น ซึ่งมีความสำคัญอย่างยิ่งต่อการแบ่งเซลล์ ดังนั้นการกำหนดเป้าหมายกระบวนการพับ tubulin ที่ได้รับความช่วยเหลือจาก TRiC จึงสามารถให้กลยุทธ์ต่อต้านมะเร็งที่น่าสนใจได้
ทีมงานรายงานผลการศึกษาที่ยาวนานนับทศวรรษในบทความที่ตีพิมพ์ใน เซลล์ ในวันนี้
“นี่คือโครงสร้างโปรตีนที่น่าตื่นเต้นที่สุดที่ฉันเคยทำมาตลอดอาชีพการงาน 40 ปี” ศาสตราจารย์ Wah Chiu ของ SLAC/Stanford ผู้บุกเบิกการพัฒนาและใช้กล้องจุลทรรศน์อิเล็กตรอนแบบแช่แข็ง (cryo-EM) และผู้อำนวยการฝ่าย cryo-EM และแผนก bioimaging ของ SLAC กล่าว
“ตอนที่ฉันพบกับจูดิธเมื่อ 20 ปีที่แล้ว” เขาพูดว่า, “เราคุยกันว่าเราจะเห็นว่าโปรตีนพับตัวหรือไม่ นั่นคือสิ่งที่ผู้คนพยายามทำมาหลายปีแล้ว และตอนนี้เราก็ได้ทำสำเร็จแล้ว”
นักวิจัยได้จับสี่ขั้นตอนที่แตกต่างกันในกระบวนการพับที่ควบคุมโดย TRiC ที่ความละเอียดใกล้อะตอมด้วย cryo-EM และยืนยันสิ่งที่พวกเขาเห็นด้วยการวิเคราะห์ทางชีวเคมีและชีวฟิสิกส์
ในระดับพื้นฐานที่สุด Frydman กล่าวว่า การศึกษาครั้งนี้ช่วยไขปริศนาที่มีมายาวนานว่าทำไม tubulin ไม่สามารถพับได้หากไม่ได้รับความช่วยเหลือจาก TRiC: “จริงๆ แล้วมันเป็นตัวเปลี่ยนเกมในการนำวิธีใหม่ในการทำความเข้าใจว่าโปรตีนรวมตัวกันในเซลล์ของมนุษย์อย่างไร”
พับสปาเก็ตตี้เป็นดอกไม้
โปรตีนมีบทบาทสำคัญในแทบทุกอย่างที่เซลล์ทำ และการค้นหาว่าพวกมันพับเข้าสู่สถานะ 3 มิติขั้นสุดท้ายได้อย่างไรถือเป็นภารกิจที่สำคัญที่สุดประการหนึ่งในวิชาเคมีและ ชีววิทยา.
อย่างที่ชิวกล่าวไว้ “โปรตีนเริ่มต้นจากกลุ่มกรดอะมิโนที่มีลักษณะคล้ายสปาเก็ตตี้ แต่จะไม่สามารถทำงานได้จนกว่าจะพับเป็นดอกไม้ที่มีรูปร่างเหมาะสม”
ตั้งแต่กลางทศวรรษ 1950 ภาพของเราว่าโปรตีนพับมีรูปร่างอย่างไรโดยการทดลองโดยใช้โปรตีนขนาดเล็กโดย Christian Anfinsen นักวิจัยจากสถาบันสุขภาพแห่งชาติ เขาค้นพบว่าหากเขาคลี่โปรตีนเล็กๆ ออก มันก็จะสปริงตัวกลับเป็นรูปร่างเดิมตามธรรมชาติ และสรุปว่าคำแนะนำในการทำเช่นนั้นถูกเข้ารหัสไว้ในลำดับกรดอะมิโนของโปรตีน Anfinsen ได้รับรางวัลโนเบลในปี 1972 เคมี สำหรับการค้นพบนี้
สามสิบปีต่อมา นักวิจัยค้นพบว่าเครื่องจักรเซลล์พิเศษช่วยให้โปรตีนพับตัว แต่มุมมองที่แพร่หลายก็คือหน้าที่ของพวกมันถูกจำกัดอยู่แค่การช่วยให้โปรตีนพับตัวได้เองโดยการปกป้องพวกมันจากการติดกับดักหรือรวมตัวกันเป็นก้อน
เครื่องช่วยเหลือประเภทหนึ่งที่เรียกว่า chaperonin นั้นมีห้องคล้ายถังบรรจุโปรตีนไว้ข้างในขณะพับ TRiC เหมาะกับหมวดหมู่นี้
ห้อง TRiC มีลักษณะพิเศษตรงที่ประกอบด้วยหน่วยย่อยที่แตกต่างกัน XNUMX หน่วยซึ่งประกอบเป็นวงแหวนซ้อนกัน XNUMX วง โปรตีนทูบูลินเส้นยาวและผอมจะถูกส่งไปยังช่องเปิดของห้องโดยโมเลกุลตัวช่วยที่มีรูปร่างคล้ายแมงกะพรุน จากนั้นฝาห้องก็ปิดและเริ่มพับ เมื่อเสร็จแล้ว ฝาจะเปิดขึ้นและใบทูบูลินที่พับเสร็จแล้ว
เนื่องจาก tubulin ไม่สามารถพับได้หากไม่มี TRiC ดูเหมือนว่า TRiC อาจช่วยได้มากกว่าการช่วยให้ tubulin พับตามธรรมชาติได้ แต่มันทำงานอย่างไรกันแน่? การศึกษาใหม่นี้ตอบคำถามนั้นและแสดงให้เห็นว่า อย่างน้อยสำหรับโปรตีน เช่น tubulin แนวคิด "การพับตามธรรมชาติ" ใช้ไม่ได้ แต่ TRiC จะประสานเส้นทางการพับที่นำไปสู่โปรตีนที่มีรูปร่างถูกต้องโดยตรง
แม้ว่าความก้าวหน้าล่าสุดในด้านปัญญาประดิษฐ์หรือ AI สามารถทำนายโครงสร้างที่พับแล้วของโปรตีนส่วนใหญ่ได้ แต่ Frydman กล่าวว่า AI ไม่ได้แสดงให้เห็นว่าโปรตีนมีรูปร่างที่ถูกต้องได้อย่างไร ความรู้นี้เป็นพื้นฐานในการควบคุมการพับในเซลล์และพัฒนาวิธีการรักษาโรคพับ เพื่อให้บรรลุเป้าหมายนี้ นักวิจัยจำเป็นต้องทราบขั้นตอนโดยละเอียดของกระบวนการพับที่เกิดขึ้นในเซลล์
ห้องเซลลูล่าร์รับผิดชอบ
เมื่อ XNUMX ปีที่แล้ว Frydman, Chiu และทีมวิจัยของพวกเขาตัดสินใจที่จะเจาะลึกลงไปถึงสิ่งที่เกิดขึ้นในห้อง TRIC
“เมื่อเปรียบเทียบกับห้องพับของแบคทีเรียในแบคทีเรียที่ง่ายกว่า TRiC ในเซลล์ของมนุษย์เป็นเครื่องจักรที่น่าสนใจและซับซ้อนมาก” ฟรีดแมนกล่าวว่า “แต่ละหน่วยย่อยทั้งแปดหน่วยมีคุณสมบัติที่แตกต่างกันและมีพื้นผิวที่แตกต่างกันภายในห้อง และนี่กลายเป็นเรื่องสำคัญมาก”
นักวิทยาศาสตร์ค้นพบว่าภายในห้องพิเศษนี้ควบคุมกระบวนการพับได้สองวิธี

(หยานหยาน จ้าว/มหาวิทยาลัยสแตนฟอร์ด)
เมื่อฝาของห้องปิดทับโปรตีน บริเวณที่มีประจุไฟฟ้าสถิตจะปรากฏบนผนังด้านใน พวกมันดึงดูดส่วนที่มีประจุตรงข้ามของเส้นใยโปรตีน tubulin และยึดติดกับผนังเพื่อสร้างรูปร่างและโครงสร้างที่เหมาะสมสำหรับขั้นตอนต่อไปในการพับ ในขณะเดียวกันหน่วยย่อยของ TRiC "หาง" ที่ห้อยลงมาจากผนังห้องจะจับโปรตีน tubulin ในเวลาและสถานที่ที่กำหนดเพื่อยึดเหนี่ยวและทำให้เสถียร
ในการเริ่มต้น ปลายด้านหนึ่งของเกลียวทูบูลินเกี่ยวเข้ากับกระเป๋าเล็กๆ ที่ผนังแล้วพับ จากนั้นปลายอีกด้านจะติดที่จุดอื่นทำให้เกิดเป็นวงใหญ่ ห่วงจะพับในลักษณะที่นำมาติดกับพื้นที่พับแรก
ในขั้นตอนที่ XNUMX ส่วนหนึ่งของส่วนตรงกลางพับเพื่อสร้างแกนกลางของโปรตีน พร้อมกับช่องที่ GTP ซึ่งเป็นโมเลกุลที่เก็บและปล่อยพลังงานเพื่อขับเคลื่อนการทำงานของเซลล์สามารถเสียบปลั๊กได้
ในที่สุดส่วนโปรตีนที่เหลือจะพับ ตอนนี้โมเลกุลของทูบูลินพร้อมออกฤทธิ์แล้ว
“ภาพรวมโครงสร้างของระยะกลางในลำดับการพับเหล่านี้ไม่เคยเห็นมาก่อนด้วยกล้องจุลทรรศน์อิเล็กตรอนแบบไครโอ-อิเล็กตรอน” ฟรีดแมนกล่าวว่า
การผสมผสานเทคนิคอันทรงพลัง
ทีมงานของเธอยืนยันลำดับการพับด้วยชุดการทดสอบทางชีวเคมีและชีวฟิสิกส์ที่ท้าทาย ซึ่งต้องใช้เวลาหลายปีในการทำงาน
การตีความผลลัพธ์เหล่านี้ทำให้นักวิจัยสามารถสร้างภาพรูปร่างที่เปลี่ยนแปลงของ tubulin ขณะที่มันพับอยู่ภายในห้อง TRiC ซึ่งตรงกับภาพที่สร้างโดย cryo-EM
“การสามารถกลับไปกลับมาระหว่างเทคนิคเหล่านี้มีประสิทธิภาพมาก เพราะคุณจะรู้ได้อย่างแท้จริงว่าสิ่งที่คุณเห็นสะท้อนถึงสิ่งที่เกิดขึ้นในห้องขัง” ฟรีดแมนกล่าวว่า
“วิทยาศาสตร์ทำให้เราประหลาดใจด้วยวิธีแก้ปัญหาที่น่าสนใจจริงๆ ซึ่งผมไม่คาดคิดมาก่อน”
การศึกษายังเสนอเบาะแสในการทำความเข้าใจว่าระบบการพับนี้วิวัฒนาการมาอย่างไรในเซลล์ยูคาริโอตซึ่งประกอบขึ้นเป็นพืช สัตว์ และมนุษย์ แต่ไม่ใช่ในเซลล์ที่เรียบง่ายกว่าเช่นแบคทีเรียและอาร์เคีย เมื่อโปรตีนมีความซับซ้อนมากขึ้นเรื่อยๆ เพื่อรองรับความต้องการของเซลล์ยูคาริโอต นักวิจัยแนะนำว่า ณ จุดหนึ่ง โปรตีนไม่สามารถพับเป็นรูปทรงที่ต้องการเพื่อทำงานที่ซับซ้อนมากขึ้นได้หากไม่ได้รับความช่วยเหลือเพียงเล็กน้อย โปรตีนยูคาริโอตและห้องแชเปโรนินของพวกมันน่าจะวิวัฒนาการร่วมกัน โดยอาจเริ่มต้นจากบรรพบุรุษร่วมคนสุดท้ายของสิ่งมีชีวิตยูคาริโอตทั้งหมดเมื่อประมาณ 2.7 พันล้านปีก่อน
เนื่องจากความซับซ้อนของการวิเคราะห์และการสลับฉากของโรคระบาด การศึกษานี้จึงดำเนินต่อไปเป็นเวลานานจนผู้คนจำนวนมากที่ทำงานเกี่ยวกับเรื่องนี้ได้ย้ายไปทำงานอื่นแล้ว ได้แก่นักวิจัยดุษฎีบัณฑิต Daniel Gestaut และ Miranda Collier จากกลุ่มของ Frydman ซึ่งเป็นผู้ดำเนินการส่วนทางชีวเคมีของโครงการและผลักดันโครงการไปข้างหน้า และ Yanyan Zhao, Soung-Hun Roh, Boxue Ma และ Greg Pintilie จากกลุ่มของ Chiu ผู้ดำเนินการ cryo การวิเคราะห์ -EM ผู้ร่วมให้ข้อมูลเพิ่มเติม ได้แก่ Junsun Park นักเรียนในกลุ่มของ Roh และ Alexander Leitner จาก ETH ในเมืองซูริก ประเทศสวิตเซอร์แลนด์
งานนี้ได้รับการสนับสนุนจากทุนสนับสนุนแก่ Wah Chiu และ Judith Frydman จาก NIH และทุนแก่ Soung-Hun Roh ซึ่งปัจจุบันเป็นผู้ช่วยศาสตราจารย์ที่มหาวิทยาลัยแห่งชาติโซล จากมูลนิธิวิจัยแห่งชาติเกาหลีและมูลนิธิ Suh Kyungbae (SUHF)
การอ้างอิงวารสาร
- Daniel Gestaut และคณะ การแสดงภาพโครงสร้างของเส้นทางการพับของ tubulin ซึ่งกำกับโดยพี่เลี้ยงมนุษย์ TRiC/CCT เซลล์, 8 ธันวาคม 2022 ดอย: 10.1016 / j.cell.2022.11.014