Termoradyoterapi, radyoterapinin etkinliğini artırmak için hiperterminin - tümörü vücut sıcaklığının üzerine ısıtmanın - kullanıldığı bir kanser tedavisidir. Bu geliştirmenin miktarı EQD olarak ifade edilir.RT, ısıtma olmadan aynı terapötik etkiyi elde etmek için gereken eşdeğer radyasyon dozu.
Klinik deneyler, bu yaklaşımın, normal doku toksisitesini artırmadan, çeşitli tümör tiplerinde tedavi sonuçlarını önemli ölçüde iyileştirebileceğini göstermiştir. Önceki çalışmalar ayrıca hem elde edilen sıcaklığın hem de radyoterapi ile hipertermi arasındaki zaman aralığının klinik sonucu etkilediğini göstermiştir.
Bu süreci daha ayrıntılı olarak anlamak ve tedavileri optimize etmeye yardımcı olmak için araştırmacılar, Amsterdam UMC maksimum sıcaklık ve zaman aralığının EQD üzerindeki etkisini araştırmak için biyolojik modelleme kullandılarRT. Bulgularını açıklayan Uluslararası Radyasyon Onkolojisi Biyoloji Fiziği Dergisi, terapötik gelişmeyi en üst düzeye çıkarmak için hem yüksek sıcaklıkların hem de kısa zaman aralıklarının gerekli olduğunu bildiriyorlar.
biyolojik model
Termoradyoterapi uygulamak için klinisyenler, radyoterapi seansından önce veya sonra haftada bir veya iki kez tümöre ısı uygulamak için bir radyo frekansı veya mikrodalga cihazı kullanır. Normal dokunun ısınmasını önlemek için tümör sıcaklığı 45°C'nin altında tutulur, ancak bazen hipertermi tedavisi sırasında kullanılabilecek maksimum tolere edilebilir güç seviyesini sınırlayan istenmeyen (ve ağrılı) sıcak noktalar oluşabilir.
İlk yazar Petra Kok ve meslektaşları, radyoterapi artı hiperterminin biyolojik etkilerini eşdeğer doz dağılımları açısından modellemek için yazılım geliştirdiler. Hipertermi ile DNA onarımı inhibisyonunun yanı sıra doğrudan ısı kaynaklı sitotoksisiteyi açıklayan model, standart doz-hacim histogramları kullanılarak kombine tedavi planlarının kalitesinin değerlendirilmesini sağlar.
Ekip, hipertermi parametrelerinin etkisine ilişkin temel bilgileri elde etmek için önce 23 ila 2 saat arasındaki zaman aralıkları için 37 ila 43 °C arasındaki homojen sıcaklıklarla standart bir 0 × 4 Gy doz dağılımının gelişimini hesapladı.
Model, EQD'ninRT hem artan sıcaklık hem de azalan zaman aralığı ile önemli ölçüde artmıştır. Örneğin, 1 saatlik bir zaman aralığı için bir EQD'yi tahmin etti.RT 2'dan 15°C'ye sıcaklıklar için 39–43 Gy artış. Bu bulgular, klinik sonucu optimize etmek için tolere edilebilir en yüksek tümör sıcaklığına ulaşmanın önemini vurgulamaktadır.
Zaman aralığının etkisi en çok daha yüksek sıcaklıklarda (41°C'nin üzerinde) belirgindi. 41.5°C'lik tipik bir hipertermik sıcaklıkta, bir EQDRT 10 saatlik bir zaman aralığında yaklaşık 0 Gy'lik bir artış sağlandı. Bu, 4 saatlik bir aralıkla yaklaşık 4 Gy artışa düşmüştür; bu, zaman aralığı arttıkça aynı etkiyi gerçekleştirmek için daha yüksek bir sıcaklığın gerekli olduğunu gösterir.
Klinik vakalar
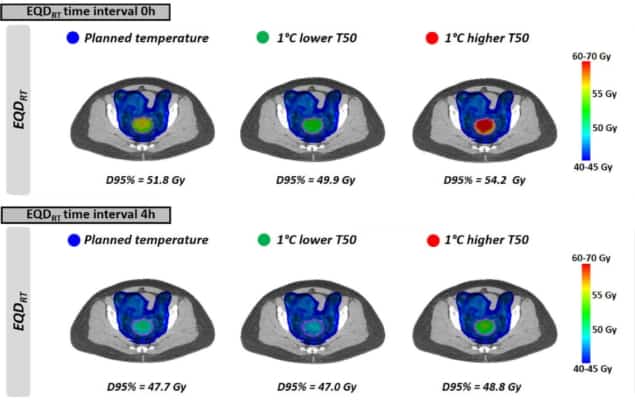
Daha sonra, araştırmacılar homojen olmayan sıcaklık dağılımlarına ve klinik radyoterapi planlarına dayanan gerçekçi tedavi senaryolarını değerlendirdiler. EQD'yi hesapladılarRT Lokal olarak ilerlemiş rahim ağzı kanseri olan 10 hasta için. Tüm hastalar, tedavi kursu boyunca haftalık olarak uygulanan hipertermi ile 23 × 2 Gy hacimsel modülasyonlu ark tedavisi (VMAT) almıştı.
Eşit sıcaklıklarda görüldüğü gibi, EQDRT en küçük zaman aralığı için en büyüktü. Radyoterapiden hemen önce veya sonra hipertermi uygulandığında (0 saat zaman aralığı), ortalama EQDRT hacmin %95'i (%D95) 51.7 Gy idi - tek başına radyasyona göre 6.3 Gy'lik bir kazanç. Zaman aralığını 4 saate çıkarmak, bu kazancı 2.2 Gy'ye düşürdü.
Model, doz artışının çoğunun ilk saat içinde kaybolduğunu öngörmüştür. Bu nedenle klinik kullanım için, radyoterapi ile hipertermi uygulaması arasındaki süre mümkün olduğu kadar kısa olmalıdır - ideal olarak aynı hastanede her iki tedaviyi de alan hastalar için. Ekip, tümörü ısıtmak zaman aldığından, iki tedavinin sırasının klinik olarak alakalı olmadığını, ancak önce hiperterminin uygulanmasının, 0 saate yakın bile olsa önemli ölçüde daha kısa zaman aralıkları sağlayabileceğini belirtiyor.
Son olarak, araştırmacılar, tedaviyi sınırlayan sıcak noktaların ortaya çıkması nedeniyle, planlanandan biraz daha düşük tümör sıcaklıklarına ulaşmanın etkisini modellediler. EQD üzerindeki etkisiRT en çok radyoterapi ile hipertermi arasındaki kısa bir zaman aralığında belirgindi. 1°C daha düşük bir sıcaklık ve 0 saatlik bir zaman aralığı için, örneğin, tahmin edilen ortalama EQDRT(D95%) 1.8 Gy azaldı (51.7'den 49.9 Gy'ye); 4 saatlik bir aralık için düşüş yaklaşık 0.7 Gy idi.
Isınan tümörlerde radyoterapi daha etkili
Sıcak noktaların görünmediği durumlarda, çıkış gücünü artırmak ve planlanandan daha yüksek bir sıcaklığa ulaşmak mümkün olabilir. Bir kez daha, daha yüksek bir sıcaklığa ulaşmanın faydası, ulaşılan gerçek sıcaklıklara bağlı olan kesin kazançla birlikte, daha kısa zaman aralıkları için en yüksek düzeydeydi.
"Biyolojik modelleme, tedavi parametreleri ile beklenen EQD arasındaki ilişki hakkında ilgili içgörü sağlar.RT” Kok ve meslektaşları sonuçlandırıyor. "EQD'yi en üst düzeye çıkarmak için hem yüksek sıcaklıklar hem de kısa zaman aralıkları çok önemlidir.RT.