Giriş
Anılarımız kimliğimizin temel taşıdır. Bunların önemi, Alzheimer hastalığını ve diğer demans türlerini bu kadar acımasız ve dokunaklı kılan şeyin büyük bir kısmıdır. Bilimin Alzheimer'a bir çare bulmasını bu kadar umutsuzca ummamızın ve yararlı tedavilerin yavaş ortaya çıkmasının bu kadar sinir bozucu ve trajik olmasının nedeni budur. Bu nedenle Eylül ayında yeni bir ilacın, lecanemab'ın, klinik deneylerde hastalığın ilerlemesini yavaşlattığının duyurulması büyük bir heyecan yarattı. Gıda ve İlaç İdaresi tarafından onaylanması halinde lecanemab, yaygın olarak hastalığın nedeni olduğu düşünülen amiloid-beta proteinini etkisiz hale getiren ikinci Alzheimer tedavisi olacak.
Ancak lecanemabın etkileri o kadar marjinal ki araştırmacılar ilacın hastalar için gerçekten pratik bir fark yaratıp yaratmayacağını tartışıyor. Lecanemabın parlak bir nokta olarak öne çıkması, Alzheimer tedavisine yönelik araştırmaların geçmişinin ne kadar kasvetli olduğunu gösteriyor. Bu arada, biyolojinin daha derinlemesine anlaşılması, hastalığa neyin sebep olduğuna dair önde gelen alternatif teorilere olan ilgiyi artırıyor.
Belleğin nasıl çalıştığına dair spekülasyonlar en azından Sokratik diyaloglarından birinde "Esin Perilerinin Annesi Belleğin armağanı" hakkında yazan ve işleyişini ruhtaki balmumu damgasıyla karşılaştıran Platon kadar eskidir. Bilimin, Platon'un zamanından bu yana hafıza anlayışımızı büyük ölçüde geliştirdiği için minnettar olabiliriz; balmumu damgaları ve nöronlarımızdaki değişikliklerin "engramları" ile. Yalnızca geçtiğimiz yıl içinde araştırmacılar, anılarımızın farklı yönlerinin beynimizde nasıl ve nerede bulunduğunu öğrenmeye yönelik heyecan verici ilerlemeler kaydettiler. Daha da şaşırtıcı olanı, iyi anıları kötü anılardan ayıran biyokimyasal mekanizmaları bile bulmuşlardır.
Beyni olan yaratıklar olduğumuz için, genellikle hafızayı tamamen nörolojik terimlerle düşünürüz. Ancak Kaliforniya Teknoloji Enstitüsü'ndeki araştırmacılar tarafından 2022'nin başlarında yayınlanan çalışma, gelişmekte olan dokulardaki tek tek hücrelerin bile kendi soylarının geçmişine dair bazı kayıtlar taşıyabileceğini öne sürüyor. Bu kök hücreler, kimyasal ipuçlarına yanıt olarak nasıl uzmanlaşacaklarına ilişkin kararlarla karşı karşıya kaldıklarında bu depolanmış bilgiye güveniyor gibi görünüyor. Geçtiğimiz yıl biyolojide kaydedilen ilerlemeler, beynin uzun süreli gıda yetersizliğine nasıl uyum sağladığına ve göç eden hücrelerin vücutta nasıl bir yol izlediğine dair bilgiler de dahil olmak üzere birçok başka sürprizi de ortaya çıkardı. Önümüzdeki yıl ortaya çıkacak gelişmeler bize kendimizle ilgili yeni bir bakış açısı kazandırmadan önce, bu çalışmaların en iyilerinden bazılarına dönüp bakmaya değer.
Giriş
Araştırma yoluyla ya da hastalarla kişisel bağlar yoluyla Alzheimer hastalığıyla bağlantısı olan birçok kişi, 2022'nin parlak bir yıl olmasını umuyordu. Büyük klinik araştırmalar sonunda hastalığın algılanan temel nedenini ele alan iki yeni ilacın işe yarayıp yaramadığını ortaya çıkaracaktı. Sonuçlar ne yazık ki beklentilerin altında kaldı. İlaçlardan biri olan lecanemab, bazı hastaların bilişsel gerilemesini biraz yavaşlatma potansiyeli gösterdi ancak aynı zamanda bazen ölümcül yan etkilerle de bağlantılıydı; diğeri olan gantenerumab ise tam bir başarısızlık olarak değerlendirildi.
Hayal kırıklığı yaratan sonuçlar, Alzheimer hastalığının beyin hücreleri arasında biriken ve onları öldüren amiloid protein plaklarından kaynaklandığı teorisine dayanan otuz yıllık araştırmayı sınırlıyor. Bununla birlikte artan deliller amiloidin tek bir bileşen olduğunu göstermektedir. çok daha karmaşık hastalık süreci Bu, hasar veren iltihaplanmayı ve hücrelerin proteinlerini geri dönüştürme biçimindeki arızaları içerir. Bu fikirlerin çoğu amiloid hipotezi kadar uzun süredir ortalıkta dolaşıyor ancak hak ettikleri ilgiyi yeni yeni görmeye başlıyorlar.
Aslına bakılırsa hücrelerin etrafındaki protein kümeleri, neredeyse evrensel bir fenomen Stanford Üniversitesi araştırmacılarının geçen baharda bir ön baskıda duyurduğu çalışmaya göre, yaşlanan dokularda bu durum amiloid ve Alzheimer hastalığına özgü bir durum değil. Bu gözlem, protein yönetimiyle ilgili sorunların kötüleşmesinin, hücrelerin yaşlanmasının rutin bir sonucu olabileceğinin bir kanıtı olabilir.
Giriş
Sinirbilimciler, prensipte, anıların nasıl oluştuğuna dair uzun zamandır pek çok şeyi anladılar. Beyin algıladıkça, hissettikçe ve düşündükçe, bu deneyimlere yol açan sinirsel aktivitenin ilgili nöronlar arasındaki sinaptik bağlantıları güçlendirdiğini biliyorlardı. Nöral devrelerimizdeki bu kalıcı değişiklikler, anılarımızın fiziksel kayıtları haline gelir ve ihtiyaç duyulduğunda deneyimlerimizin elektriksel modellerini yeniden uyandırmayı mümkün kılar. Bu sürecin kesin ayrıntıları yine de gizemli kaldı. Bu yılın başlarında, Güney Kaliforniya Üniversitesi'ndeki araştırmacıların bir teknik tanımlamasıyla bu durum değişti. bu değişiklikleri görselleştirmek Bunlar, bir balığın hoş olmayan ısıyı bir ışık işaretiyle ilişkilendirmeyi öğrenmesini izlemek için kullanılan canlı bir beyinde meydana geldikleri gibi. Şaşırtıcı bir şekilde, bu süreç bazı sinapsları güçlendirirken bazılarını da sildi.
Bir anının bilgi içeriği beynin depoladığı şeyin yalnızca bir kısmıdır. Anılar da kodlanmıştır duygusal bir “değerlik” bu onları olumlu veya olumsuz bir deneyim olarak sınıflandırır. Geçen yaz araştırmacılar, nöronlar tarafından salınan nörotensin adı verilen tek bir molekülün seviyelerinin bu etiketleme için bayrak görevi gördüğünü bildirdi.
Giriş
Dünyadaki yaşam, yaklaşık 3.8 milyar yıl önce hücrelerin ilk ortaya çıkışıyla başladı. Ancak paradoksal olarak, hücreler var olmadan önce, şaşırtıcı derecede gerçekçi şeyler yapan molekül topluluklarının olması gerekir. Geçtiğimiz on yılda, Japonya'daki araştırmacılar, yaşamın kökeni üzerine araştırmacıların doğada meydana gelmiş olması gerektiğini teorileştirdiği gibi, tek bir kopyalanan molekül tipinin farklı kopyalayıcılardan oluşan bir topluluğa evrimleşip evrimleşemeyeceğini öğrenmek için RNA molekülleri ile deneyler yürütüyorlar. Japon bilim adamları, bu çeşitliliğin, çeşitli moleküllerin rakip konakçılara ve baskınlık içinde yükselip düşen parazitlere birlikte evrimleşmesiyle meydana geldiğini keşfettiler. Geçtiğimiz Mart ayında bilim insanları yeni bir gelişmeyi bildirdiler: Çeşitli moleküller tek bir yapıda birlikte çalışmaya başlamıştı. daha istikrarlı ekosistem. Çalışmaları, prebiyotik dünyadaki RNA'ların ve diğer moleküllerin de hücresel yaşamın temellerini oluşturmak üzere birlikte evrimleşebileceğini öne sürüyor.
Kendi kendini kopyalama, yaşamın kökeni hipotezlerinde sıklıkla temel ilk adım olarak ele alınır, ancak bu böyle olmak zorunda değildir. Bu yıl, Nick Lane ve diğer evrimci biyologlar hücrelerin var olmasından önce kanıt bulmaya devam ettiler. “proto-metabolizma” sistemleri Hidrotermal menfezlerin yakınındaki gözenekli malzemelerde karmaşık enerjik reaksiyonlar içeren reaksiyonlar ortaya çıkmış olabilir.
Giriş
Tek bir döllenmiş yumurta hücresi nasıl büyüyerek 30'den fazla özel kategoride 200 trilyondan fazla hücreye sahip yetişkin bir insan vücuduna dönüşür? Bu, gelişimin en temel gizemidir. Geçtiğimiz yüzyılın büyük bir bölümünde, baskın açıklama, gelişmekte olan vücudun çeşitli yerlerinde oluşturulan kimyasal değişimlerin, hücrelere ihtiyaç duyulan yere rehberlik etmesi ve onlara deri, kas, kemik, beyin ve diğer bileşenlerine nasıl farklılaşacaklarını söylemesi olmuştur. organlar.
Ancak kimyasallar artık cevabın yalnızca bir parçası gibi görünüyor. Son çalışmalar, hücrelerin gezinmelerine rehberlik etmek için kimyasal gradyan ipuçlarını kullanırken aynı zamanda bunları takip ettiklerini de öne sürüyor. fiziksel gerilim kalıpları Onları çevreleyen dokularda, gergin bir halatı geçen ip cambazları gibi. Fiziksel gerilim, hücrelere nereye gideceklerini söylemekten daha fazlasını yapar. Mayıs ayında bildirilen diğer çalışmalar, embriyo içindeki mekanik kuvvetlerin aynı zamanda hücre gruplarının harekete geçmesine yardımcı olduğunu gösterdi. spesifik yapılara dönüşmekderi yerine tüy gibi.
Bu arada, yaşamın incelenmesinde mühendislik yaklaşımını benimseyen sentetik biyologlar, hücrelerin kimyasal ipuçlarına tepki olarak nasıl farklılaştığını kontrol eden genetik algoritma türlerini anlamada önemli ilerleme kaydetti. Caltech'teki bir ekip şunu gösterdi: yapay gen ağı Bu, kök hücreleri istikrarlı bir şekilde bir dizi daha özel hücre tipine dönüştürebilir. Hücrelerdeki doğal genetik kontrol sisteminin ne olduğunu tanımlamadılar ancak modellerinin başarısı, gerçek sistem ne olursa olsun, muhtemelen çok daha karmaşık olmasına gerek olmadığını kanıtlıyor.
Giriş
Beyin, vücuttaki enerjiye en aç organdır, bu nedenle evrimin, beynin uzun süreli gıda eksikliğiyle başa çıkmasına yardımcı olmak için bir acil durum stratejisi geliştirmesi belki de şaşırtıcı değildir. Edinburg Üniversitesi'ndeki araştırmacılar, farelerin haftalarca kısa gıdalarla hayatta kalmak zorunda kaldıklarında beyinlerinin bir eşdeğerde çalışmaya başladığını keşfetti. “düşük güç” modu.
Bu durumda, görsel korteksteki nöronlar sinapslarında neredeyse %30 daha az enerji kullanır. Mühendislik açısından bakıldığında, beynin enerji kaynaklarını genişletmek için iyi bir çözüm, ancak bir sorun var. Aslında düşük güç modu, görsel sistem sinyallerini daha az hassas hale getirerek hayvanın görüş çözünürlüğünü azaltır.
Beynin mühendislik görünümü yakın zamanda başka bir duyu sistemi hakkındaki anlayışımızı da geliştirdi: koku alma duyumuz. Araştırmacılar, bilgisayarlı "yapay burunların" kokuları tanıma yeteneğini geliştirmeye çalışıyorlar. Kimyasal yapılar tek başına çeşitli moleküllerle ilişkilendirdiğimiz kokuları tanımlamada uzun bir yol kat eder. Ancak yeni çalışma gösteriyor ki metabolik süreçler Doğada molekülleri oluşturan şeyler aynı zamanda moleküllerin koku duyusunu da yansıtır. Analizlerine metabolik bilgileri dahil eden sinir ağları, kokuları insanların yaptığı gibi sınıflandırmaya önemli ölçüde yaklaştı.
Giriş
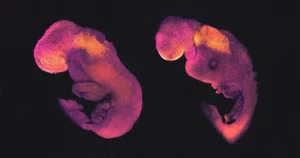
Yaşayan bir insan beyni, nörobilimciler için hala çıldırtıcı derecede zor bir şey: Kafatası onların görüşünü engelliyor ve etik kaygılar, potansiyel olarak bilgilendirici birçok deneyi dışlıyor. Bu nedenle araştırmacılar laboratuvarda izole beyin dokusu yetiştirmeye ve bunun gerçek beyinle fiziksel ve elektriksel açıdan benzerlik gösteren "organoidler" oluşturmasını sağlamaya başladılar. Bu yıl sinir bilimci Sergiu Paşca ve meslektaşları, bu benzerliklerin ne kadar ileri gittiğini gösterdi. insan beyni organoidleri yeni doğmuş laboratuvar farelerine. İnsan hücreleri hayvanın sinir devrelerine entegre oldu ve koku alma duyusunda rol üstlendi. Üstelik nakledilen nöronlar, izole edilmiş organoidlerde büyüyenlerden daha sağlıklı görünüyordu; bu da Paşca'nın belirttiği gibi, düşündürüyor. röportaj ile Kuantumnöronlara girdi ve çıktı sağlamanın önemi. Çalışma gelecekte insan beyni için daha iyi deneysel modeller geliştirmenin yolunu gösteriyor.