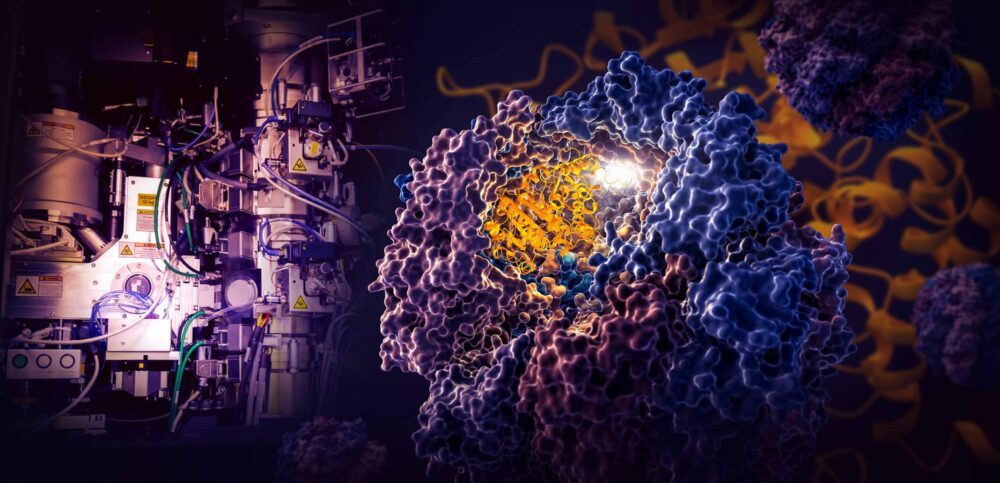
Епохальне дослідження, проведене дослідниками Національної прискорювальної лабораторії SLAC Департаменту енергетики та Стенфордського університету, показує, як крихітна клітинна машина під назвою TRiC керує згортанням тубуліну, людського білка, який є будівельним блоком мікротрубочок, які служать каркасом клітини та транспортною системою. .
Досі вчені вважали, що TRiC та подібні машини, відомі як шапероніни, пасивно створюють середовище, сприятливе для згортання, але не беруть у цьому безпосередньої участі.
За підрахунками дослідників, до 10% білків у наших клітинах, а також у рослинах і тваринах отримують практичну допомогу від цих маленьких камер, згортаючись у свою остаточну активну форму.
Багато білків, які згортаються за допомогою TRiC, тісно пов’язані із захворюваннями людини, включаючи певні види раку та нейродегенеративні розлади, такі як хвороби Паркінсона, Хантінгтона та Альцгеймера, сказала професор Стенфордського університету Джудіт Фрідман, один із провідних авторів дослідження.
Насправді, за її словами, багато протиракових ліків розроблені для руйнування тубуліну та мікротрубочок, які він утворює, які дійсно важливі для поділу клітин. Таким чином, націлювання на процес згортання тубуліну за допомогою TRiC може забезпечити привабливу протиракову стратегію.
Команда повідомила про результати свого десятирічного дослідження в статті, опублікованій в Осередок сьогодні.
«Це найцікавіша білкова структура, над якою я працював за свою 40-річну кар’єру», сказав професор SLAC/Стенфорд Ва Чіу, піонер у розробці та використанні кріогенної електронної мікроскопії (кріо-ЕМ) і директор відділу кріо-ЕМ і біовізуалізації SLAC.
«Коли я зустрів Джудіт 20 років тому,» він сказав, «Ми говорили про те, чи можемо ми побачити згортання білків. Це те, що люди намагалися зробити роками, і тепер ми це зробили».
За допомогою кріо-ЕМ дослідники зафіксували чотири чіткі етапи процесу згортання, керованого TRiC, із роздільною здатністю, близькою до атомної, і підтвердили те, що вони побачили за допомогою біохімічного та біофізичного аналізів.
На самому базовому рівні, сказав Фрідман, це дослідження вирішує давню загадку про те, чому тубулін не може згортатися без допомоги TRiC: «Це дійсно змінює правила гри, оскільки нарешті пропонується новий спосіб зрозуміти, як згортаються білки в клітині людини».
Складання спагетті в квіти
Білки відіграють важливу роль практично в усьому, що робить клітина, і з’ясувати, як вони згортаються у свій кінцевий тривимірний стан, є одним із найважливіших завдань у хімії та біологія.
Як каже Чіу, «Білок починається як рядок амінокислот, який виглядає як спагетті, але він не може функціонувати, доки його не згорнуть у квітку правильної форми».
З середини 1950-х років наше уявлення про те, як згортаються білки, формувалося в результаті експериментів, проведених дослідником Національного інституту здоров’я Крістіаном Анфінсеном з використанням невеликих білків. Він виявив, що якщо розгорнути невеликий білок, він спонтанно повернеться до тієї самої форми, і зробив висновок, що вказівки щодо цього закодовані в амінокислотній послідовності білка. Анфінсен розділив Нобелівську премію 1972 року хімія за це відкриття.
Через тридцять років дослідники виявили, що спеціальні клітинні машини допомагають білкам згортатися. Але поширена думка полягала в тому, що їхня функція зводилася до допомоги білкам у спонтанному згортанні, захищаючи їх від захоплення або злиття разом.
Один тип допоміжної машини, яка називається шаперонін, містить бочкоподібну камеру, яка утримує білки всередині, поки вони згортаються. TRiC підходить до цієї категорії.
Камера TRiC унікальна тим, що складається з восьми різних субодиниць, які утворюють два складені кільця. Довга тонка нитка білка тубуліну доставляється в отвір камери допоміжною молекулою, що має форму медузи. Потім кришка камери закривається і починається згортання. Коли це буде готово, кришка відкривається, і готовий, складений тубулін виходить.
Оскільки тубулін не може згортатися без TRiC, виявилося, що TRiC може робити більше, ніж пасивно допомагати тубуліну спонтанно згортатися. Але як саме це працює? Це нове дослідження відповідає на це запитання та демонструє, що, принаймні, для білків, таких як тубулін, концепція «спонтанного згортання» не застосовується. Натомість TRiC безпосередньо організовує шлях згортання, що веде до білка правильної форми.
Незважаючи на те, що останні досягнення в області штучного інтелекту, або ШІ, можуть передбачити готову, згорнуту структуру більшості білків, сказав Фрідман, ШІ не показує, як білок набуває правильної форми. Ці знання є основоположними для контролю згортання в клітині та розробки методів лікування захворювань згортання. Щоб досягти цієї мети, дослідники повинні з’ясувати детальні етапи процесу згортання, який відбувається в клітині.
Заряд бере на себе коміркова камера
Десять років тому Фрідман, Чіу та їхні дослідницькі групи вирішили глибше дослідити те, що відбувається в камері TRIC.
«Порівняно з простішими складними камерами шаперонінів у бактеріях, TRiC у клітинах людини є дуже цікавою та складною машиною», – сказав Фрідман. «Кожна з восьми його субодиниць має різні властивості та представляє окрему поверхню всередині камери, і це виявляється дуже важливим».
Вчені виявили, що всередині цієї унікальної камери керується процесом згортання двома способами.

(Яньян Чжао/Стенфордський університет)
Коли кришка камери закривається над білком, на її внутрішніх стінках з’являються області електростатичного заряду. Вони притягують протилежно заряджені частини ланцюга білка тубуліну і, по суті, прикріплюють їх до стінки, щоб створити правильну форму та конфігурацію для наступного етапу згортання. Тим часом «хвости» субодиниці TRiC, які звисають зі стінки камери, захоплюють білок тубуліну в певний час і в певних місцях, щоб закріпити та стабілізувати його.
Для початку один кінець нитки тубуліну зачіпляється за маленьку кишеню в стіні та складається. Потім інший кінець прикріплюється в іншому місці, утворюючи велику петлю. Петля складається таким чином, що вона наближається до першої складеної області.
На третьому кроці частина середньої секції складається, щоб утворити ядро білка разом із кишенями, куди може вставлятися GTP, молекула, яка зберігає та вивільняє енергію для роботи клітини.
Нарешті, частина білка, що залишилася, згортається. Молекула тубуліну тепер готова до дії.
«Ці структурні знімки проміжних стадій послідовності згортання ніколи раніше не бачили за допомогою кріоелектронної мікроскопії», – сказав Фрідман.
Потужне поєднання технік
Її команда підтвердила послідовність згортання складною серією біохімічних і біофізичних тестів, які потребували років роботи.
Інтерпретація цих результатів дозволила дослідникам створити картину зміни форми тубуліну, коли він згортається всередині камери TRiC, що збігалося із зображеннями, отриманими за допомогою кріо-ЕМ.
«Це дуже потужна можливість переходити між цими техніками, тому що тоді ви дійсно можете знати, що те, що ви бачите, відображає те, що відбувається в клітині», – сказав Фрідман.
«Наука здивувала нас справді цікавим рішенням, яке я б не передбачив».
Дослідження також пропонує підказки до розуміння того, як ця система згортання еволюціонувала в еукаріотичних клітинах, з яких складаються рослини, тварини та люди, але не в більш простих клітинах, таких як бактерії та археї. Дослідники припускають, що оскільки протеїни ставали дедалі складнішими, щоб задовольнити потреби еукаріотичних клітин, у певний момент вони не могли згортатися у форми, необхідні для виконання більш складної роботи без невеликої допомоги. Еукаріотичні білки та їх шаперонінова камера, ймовірно, еволюціонували разом, можливо, починаючи з останнього спільного предка всіх еукаріотичних організмів приблизно 2.7 мільярда років тому.
Через складність аналізу та пандемію дослідження тривало так довго, що багато людей, які над ним працювали, перейшли на іншу роботу. До них належать докторські дослідники Даніель Гестаут і Міранда Коллієр з групи Фрідмана, які виконали біохімічну частину проекту та просунули його вперед, а також Яньян Чжао, Сонг-Хун Ро, Боксуе Ма та Грег Пінтілі з групи Чіу, які виконали кріотерапію. - ЕМ аналізи. Серед інших учасників були Джунсун Парк, студент групи Ро, і Олександр Лейтнер з ETH у Цюріху, Швейцарія.
Робота була підтримана грантами Wah Chiu і Judith Frydman з NIH і грантами Soung-Hun Roh, який зараз є доцентом Сеульського національного університету, від Korean National Research Foundation і Suh Kyungbae Foundation (SUHF).
Довідник з журналу
- Daniel Gestaut та ін., Структурна візуалізація шляху згортання тубуліну, керованого людським шапероніном TRiC/CCT. Осередок, 8 грудня 2022 р. DOI: 10.1016 / j.cell.2022.11.014