Новий тип комп’ютерної моделі, яка може виявляти радіаційні пошкодження на клітинному рівні, може покращити результати променевої терапії для пацієнтів з раком легенів.
Роман Бауер, обчислювальний нейробіолог у Університет Суррей у Великобританії, у співпраці з Марко Дуранте та Ніколо Коньо від GSI Helmholtzzentrum für Schwerionenforschung у Німеччині створив модель, яка імітує, як радіація взаємодіє з легенями на клітинній основі.
Більше половини всіх хворих на рак легенів лікуються за допомогою променевої терапії. Хоча цей підхід є ефективним, він залишає до 30% реципієнтів з радіаційними травмами. Це може спровокувати серйозні захворювання, які впливають на дихання, наприклад фіброз, при якому вистилка альвеол (повітряних мішків) у легенях потовщується та стає жорсткішою, і пневмоніт, коли стінки альвеол запалюються.
Щоб обмежити радіаційне ураження здорових тканин, водночас знищуючи ракові клітини, радіотерапія проводиться кількома окремими «фракціями». Це дозволяє вводити вищу – і, отже, ефективнішу – дозу в цілому, оскільки деякі пошкоджені здорові клітини можуть відновлюватися між кожною фракцією.
Наразі схеми фракціонування променевої терапії вибираються на основі минулого досвіду та узагальнених статистичних моделей, тому не оптимізовані для окремих пацієнтів. На відміну від цього, персоналізована медицина може бути досягнута завдяки цій новій моделі, яка, за словами Дуранте, директора Кафедра біофізики в GSI пояснює, розглядає «токсичність у тканинах, починаючи з основних клітинних реакцій, і тому [може] передбачити, що станеться з будь-яким пацієнтом», коли вибираються різні схеми фракціонування.
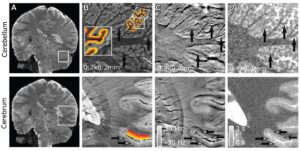
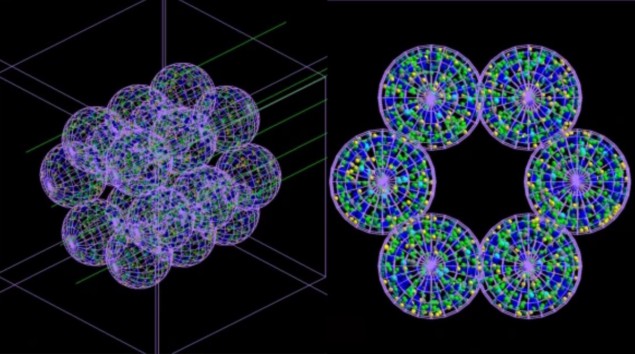
Команда розробила «агентну» модель (ABM), що складається з окремих взаємодіючих одиниць або агентів, які в даному випадку імітують легеневі клітини, у поєднанні з симулятором Монте-Карло. ПРО, описана в Комунікаційна медицина, створює зображення альвеолярного сегмента, що складається з 18 альвеол діаметром 260 мкм кожна. Далі виконується моделювання опромінення цих альвеол методом Монте-Карло в мікроскопічному та наноскопічному масштабі, а інформація про дозу радіації, що подається до кожної клітини, та її розподіл повертається в ABM.
ABM використовує цю інформацію, щоб визначити, чи буде кожна клітина жити чи помре, і виводить остаточні результати у вигляді 3D-зображення. Важливо те, що пов’язана модель може імітувати плин часу і, таким чином, показувати серйозність радіаційного ураження – і прогресування захворювань, які воно може спричинити – години, дні, місяці або навіть роки після лікування.
«Я знайшов дуже захоплюючим те, що ці обчислювальні симуляції фактично дали результати, які збігалися з різними експериментальними спостереженнями різних груп, лабораторій і лікарень. Таким чином, наш обчислювальний підхід, в принципі, можна використовувати в клінічних умовах», – говорить Бауер, речник міжнародної Співпраця BioDynaMo, яка має на меті впровадження нових обчислювальних методів у охорону здоров’я за допомогою пакету програмного забезпечення, що використовується для створення цієї моделі.
Бауер почав працювати над обчислювальними моделями раку після того, як його близький друг помер від хвороби у віці всього 34 роки. «Кожен рак різний, і кожна людина різна, з різними органами, генетичними схильностями та способом життя», – пояснює він. Він сподівається, що дані сканування, біопсії та інших тестів можна буде ввести в нову модель, щоб отримати картину кожної людини. Потім може бути створений протокол терапії за допомогою штучного інтелекту, який дасть чітко адаптований план лікування, який покращить шанси пацієнта на виживання.
Планування для кожного пацієнта може покращити результати променевої терапії
Зараз Бауер шукає співробітників з інших дисциплін, включаючи фізику, щоб допомогти просунутися до клінічних випробувань пацієнтів з раком легенів протягом кількох років. Тим часом команда має намір розширити використання моделі в інших сферах медицини.
Дюранте, наприклад, сподівається вивчити вірусну інфекцію за допомогою цієї моделі легень, оскільки вона «може передбачити пневмоніт, викликаний інфекцією COVID-19». Тим часом Бауер почав симулювати розвиток ланцюгів у мозку недоношених дітей, щоб краще зрозуміти, «в який момент часу втручатися і як».
- Розповсюдження контенту та PR на основі SEO. Отримайте посилення сьогодні.
- PlatoData.Network Vertical Generative Ai. Додайте собі сили. Доступ тут.
- PlatoAiStream. Web3 Intelligence. Розширення знань. Доступ тут.
- ПлатонЕСГ. вуглець, CleanTech, Енергія, Навколишнє середовище, Сонячна, Поводження з відходами. Доступ тут.
- PlatoHealth. Розвідка про біотехнології та клінічні випробування. Доступ тут.
- джерело: https://physicsworld.com/a/modelling-lung-cells-could-help-personalize-radiotherapy/
- : має
- :є
- : ні
- $UP
- 135
- 3d
- a
- Здатний
- МЕНЮ
- AC
- досягнутий
- насправді
- вводити
- впливати
- після
- у віці
- агенти
- Цілі
- AIR
- ВСІ
- дозволяє
- хоча
- an
- та
- будь-який
- підхід
- ЕСТЬ
- області
- AS
- At
- назад
- заснований
- основний
- основа
- BE
- оскільки
- ставати
- почалася
- почався
- Краще
- між
- дихання
- приносити
- будувати
- Будує
- by
- CAN
- рак
- Ракові клітини
- carried
- випадок
- Викликати
- осередок
- Клітини
- шанси
- вибраний
- Клінічний
- близько
- тісно
- співробітництво
- співробітники
- обчислювальна
- комп'ютер
- Умови
- Складається
- контрастність
- може
- з'єднаний
- COVID-19
- створений
- вирішальною мірою
- В даний час
- пошкодження
- Днів
- поставляється
- відділ
- описаний
- розвиненою
- розробка
- Померти
- померлий
- різний
- Директор
- дисциплін
- Захворювання
- розподіл
- доза
- кожен
- Ефективний
- Навіть
- Кожен
- захоплюючий
- Розширювати
- досвід
- експериментальний
- Пояснює
- Fed
- остаточний
- після
- для
- форма
- знайдений
- фракція
- друг
- від
- узагальнені
- генетичний
- Німеччина
- мета
- Групи
- Половина
- відбувається
- he
- охорона здоров'я
- здоровий
- допомога
- вище
- його
- надія
- сподіваючись
- лікарні
- ГОДИННИК
- Як
- HTTPS
- i
- удосконалювати
- поліпшується
- in
- У тому числі
- індивідуальний
- інформація
- травми
- екземпляр
- наміри
- взаємодіючих
- взаємодіє
- Міжнародне покриття
- втрутитися
- в
- питання
- IT
- ЙОГО
- JPG
- просто
- вбивство
- Labs
- рівень
- спосіб життя
- МЕЖА
- підкладка
- жити
- ВИГЛЯДИ
- відповідає
- макс-ширина
- Може..
- Між тим
- медичний
- медицина
- методика
- мікроскопічний
- модель
- моделювання
- Моделі
- місяців
- більше
- рухатися
- природа
- Нові
- наступний
- of
- on
- оптимізований
- or
- порядок
- Інше
- наші
- з
- Результати
- вихід
- виходи
- над
- загальний
- проходження
- Минуле
- пацієнт
- pacientes
- людина
- Уособлювати
- Персоналізовані
- Фізика
- Світ фізики
- картина
- план
- планування
- plato
- Інформація про дані Платона
- PlatoData
- точка
- передбачати
- Передчасний
- принцип
- прогресія
- протокол
- забезпечувати
- Променева терапія
- реакції
- одержувачів
- ремонт
- подання
- результати
- показувати
- говорить
- шкала
- сканування
- схеми
- пошук
- сегмент
- окремий
- серйозний
- установка
- кілька
- форми
- Показувати
- імітувати
- моделювання
- симулятор
- So
- Софтвер
- деякі
- доповідач
- Починаючи
- статистичний
- Як і раніше
- Вивчення
- такі
- набір
- Легкий двомісний екіпаж
- виживання
- з урахуванням
- команда
- Тести
- Дякую
- Що
- Команда
- Великобританія
- самі
- потім
- терапія
- отже
- Ці
- це
- слайдами
- Таким чином
- час
- до
- до
- лікування
- лікування
- суд
- викликати
- правда
- тип
- Uk
- розуміння
- одиниць
- використання
- використовуваний
- використовує
- використання
- різний
- дуже
- через
- вірусний
- Що
- коли
- Чи
- який
- в той час як
- з
- в
- Work
- тренування
- робочий
- світ
- б
- років
- зефірнет