Останню стадію ниркової недостатності, коли нирки більше не можуть задовольняти потреби організму, найкраще лікувати за допомогою трансплантації нирки. Проте кількість донорських органів обмежена, і багато пацієнтів змушені замість цього покладатися на діаліз. І хоча трансплантація нирки дає чудові результати, вона вимагає від пацієнта довічного прийому препаратів для пригнічення імунітету, які спричиняють його власні ускладнення. Щоб вирішити ці проблеми, дослідники сподіваються розробити імплантовану біоштучну нирку для лікування ниркової недостатності.
Дослідники з Каліфорнійського університету в Сан-Франциско (UCSF) працюють над створенням такого пристрою. У своєму останньому дослідженні, повідомленому в Природа зв'язку, вони демонструють, що клітини нирок, розміщені в імплантованому біореакторі, можуть вижити всередині свині та імітувати кілька важливих функцій нирок. Важливо те, що імплантований пристрій не спровокував імунної реакції. Дослідження є частиною Проект «Нирка»., спільно очолювані UCSF Шуво Рой та Вільям Фісселл Медичного центру університету Вандербільта.
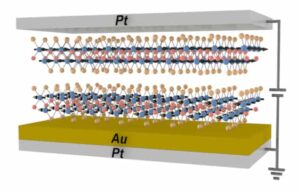
Як перший крок до імплантованої біоштучної нирки, Рой, Фіссель та його колеги створили клітинний біореактор, який повторює ключові функції ниркових канальців, включаючи доставку кисню та поживних речовин до клітин нирки, захищаючи їх від імунних клітин реципієнта, які можуть спричинити відторгнення. . Щоб досягти цього імунозахисту, команда розробила тонку (менше 1 мкм) кремнієву нанопористу мембрану (SNM) із кремнієвих пластин, що містять нанорозмірні щілинні пори.
Дослідники побудували прототип біореактора, що містить SNM з порами шириною 10 нм, з клітинами ниркового епітелію людини (HREC), культивованими на акрилових вставках по обидва боки від SNM. Щоб перевірити, чи забезпечує SNM імунозахисний бар’єр пробірці, вони піддали одну сторону SNM дії прозапального цитокіну TNF-α.
Через шість годин після впливу рівні TNF-α у відділі, захищеному SNM, були незначними, демонструючи, що пори шириною 10 нм перешкоджають проходженню великих цитокінів (і, отже, також більших компонентів імунної системи, таких як Т-клітини та антитіла). . Клітини на тій стороні, яка була безпосередньо піддана TNF-α, мали менше 50% життєздатності, тоді як клітини, запечатані SNM, підтримували високу життєздатність майже 90%.
Також важливо, щоб імплантат не спричиняв утворення тромбів, які можуть утворюватися на поверхнях, що контактують з кров’ю, і призводити до поломки пристрою та серйозних ускладнень для пацієнта. Щоб уникнути цього, дослідники застосували обчислювальну гідродинаміку для оптимізації геометрії U-подібного шляху кровотоку через біореактор.
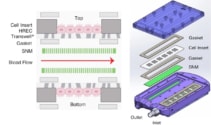
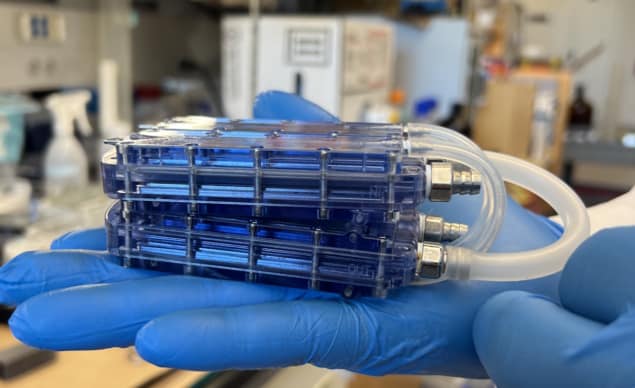
Вони використовували цю конструкцію для створення імплантованого біореактора, що містить чотири SNM в полікарбонатному корпусі, вирівняних з верхньою та нижньою поверхнями кровоносних каналів. Вони розмістили акрилові вставки, засіяні конфлюентними HREC, на протилежних сторонах кожного SNM і використовували з’єднувачі з нержавіючої сталі для переміщення крові між SNM і PTFE судинними трансплантатами.
Щоб перевірити біосумісність цих прототипів біореакторів, команда зібрала та хірургічним шляхом імплантувала пристрої п’яти здоровим свиням на подвійній антитромбоцитарній терапії (без імуносупресії). Біореактори з’єднувалися з судинною системою тварин через трансплантати з ПТФЕ. Жодних ускладнень, пов’язаних із пристроями чи хірургічним втручанням, не виникло, і тварини залишалися здоровими протягом трьох- або семиденних експериментів (час, протягом якого зазвичай відбувається надгостре відторгнення), без ознак відторгнення.
Дослідники оцінювали, чи імплантація біореакторів, що містять ксеногенні клітини людини, викликає імунну реакцію у свиней. Дослідження 13 загальних запальних біомаркерів виявило збільшення деяких цитокінів через два дні після імплантації, як і очікувалося через післяопераційне запалення. Але через сім днів після імплантації всі рівні цитокінів знизилися до стану мінімального запалення. Цей висновок відрізняється від сильної відповіді, очікуваної в типовій моделі ксенотрансплантата з імунокомпетентним реципієнтом.
ОКТ може допомогти розширити пул донорів нирок
Через три або сім днів дослідники вилучили біореактори з тварин для оцінки. Вони виявили, що експлантований SNM був інтактним, з мінімальним приєднанням клітин і білків, і в пристрої не утворилися згустки крові, що є важливим кроком у демонстрації його безпеки. Крім того, інкапсульовані клітини HREC залишалися більш ніж на 90% життєздатними, без жодних ознак від’єднання клітин і збереження щільних міжклітинних з’єднань.
«Нам потрібно було довести, що функціональний біореактор не потребуватиме імунодепресантів, і ми це зробили», — сказав Рой у заяві для преси. «У нас не було ускладнень, і тепер ми можемо повторювати, охоплюючи всю панель функцій нирок у людському масштабі».
- Розповсюдження контенту та PR на основі SEO. Отримайте посилення сьогодні.
- PlatoData.Network Vertical Generative Ai. Додайте собі сили. Доступ тут.
- PlatoAiStream. Web3 Intelligence. Розширення знань. Доступ тут.
- ПлатонЕСГ. Автомобільні / електромобілі, вуглець, CleanTech, Енергія, Навколишнє середовище, Сонячна, Поводження з відходами. Доступ тут.
- PlatoHealth. Розвідка про біотехнології та клінічні випробування. Доступ тут.
- ChartPrime. Розвивайте свою торгову гру за допомогою ChartPrime. Доступ тут.
- BlockOffsets. Модернізація екологічної компенсаційної власності. Доступ тут.
- джерело: https://physicsworld.com/a/implantable-bioartificial-kidney-aims-to-free-patients-from-dialysis/
- :є
- : ні
- $UP
- 1
- 10
- 125
- 13
- a
- Achieve
- доповнення
- адреса
- після
- Цілі
- вирівняні
- ВСІ
- Також
- an
- та
- тварини
- ЕСТЬ
- AS
- зібраний
- At
- уникнути
- бар'єр
- КРАЩЕ
- між
- кров
- дно
- побудований
- але
- by
- CAN
- Викликати
- Клітини
- Центр
- канали
- клацання
- колеги
- загальний
- повний
- Компоненти
- включає
- Перехід
- підключений
- контакт
- містить
- контрастність
- може
- створювати
- створений
- вирішальною мірою
- Днів
- знизився
- надання
- демонструвати
- демонстрація
- дизайн
- розвивати
- пристрій
- прилади
- dialysis
- DID
- прямий
- безпосередньо
- Захворювання
- Лікар
- робить
- Наркотики
- два
- під час
- динаміка
- кожен
- або
- працевлаштований
- інкапсульований
- оцінюється
- оцінка
- докази
- Вивчення
- відмінно
- Розширювати
- очікуваний
- Експерименти
- піддаватися
- експонування
- Провал
- виявлення
- п'ять
- потік
- рідина
- Динаміка рідини
- для
- форма
- сформований
- знайдений
- чотири
- Франциско
- Безкоштовна
- від
- функціональний
- Функції
- було
- очолював
- здоров'я
- здоровий
- допомога
- Високий
- проведення
- сподіваючись
- ГОДИННИК
- житло
- Однак
- HTTPS
- людина
- зображення
- Імунна система
- важливо
- in
- includes
- Augmenter
- інформація
- початковий
- Вставки
- всередині
- замість
- в
- питання
- питання
- IT
- ЙОГО
- JPG
- ключ
- нирка
- нирки
- великий
- більше
- останній
- вести
- залишити
- менше
- рівні
- обмеженою
- довше
- обслуговування
- багато
- макс-ширина
- медичний
- мінімальний
- модель
- більше
- повинен
- нанопор
- природа
- майже
- необхідний
- потреби
- Нові
- немає
- зараз
- сталося
- of
- on
- ONE
- відкрити
- протилежний
- Оптимізувати
- or
- Результати
- власний
- Кисень
- панель
- частина
- проходження
- шлях
- пацієнт
- pacientes
- Фізика
- Світ фізики
- plato
- Інформація про дані Платона
- PlatoData
- press
- запобігати
- проект
- захищений
- захищає
- Білок
- прототип
- Прототипи
- Доведіть
- забезпечує
- досягнення
- реакція
- пов'язаний
- покладатися
- залишився
- Вилучено
- нирковий
- тиражує
- Повідомляється
- вимагати
- Вимагається
- дослідження
- Дослідники
- відповідь
- Показали
- право
- Рой
- Безпека
- Сан -
- Сан Франциско
- говорить
- шкала
- розділ
- розділам
- серйозний
- сім
- кілька
- сторона
- Сторони
- підпис
- Кремній
- деякі
- стан
- Заява
- Крок
- Вивчення
- Успішно
- такі
- поставка
- підтримка
- Хірургія
- виживати
- система
- Т-клітини
- Приймати
- команда
- тест
- перевірений
- ніж
- Що
- Команда
- їх
- Їх
- Ці
- вони
- це
- ті
- хоча?
- три
- по всьому
- слайдами
- Таким чином
- час
- до
- топ
- до
- перехід
- пересадка
- лікувати
- лікування
- лікування
- правда
- два
- типовий
- типово
- університет
- використовуваний
- через
- життєздатності
- viable
- було
- we
- були
- коли
- Чи
- який
- в той час як
- всі
- волі
- з
- без
- робочий
- світ
- б
- зефірнет