Термопроменева терапія — це лікування раку, при якому гіпертермія — нагрівання пухлини до температури вище тіла — використовується для підвищення ефективності променевої терапії. Величина цього посилення виражається як EQDRT, еквівалентна доза радіації, необхідна для досягнення такого ж терапевтичного ефекту без нагрівання.
Клінічні випробування показали, що цей підхід може суттєво покращити результати лікування кількох типів пухлин без збільшення токсичності нормальної тканини. Попередні дослідження також продемонстрували, що досягнута температура та часовий інтервал між променевою терапією та гіпертермією впливають на клінічний результат.
Щоб зрозуміти цей процес більш детально та допомогти оптимізувати лікування, дослідники з Амстердам UMC використовували біологічне моделювання для дослідження впливу максимальної температури та часового інтервалу на EQDRT. Описуючи свої знахідки в Міжнародний журнал радіаційної онкології, біологія, фізика, вони повідомляють, що як високі температури, так і короткі проміжки часу є важливими для максимального терапевтичного посилення.
Біологічна модель
Для проведення термопроменевої терапії клініцисти використовують радіочастотний або мікрохвильовий пристрій для нагрівання пухлини один або два рази на тиждень до або після сеансу променевої терапії. Температуру пухлини підтримують нижче 45°C, щоб запобігти нагріванню нормальної тканини, але іноді можуть виникати небажані (і болючі) гарячі точки, які обмежують максимально допустимий рівень потужності, який можна використовувати під час лікування гіпертермією.
Перший автор Петра Кок і його колеги розробили програмне забезпечення для моделювання біологічних ефектів променевої терапії плюс гіпертермії з точки зору розподілу еквівалентної дози. Модель, яка враховує інгібування репарації ДНК гіпертермією, а також цитотоксичність, спричинену нагріванням, дозволяє оцінити якість комбінованих планів лікування за допомогою стандартних гістограм доза-об’єм.
Щоб отримати базове уявлення про вплив параметрів гіпертермії, команда спочатку розрахувала посилення стандартного розподілу дози 23 × 2 Гр за допомогою однорідних температур від 37 до 43 °C для інтервалів часу від 0 до 4 годин.
Модель показала, що EQDRT значно зростає як із підвищенням температури, так і зі зменшенням інтервалу часу. Для інтервалу часу в 1 годину, наприклад, він передбачив EQDRT підвищення на 2–15 Гр при температурах від 39 до 43°С. Ці результати підкреслюють важливість досягнення найвищої допустимої температури пухлини для оптимізації клінічного результату.
Вплив часового інтервалу був найбільш вираженим при більш високих температурах (вище 41°C). При типовій гіпертермічній температурі 41.5°C EQDRT збільшення приблизно на 10 Гр було досягнуто з інтервалом часу 0 год. Це зменшилося приблизно до 4 Гр збільшення з 4-годинним інтервалом, що вказує на те, що зі збільшенням часового інтервалу для реалізації того самого ефекту потрібна більш висока температура.
Клінічні випадки
Потім дослідники оцінили реалістичні сценарії лікування на основі неоднорідного розподілу температури та клінічних планів променевої терапії. Вони розрахували EQDRT для 10 хворих на місцево-поширений рак шийки матки. Усі пацієнти отримували 23 × 2 Гр об’ємно-модульованої дугової терапії (VMAT) із застосуванням гіпертермії щотижня протягом курсу лікування.
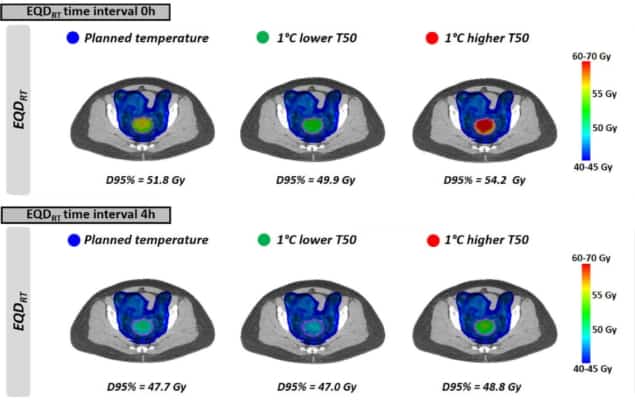
Як видно з рівномірних температур, EQDRT був найбільшим за найменший інтервал часу. Коли гіпертермія застосовувалася безпосередньо перед або після променевої терапії (часовий інтервал 0 годин), середнє EQDRT до 95% об’єму (D95%) становив 51.7 Гр – приріст 6.3 Гр лише за радіацію. Збільшення інтервалу часу до 4 год зменшило цей приріст до 2.2 Гр.
Модель передбачила, що більша частина збільшення дози втрачається протягом першої години. Таким чином, для клінічного використання час між променевою терапією та гіпертермією має бути якомога коротшим – в ідеалі пацієнти, які отримують обидва види лікування в одній лікарні. Команда зазначає, що хоча порядок двох процедур не є клінічно значущим, оскільки потрібен час, щоб нагріти пухлину, спочатку застосувавши гіпертермію, можна значно скоротити часові інтервали, навіть близькі до 0 годин.
Нарешті, дослідники змоделювали вплив досягнення трохи нижчих температур пухлини, ніж планувалося, через появу гарячих точок, що обмежують лікування. Вплив на EQDRT був найбільш вираженим протягом короткого інтервалу часу між променевою терапією та гіпертермією. Для нижчої температури на 1°C і інтервалу часу 0 годин, наприклад, середнє прогнозоване EQDRT(D95%) зменшилася на 1.8 Гр (з 51.7 до 49.9 Гр); для 4-годинного інтервалу зниження становило близько 0.7 Гр.
Променева терапія більш ефективна при розігрітих пухлинах
У випадках, коли гарячі точки не з’являються, можна збільшити вихідну потужність і досягти вищої температури, ніж планувалося. Знову ж таки, вигода від досягнення вищої температури була найбільшою за коротші проміжки часу, причому точний приріст залежав від фактично досягнутих температур.
«Біологічне моделювання дає відповідне уявлення про зв’язок між параметрами лікування та очікуваним EQDRT”, – підсумовують Кок і його колеги. «Як високі температури, так і короткі часові інтервали є важливими для максимізації EQDRT.