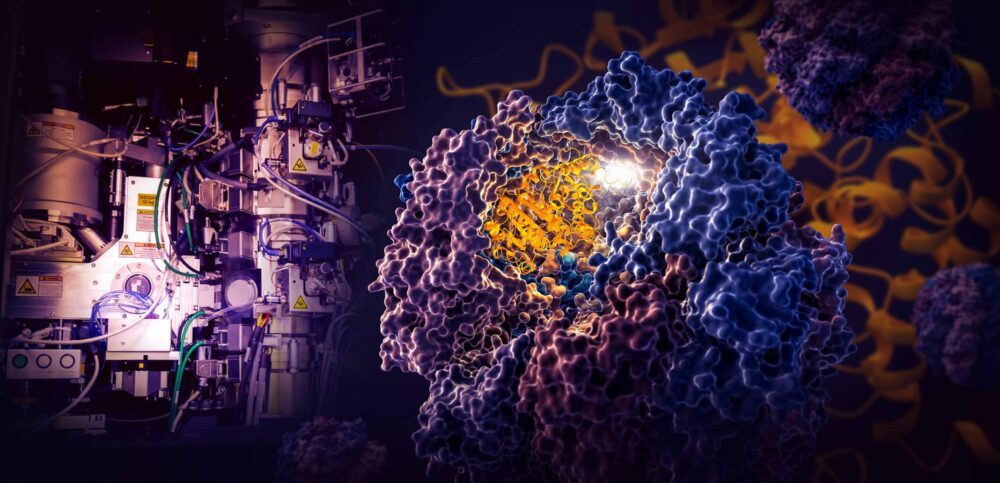
Một nghiên cứu mang tính bước ngoặt của các nhà nghiên cứu tại Phòng thí nghiệm Máy gia tốc Quốc gia SLAC của Bộ Năng lượng và Đại học Stanford cho thấy cách một cỗ máy tế bào nhỏ gọi là TRiC chỉ đạo quá trình gấp tubulin, một loại protein của con người là khối xây dựng của các vi ống đóng vai trò là giàn giáo và hệ thống vận chuyển của tế bào .
Cho đến nay, các nhà khoa học cho rằng TRiC và các máy tương tự, được gọi là người đi kèm, cung cấp một cách thụ động môi trường thuận lợi cho việc gấp, nhưng không trực tiếp tham gia vào việc đó.
Các nhà nghiên cứu ước tính có tới 10% protein trong tế bào của chúng ta, cũng như protein trong thực vật và động vật, nhận được sự trợ giúp trực tiếp từ những khoang nhỏ này để gấp lại thành hình dạng hoạt động cuối cùng của chúng.
Giáo sư Judith Frydman của Đại học Stanford, một trong những tác giả chính của nghiên cứu cho biết, nhiều protein có thể gấp lại với sự trợ giúp của TRiC có liên quan mật thiết đến các bệnh ở người, bao gồm một số bệnh ung thư và rối loạn thoái hóa thần kinh như bệnh Parkinson, Huntington và Alzheimer.
Trên thực tế, cô ấy nói, rất nhiều loại thuốc chống ung thư được thiết kế để phá vỡ tubulin và các vi ống mà nó hình thành, những thứ thực sự quan trọng đối với sự phân chia tế bào. Vì vậy, nhắm mục tiêu quy trình gấp tubulin được hỗ trợ bởi TRiC có thể cung cấp một chiến lược chống ung thư hấp dẫn.
Nhóm đã báo cáo kết quả nghiên cứu kéo dài hàng thập kỷ của họ trong một bài báo đăng trên tạp chí Pin hôm nay.
“Đây là cấu trúc protein thú vị nhất mà tôi đã nghiên cứu trong suốt 40 năm sự nghiệp của mình,” Giáo sư Wah Chiu của SLAC/Stanford, người tiên phong trong việc phát triển và sử dụng kính hiển vi điện tử đông lạnh (cryo-EM) và là giám đốc bộ phận hình ảnh sinh học và cryo-EM của SLAC.
“Khi tôi gặp Judith 20 năm trước,” ông nói, “chúng tôi đã nói về việc liệu chúng tôi có thể thấy các protein gấp lại hay không. Đó là điều mà mọi người đã cố gắng thực hiện trong nhiều năm và giờ chúng tôi đã làm được.”
Các nhà nghiên cứu đã nắm bắt được bốn bước riêng biệt trong quy trình gấp định hướng TRiC ở độ phân giải gần bằng nguyên tử với cryo-EM và xác nhận những gì họ thấy bằng các phân tích sinh hóa và lý sinh.
Ở cấp độ cơ bản nhất, Frydman cho biết, nghiên cứu này giải quyết bí ẩn lâu đời về lý do tại sao tubulin không thể gấp lại nếu không có sự hỗ trợ của TRiC: “Nó thực sự là một yếu tố thay đổi cuộc chơi khi cuối cùng đã mang đến một cách mới để hiểu cách protein gấp nếp trong tế bào người.”
Gấp spaghetti thành bông hoa
Protein đóng vai trò thiết yếu trong hầu hết mọi hoạt động của tế bào và việc tìm ra cách chúng gấp lại ở trạng thái 3D cuối cùng là một trong những nhiệm vụ quan trọng nhất trong hóa học và khoa học. sinh học.
Như Chiu nói, “Một loại protein ban đầu là một chuỗi các axit amin trông giống như mì spaghetti, nhưng nó không thể hoạt động cho đến khi nó được gấp lại thành một bông hoa có hình dạng phù hợp.”
Kể từ giữa những năm 1950, bức tranh của chúng ta về cách protein gấp nếp đã được định hình bằng các thí nghiệm được thực hiện bằng cách sử dụng các protein nhỏ của nhà nghiên cứu Christian Anfinsen của Viện Y tế Quốc gia. Ông phát hiện ra rằng nếu ông mở một protein nhỏ, nó sẽ tự động trở lại hình dạng cũ và kết luận rằng các hướng để làm điều đó được mã hóa trong chuỗi axit amin của protein. Anfinsen cùng nhận giải Nobel năm 1972 về hóa học cho khám phá này.
Ba mươi năm sau, các nhà nghiên cứu phát hiện ra rằng các cỗ máy tế bào chuyên dụng giúp protein gấp lại. Nhưng quan điểm phổ biến là chức năng của chúng bị giới hạn trong việc giúp các protein thực hiện quá trình gấp nếp tự phát của chúng bằng cách bảo vệ chúng khỏi bị mắc kẹt hoặc dính lại với nhau.
Một loại máy trợ giúp, được gọi là chaperonin, chứa một buồng giống như thùng chứa protein bên trong khi chúng gấp lại. TRiC phù hợp với thể loại này.
Buồng TRiC độc đáo ở chỗ nó bao gồm tám tiểu đơn vị khác nhau tạo thành hai vòng xếp chồng lên nhau. Một sợi protein tubulin dài, mảnh được đưa vào lỗ mở của buồng bởi một phân tử trợ giúp có hình dạng giống như một con sứa. Sau đó, nắp buồng đóng lại và quá trình gấp bắt đầu. Khi hoàn thành, nắp sẽ mở ra và những chiếc tubulin đã được gấp lại đã hoàn thành rời đi.
Vì tubulin không thể gấp lại nếu không có TRiC, nên có vẻ như TRiC có thể làm được nhiều việc hơn là giúp tubulin gấp một cách thụ động. Nhưng chính xác nó hoạt động như thế nào? Nghiên cứu mới này trả lời câu hỏi đó và chứng minh rằng, ít nhất là đối với các protein như tubulin, khái niệm “sự gấp nếp tự phát” không áp dụng được. Thay vào đó, TRiC trực tiếp sắp xếp con đường gấp nếp dẫn đến protein có hình dạng chính xác.
Frydman cho biết, mặc dù những tiến bộ gần đây trong trí tuệ nhân tạo, hay AI, có thể dự đoán cấu trúc gấp nếp, hoàn chỉnh của hầu hết các protein, nhưng AI không chỉ ra cách một protein đạt được hình dạng chính xác của nó. Kiến thức này là nền tảng để kiểm soát sự gấp nếp trong tế bào và phát triển các liệu pháp điều trị bệnh gấp nếp. Để đạt được mục tiêu này, các nhà nghiên cứu cần tìm ra các bước chi tiết của quá trình gấp nếp khi nó diễn ra trong tế bào.
Một buồng di động chịu trách nhiệm
Mười năm trước, Frydman, Chiu và nhóm nghiên cứu của họ quyết định tìm hiểu sâu hơn về những gì diễn ra trong buồng TRIC.
“So với các khoang gấp nếp đơn giản hơn của chaperonin ở vi khuẩn, TRiC trong tế bào người là một cỗ máy rất thú vị và phức tạp,” Frydman nói. “Mỗi trong số tám tiểu đơn vị của nó có các đặc tính khác nhau và thể hiện một bề mặt riêng biệt bên trong buồng, và điều này thực sự quan trọng.”
Các nhà khoa học phát hiện ra rằng bên trong buồng độc đáo này chỉ đạo quá trình gấp theo hai cách.

(Yanyan Zhao/Đại học Stanford)
Khi nắp của buồng đóng lại trên một protein, các vùng tích điện xuất hiện trên các bức tường bên trong của nó. Chúng thu hút các phần tích điện trái dấu của sợi protein tubulin và về cơ bản gắn chúng vào thành để tạo ra hình dạng và cấu hình thích hợp cho bước gấp tiếp theo. Trong khi đó, các “đuôi” tiểu đơn vị TRiC treo lủng lẳng trên thành buồng lấy protein tubulin vào những thời điểm và địa điểm cụ thể để neo giữ và ổn định nó.
Để bắt đầu, một đầu của sợi tubulin móc vào một cái túi nhỏ trên tường và gấp lại. Sau đó, đầu kia gắn vào một điểm khác, tạo ra một vòng lặp lớn. Vòng gấp theo cách đưa nó đến ngay bên cạnh khu vực gấp đầu tiên.
Ở bước ba, một phần của phần giữa gấp lại để tạo thành lõi của protein, cùng với các túi nơi GTP, một phân tử lưu trữ và giải phóng năng lượng để cung cấp năng lượng cho hoạt động của tế bào, có thể cắm vào.
Cuối cùng, phần protein còn lại gấp lại. Phân tử tubulin hiện đã sẵn sàng hoạt động.
“Những bức ảnh chụp nhanh về cấu trúc của các giai đoạn trung gian trong trình tự gấp nếp này chưa từng được nhìn thấy trước đây bằng kính hiển vi điện tử lạnh,” Frydman nói.
Một sự pha trộn mạnh mẽ của các kỹ thuật
Nhóm của cô đã xác nhận trình tự gấp bằng một loạt thử nghiệm sinh hóa và lý sinh đầy thử thách đòi hỏi nhiều năm nghiên cứu.
Việc giải thích những kết quả đó cho phép các nhà nghiên cứu xây dựng một bức tranh về hình dạng thay đổi của tubulin khi nó gấp lại bên trong buồng TRiC, phù hợp với hình ảnh do cryo-EM tạo ra.
“Thật tuyệt vời khi có thể chuyển đổi qua lại giữa các kỹ thuật này, bởi vì khi đó bạn có thể thực sự biết rằng những gì bạn nhìn thấy phản ánh những gì đang diễn ra trong phòng giam,” Frydman nói.
“Khoa học đã làm chúng ta ngạc nhiên với một giải pháp thực sự thú vị mà tôi không ngờ tới.”
Nghiên cứu cũng cung cấp manh mối để hiểu hệ thống gấp này phát triển như thế nào trong các tế bào nhân chuẩn, tạo nên thực vật, động vật và con người, nhưng không phải trong các tế bào đơn giản hơn như vi khuẩn và vi khuẩn cổ. Khi các protein ngày càng trở nên phức tạp hơn để phục vụ nhu cầu của các tế bào nhân chuẩn, các nhà nghiên cứu cho rằng, tại một số thời điểm, chúng không thể gấp lại thành hình dạng cần thiết để thực hiện các công việc phức tạp hơn nếu không có sự trợ giúp nhỏ. Các protein của sinh vật nhân chuẩn và buồng chaperonin của chúng có khả năng tiến hóa cùng nhau, có thể bắt đầu từ tổ tiên chung cuối cùng của tất cả các sinh vật nhân chuẩn khoảng 2.7 tỷ năm trước.
Do sự phức tạp của các phân tích và sự bùng phát của đại dịch, nghiên cứu đã diễn ra quá lâu đến nỗi nhiều người làm việc trong đó đã chuyển sang công việc khác. Họ bao gồm các nhà nghiên cứu sau tiến sĩ Daniel Gestaut và Miranda Collier từ nhóm của Frydman, những người đã thực hiện phần sinh hóa của dự án và đẩy nó về phía trước, và Yanyan Zhao, Soung-Hun Roh, Boxue Ma và Greg Pintilie từ nhóm của Chiu, những người đã thực hiện quá trình đông lạnh. -EM phân tích. Những người đóng góp khác bao gồm Junsun Park, một sinh viên trong nhóm của Roh, và Alexander Leitner từ ETH ở Zurich, Thụy Sĩ.
Công trình được hỗ trợ bởi các khoản tài trợ cho Wah Chiu và Judith Frydman từ NIH và tài trợ cho Soung-Hun Roh, hiện là trợ lý giáo sư tại Đại học Quốc gia Seoul, từ Quỹ Nghiên cứu Quốc gia Hàn Quốc và Quỹ Suh Kyungbae (SUHF).
Tham khảo nhật ký
- Daniel Gestaut và cộng sự, Hình dung cấu trúc của con đường gấp tubulin do người đi kèm con người TRiC/CCT chỉ đạo. Pin, ngày 8 tháng 2022 năm XNUMX DOI: 10.1016 / j.cell.2022.11.014