Bộ máy phân tử của cơ thể chúng ta bị hỏng theo tuổi tác.
Đột biến tích lũy DNA. Các đầu bảo vệ của chúng bị xói mòn. Ty thể, nhà máy sản xuất năng lượng của tế bào, hoạt động yếu kém và bị phá vỡ. Hệ thống miễn dịch trở nên rối loạn. Nguồn tế bào gốc dự trữ ngày càng cạn kiệt, trong khi một số tế bào trưởng thành chuyển sang trạng thái giống như thây ma, phun ra các hóa chất độc hại vào môi trường của chúng.
Hình ảnh nghe có vẻ thảm khốc, nhưng không phải tất cả đều là tin xấu. Lão hóa là một câu đố phức tạp. Bằng cách tìm ra từng mảnh riêng lẻ, các nhà khoa học có thể tập hợp một bức tranh đầy đủ về cách thức và lý do chúng ta già đi—đồng thời thiết kế những cách mới để ngăn chặn các triệu chứng liên quan đến tuổi tác.
Đã có một số thành công rồi. Senolytics—thuốc tiêu diệt tế bào zombie—đã được thử nghiệm lâm sàng. Lập trình lại một phần, giúp xóa danh tính của tế bào và đưa tế bào trở lại trạng thái giống như tế bào gốc, đang thu hút sự chú ý như một phương pháp điều trị thay thế đầy hứa hẹn và là một trong những khoản đầu tư kéo dài tuổi thọ hấp dẫn nhất ở Thung lũng Silicon.
Một nghiên cứu mới in Thiên nhiên săn lùng một mảnh khác cho câu đố cũ. Ở năm loài trong quy mô tiến hóa—giun, ruồi, chuột nhắt, chuột cống và con người—nhóm nghiên cứu đã mài giũa một quy trình phân tử quan trọng cung cấp năng lượng cho mọi tế bào đơn lẻ bên trong cơ thể và thoái hóa theo tuổi tác.
Quá trình, được gọi là phiên mã, là bước đầu tiên để biến vật liệu di truyền của chúng ta thành protein. Tại đây, các chữ cái DNA được làm lại thành một “sứ giả” được gọi là RNA, sau đó chuyển thông tin đến các phần khác của tế bào để tạo ra protein.
Các nhà khoa học từ lâu đã nghi ngờ rằng quá trình phiên mã có thể trở nên sai lệch khi lão hóa, nhưng nghiên cứu mới đưa ra bằng chứng rằng điều đó không xảy ra - với một sự thay đổi. Trong tất cả năm loài được thử nghiệm, khi sinh vật già đi, quá trình này tăng tốc một cách đáng ngạc nhiên. Nhưng giống như cố gắng gõ nhanh hơn khi bị bịt mắt, tỷ lệ lỗi cũng tăng lên.
Có một sửa chữa. Sử dụng hai biện pháp can thiệp được biết đến để kéo dài tuổi thọ, nhóm nghiên cứu đã có thể làm chậm quá trình phiên mã ở nhiều loài, bao gồm cả chuột. Đột biến gen đảo ngược quá trình phiên mã cẩu thả cũng kéo dài tuổi thọ ở giun và ruồi giấm, đồng thời tăng khả năng phân chia và phát triển của tế bào người.
Dấu hiệu lão hóa mới hầu như không sẵn sàng để thử nghiệm trên người. Nhưng “nó mở ra một lĩnh vực mới thực sự cơ bản để hiểu cách thức và lý do chúng ta già đi,” nói Tiến sĩ Lindsay Wu tại UNSW Sydney, người không tham gia vào nghiên cứu.
Biên tập gen
Biến bản thiết kế di truyền của chúng ta thành protein là một quá trình gồm hai bước.
Đầu tiên, bốn chữ cái của DNA—A, T, C và G—được phiên mã thành RNA. Cũng được tạo thành từ bốn chữ cái, RNA về cơ bản là các nốt phân tử có thể vượt qua không gian hạn chế của DNA để gửi thông điệp đến nhà máy sản xuất protein của tế bào. Ở đó, RNA được dịch sang ngôn ngữ của protein.
Bước đầu tiên—biến DNA thành RNA—khó hơn người ta tưởng. Để tiết kiệm không gian, DNA được quấn chặt quanh một nhóm protein gọi là histone, giống như thịt xông khói bao quanh tám cọng măng tây. Điều này “che giấu” thông tin di truyền một cách hiệu quả, khiến tế bào không thể đọc được.
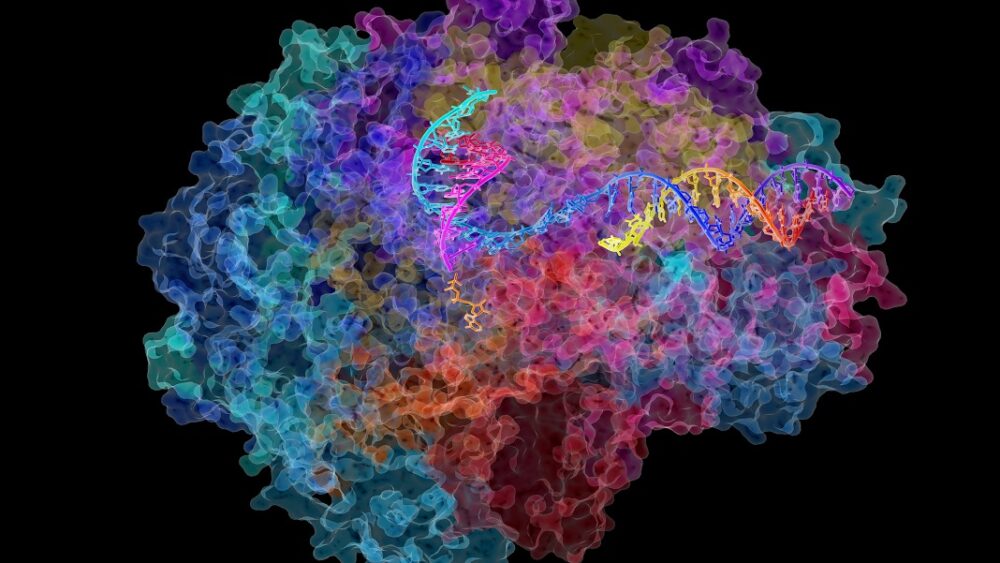
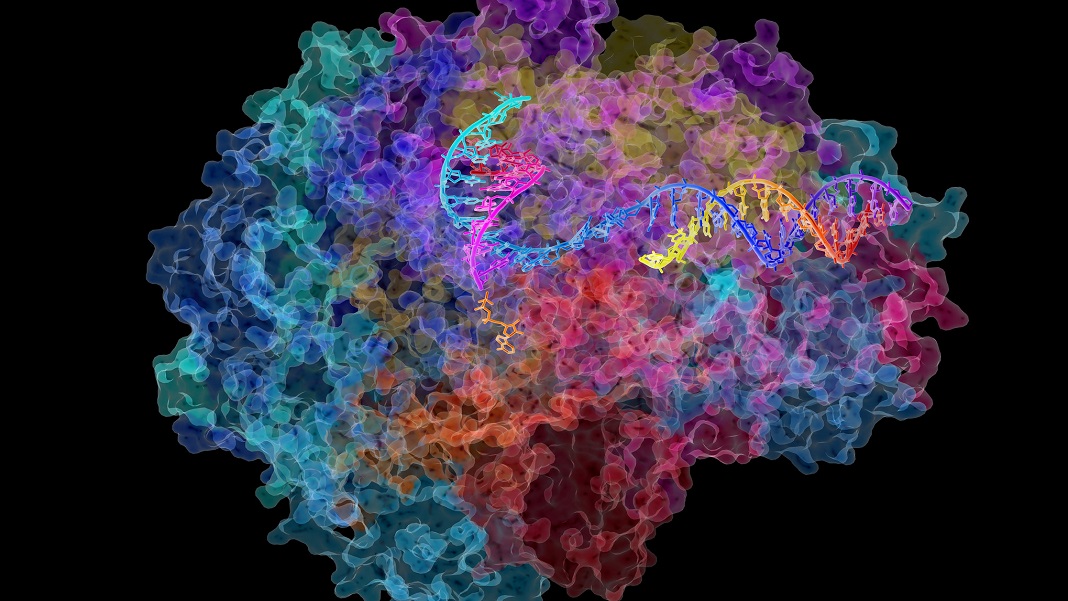
Cần cả một ngôi làng hỗ trợ protein để giải phóng DNA và chuẩn bị cho quá trình phiên mã. Nhưng ngôi sao chính là Pol II (RNA polymerase II), một đa phức hợp khổng lồ di chuyển dọc theo sợi DNA giúp nó biến đổi thành phiên bản đầu tiên của RNA, được gọi một cách khéo léo là tiền RNA.
Giống như một câu dài, tiền RNA sau đó được sao chép thành các chuỗi nhỏ hơn để tạo ra protein, một quá trình được gọi là ghép nối. Pol II giám sát toàn bộ quá trình, đảm bảo rằng hàng trăm nghìn RNA được tạo ra một cách hoàn hảo.
Tuy nhiên, khi chúng ta già đi, quá trình này xuống cấp. Không ai tìm ra lý do tại sao.
Nghiên cứu mới đặt câu hỏi: tại sao không tập trung vào ngôi sao của chương trình phiên mã?
Loài kéo dài
Giải mã các dấu hiệu lão hóa đi kèm với một trở ngại: một đầu mối tiềm năng có thể chỉ phù hợp với một loài.
Nghiên cứu mới đã giải quyết vấn đề trực tiếp bằng cách kiểm tra năm loài. Sử dụng một kỹ thuật gọi là giải trình tự RNA, họ đã nắm bắt được tốc độ của Pol II khi nó di chuyển DNA của giun, ruồi giấm, chuột nhắt, chuột cống và tế bào người ở các độ tuổi khác nhau. Các mẫu người có độ tuổi từ 21 đến 70, cùng với hai dòng tế bào nuôi cấy “bất tử”.
Để có cái nhìn toàn diện hơn, nhóm đã thử nghiệm các mẫu từ nhiều cơ quan, bao gồm não, gan, thận và máu.
Kết quả nhận lại thật bất ngờ. Mặc dù mọi loài đều có “chữ ký tốc độ” Pol II của riêng mình, nhưng xu hướng là giống nhau: Poll II tăng tốc giữa các loài theo tuổi trong mọi mô được kiểm tra. Gen hoặc mô chính xác không thành vấn đề. Sự thay đổi liên quan đến tuổi bao trùm khoảng 200 gen khác nhau ở nhiều loài. Thay vì một sự thay đổi cục bộ, việc tăng tốc Pol II dường như là một dấu hiệu lão hóa phổ quát.
Tuy nhiên, với tốc độ, đã xảy ra lỗi. Ghép nối—chỉnh sửa các tiền RNA—yêu cầu tốc độ Pol II phải ở trong vùng Goldilocks. Các tác giả giải thích rằng việc tăng tốc độ làm tăng nguy cơ dịch sai, mà trong các nghiên cứu trước đây “có liên quan đến tuổi cao và tuổi thọ bị rút ngắn”.
Họ cho biết: “Tốc độ của Pol II tăng lên có thể dẫn đến nhiều lỗi phiên mã hơn vì khả năng hiệu đính của Pol II bị thách thức.
Quay ngược đồng hồ
Nếu Pol II hoạt động quá mức góp phần vào quá trình lão hóa, liệu chúng ta có thể làm chậm quá trình đó lại—và từ đó chống lại sự lão hóa?
Trong một thử nghiệm, nhóm nghiên cứu đã khai thác hai phương pháp điều trị nổi tiếng để trì hoãn quá trình lão hóa: ức chế tín hiệu insulin và hạn chế calo. Ở giun, ruồi và chuột, việc làm gián đoạn di truyền con đường cảm nhận insulin đã làm chậm tốc độ của Pol II. Đưa chuột vào chế độ ăn kiêng ở tuổi trưởng thành sớm và trung niên - nhưng không phải ở tuổi già - cũng đã kìm hãm Pol II.
Một bài kiểm tra khác tập trung vào câu hỏi cuối cùng: gia tốc Pol II có làm lão hóa không? Tại đây, nhóm đã theo dõi một đàn sâu biến đổi gen và ruồi giấm mang đột biến làm giảm tốc độ Pol II của chúng. So với những người không đột biến, cả hai chủng được thiết kế đều kéo dài tuổi thọ của chúng từ 10 đến 20%.
Tuy nhiên, khi nhóm sử dụng CRISPR-Cas9 để đảo ngược các đột biến Pol II ở sâu, tuổi thọ của chúng bị rút ngắn và phù hợp với các đồng loại hoang dã. Các tác giả giải thích rằng có vẻ như Pol II là một nguyên nhân gây lão hóa.
Tại sao?
Tìm hiểu sâu hơn về bộ máy sao chép, nhóm đã tìm thấy một câu trả lời. Hãy nhớ rằng: DNA được bọc trong các bó măng tây thịt xông khói, được biết đến với tên khoa học là nucleosome. Bằng cách so sánh các tế bào tĩnh mạch rốn của con người và các tế bào phổi, nhóm nghiên cứu phát hiện ra rằng khi các tế bào già đi, các bó này dần dần giãn ra và phân rã. Điều này giúp Pol II dễ dàng trượt qua chuỗi DNA hơn, từ đó kích hoạt tăng tốc độ phiên mã.
Để kiểm tra thêm lý thuyết của họ, nhóm nghiên cứu đã chèn hai loại protein histone về mặt di truyền—phần măng tây của bó nhiễm sắc thể—để tạo thành nhiều nhiễm sắc thể hơn trong tế bào người trong đĩa Petri. Điều này lại tạo ra các gờ giảm tốc bổ sung cho Pol II và làm nó chậm lại.
Nó đã làm việc. Các tế bào có thêm protein histone ít có cơ hội trở thành tế bào lão hóa xác sống hơn. Ở ruồi giấm, một mô hình phổ biến để nghiên cứu về tuổi thọ, sự điều chỉnh di truyền đã mang lại cho chúng một cú hích tuổi thọ đáng chú ý.
Mặc dù vẫn còn rất sớm, nhưng kết quả này là một tin tuyệt vời cho tiềm năng theo đuổi một loại thuốc chống lão hóa mới. Pol II đã được nghiên cứu rộng rãi trong liệu pháp điều trị ung thư, với nhiều loại thuốc đã được thử nghiệm và phê duyệt, mang đến cơ hội tái sử dụng các loại thuốc này cho nghiên cứu kéo dài tuổi thọ.
Nhóm nghiên cứu cho biết: “Cùng với nhau, dữ liệu được trình bày ở đây tiết lộ một cơ chế phân tử góp phần vào quá trình lão hóa và đóng vai trò như một phương tiện để đánh giá độ trung thực của bộ máy tế bào trong quá trình lão hóa và bệnh tật.
Ảnh: David Bushnell, Ken Westover và Roger Kornberg, Đại học Stanford/NIH Image Gallery
- Phân phối nội dung và PR được hỗ trợ bởi SEO. Được khuếch đại ngay hôm nay.
- Platoblockchain. Web3 Metaverse Intelligence. Khuếch đại kiến thức. Truy cập Tại đây.
- Đúc kết tương lai với Adryenn Ashley. Truy cập Tại đây.
- nguồn: https://singularityhub.com/2023/04/18/this-longevity-study-across-5-species-found-a-new-pathway-to-reverse-aging/
- : có
- :là
- $ LÊN
- 10
- 70
- a
- có khả năng
- Có khả năng
- Tích trữ
- ngang qua
- thêm vào
- tiên tiến
- Lứa tuổi
- Lão hóa
- Tất cả
- dọc theo
- Đã
- thay thế
- Mặc dù
- và
- Một
- trả lời
- ngoài
- phê duyệt
- LÀ
- KHU VỰC
- xung quanh
- AS
- Đánh giá
- liên kết
- At
- tác giả
- trở lại
- Bad
- Về cơ bản
- BE
- bởi vì
- trở thành
- được
- Chặn
- máu
- thân hình
- tăng
- Thúc đẩy mạnh mẽ
- tăng
- Brain
- Nghỉ giải lao
- nghỉ giải lao
- Xây dựng
- by
- gọi là
- CAN
- Ung thư
- liệu pháp ung thư
- Sức chứa
- Nguyên nhân
- Tế bào
- thách thức
- cơ hội
- thay đổi
- tốt nghiệp lớp XNUMX
- Lâm sàng
- chống lại
- so
- so sánh
- phức tạp
- toàn diện
- góp phần
- phủ
- tạo ra
- tín dụng
- quan trọng
- dữ liệu
- sâu sắc hơn
- cung cấp
- Chế độ ăn uống
- khác nhau
- dire
- Bệnh
- dna
- xuống
- lái xe
- Thuốc
- suốt trong
- Đầu
- dễ dàng hơn
- hiệu quả
- kết thúc
- năng lượng
- ky sư
- đăng ký hạng mục thi
- Toàn bộ
- Môi trường
- lôi
- lỗi
- Ngay cả
- Mỗi
- Kiểm tra
- Giải thích
- thêm
- nhà máy
- Rơi
- nhanh hơn
- lòng trung thành
- hình
- tìm kiếm
- Tên
- Sửa chữa
- Trong
- hình thức
- tìm thấy
- 4
- từ
- Full
- cơ bản
- đạt được
- khổng lồ
- Go
- Đi
- tuyệt vời
- Nhóm
- Phát triển
- Có
- giúp đỡ
- tại đây
- nóng nhất
- Độ đáng tin của
- Tuy nhiên
- HTTPS
- Nhân loại
- Hàng trăm
- Bản sắc
- hình ảnh
- Hệ thống miễn dịch
- không thể
- in
- Bao gồm
- tăng
- hệ thống riêng biệt,
- thông tin
- Đầu Tư
- tham gia
- IT
- jpg
- Giết chết
- nổi tiếng
- Ngôn ngữ
- dẫn
- tuổi thọ
- Lượt thích
- dòng
- Gan
- địa phương
- dài
- tuổi thọ
- máy móc thiết bị
- thực hiện
- làm cho
- LÀM CHO
- Làm
- đánh dấu
- phù hợp
- vật liệu
- chất
- trưởng thành
- Có thể..
- có nghĩa
- cơ chế
- tin nhắn
- Tên đệm
- Ti thể
- kiểu mẫu
- phân tử
- chi tiết
- di chuyển
- nhiều
- Thiên nhiên
- Mới
- tin tức
- Nổi bật
- Chú ý
- tiểu thuyết
- of
- Cung cấp
- Xưa
- on
- ONE
- mở ra
- Nền tảng khác
- vfoXNUMXfipXNUMXhfpiXNUMXufhpiXNUMXuf
- riêng
- Hòa bình
- một phần
- các bộ phận
- qua
- phần trăm
- hình ảnh
- mảnh
- miếng
- plato
- Thông tin dữ liệu Plato
- PlatoDữ liệu
- bỏ phiếu
- hồ bơi
- Phổ biến
- tiềm năng
- có khả năng
- quyền hạn
- Chuẩn bị
- trình bày
- trước
- Vấn đề
- quá trình
- hứa hẹn
- bằng chứng
- bảo vệ
- Protein
- Protein
- cung cấp
- Đặt
- câu đố
- câu hỏi
- CON CHUỘT
- Giá
- hơn
- Đọc
- sẵn sàng
- giảm
- có liên quan
- nhớ
- nghiên cứu
- Dự trữ
- sự hạn chế
- Kết quả
- tiết lộ
- đảo ngược
- Nguy cơ
- RNA
- Cán
- khoảng
- Nói
- tương tự
- các nhà khoa học
- dường như
- dường như
- kết án
- giải trình tự
- phục vụ
- hiển thị
- Silicon
- Silicon Valley
- duy nhất
- Trượt
- chậm
- chậm rãi
- một số
- Không gian
- tốc độ
- tốc độ
- Ngôi sao
- Tiểu bang
- hơi nước
- thân cây
- Tế bào gốc
- Bước
- Vẫn còn
- Chủng
- nghiên cứu
- Học tập
- vấp
- thành công
- bất ngờ
- sydney
- Các triệu chứng
- hệ thống
- mất
- Khai thác
- nhóm
- thử nghiệm
- Kiểm tra
- việc này
- Sản phẩm
- thông tin
- cung cấp their dịch
- Them
- hàng ngàn
- chặt lấy
- đến
- Chuyển đổi
- điều trị
- khuynh hướng
- kích hoạt
- XOAY
- Quay
- xoắn
- loại
- cuối cùng
- sự hiểu biết
- phổ cập
- bung ra
- đã sử dụng
- thung lũng
- phiên bản
- Xem
- Village
- cách
- nổi tiếng
- cái nào
- trong khi
- CHÚNG TÔI LÀ
- toàn bộ
- với
- làm việc
- sâu
- giun
- Bọc
- wu
- năm
- zephyrnet