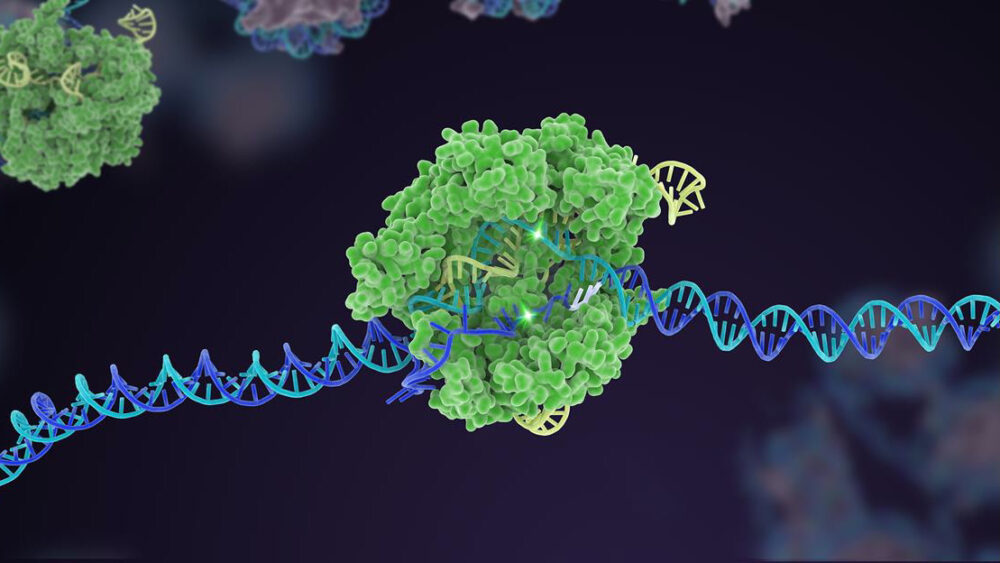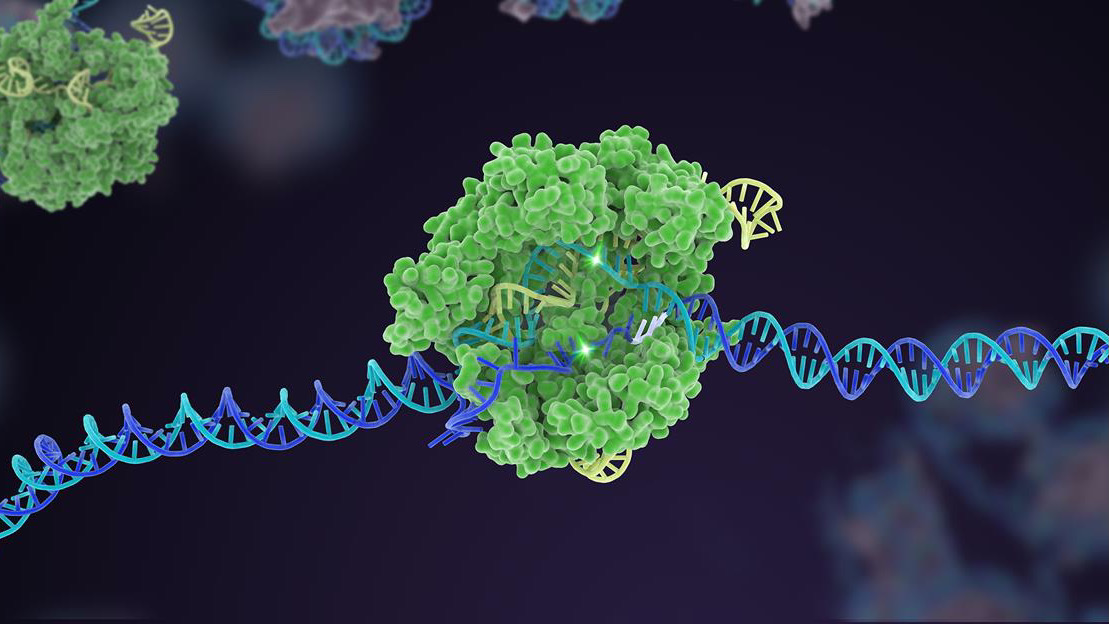
Mười năm trước, một cơ chế bảo vệ vi khuẩn ít được biết đến đã trở nên nổi tiếng như một công cụ chỉnh sửa bộ gen mạnh mẽ. Trong thập kỷ kể từ đó, CRISPR-Cas9 đã tạo ra nhiều biến thể, mở rộng thành một hộp công cụ toàn diện có thể chỉnh sửa mã di truyền của sự sống.
Khác xa với việc theo đuổi tháp ngà, những ứng dụng thực tế của nó trong nghiên cứu, chăm sóc sức khỏe và nông nghiệp đã diễn ra nhanh chóng và dữ dội.
Bạn đã thấy các tiêu đề. FDA đã phê duyệt việc sử dụng nó trong giải quyết đột biến gen cơ bản cho bệnh hồng cầu hình liềm. Một số nhà nghiên cứu các tế bào miễn dịch được chỉnh sửa để chống lại bệnh ung thư máu không thể chữa khỏi ở trẻ em. Những người khác lấy ghép tạng từ lợn sang người từ giấc mơ thành hiện thực trong nỗ lực giảm bớt tình trạng thiếu nội tạng của người hiến tặng. Công việc gần đây nhằm mục đích giúp đỡ hàng triệu người có lượng cholesterol cao—và có khả năng đưa liệu pháp gen dựa trên CRISPR đến với đại chúng—bằng cách giảm nguy cơ mắc bệnh tim với một mũi tiêm duy nhất.
Nhưng đối với Tiến sĩ Jennifer Doudna, người đã giành giải thưởng Nobel năm 2020 vì vai trò của cô ấy trong việc phát triển CRISPR, chúng ta mới chỉ khám phá ra tiềm năng của nó. Cùng với sinh viên tốt nghiệp Joy Wang, Doudna đã vạch ra lộ trình cho thập kỷ tiếp theo của công nghệ trong một bài báo in Khoa học.
Nếu những năm 2010 tập trung vào việc thiết lập hộp công cụ CRISPR và chứng minh tính hiệu quả của nó, thì thập kỷ này là khi công nghệ phát huy hết tiềm năng của nó. Từ các liệu pháp dựa trên CRISPR và màn hình quy mô lớn để chẩn đoán bệnh cho đến cải tiến cây trồng năng suất cao và thực phẩm bổ dưỡng, công nghệ “và tác động tiềm tàng của nó vẫn đang ở giai đoạn đầu,” các tác giả viết.
Một thập kỷ nổi bật
Chúng tôi đã tốn rất nhiều giấy mực về những tiến bộ của CRISPR, nhưng việc xem lại quá khứ để dự đoán tương lai và có khả năng tìm ra các vấn đề trong quá trình thực hiện là điều đáng làm.
Một điểm nổi bật ban đầu là khả năng đáng kinh ngạc của CRISPR trong việc thiết kế nhanh chóng các mô hình bệnh tật ở động vật. Dạng ban đầu của nó dễ dàng lấy đi một gen mục tiêu trong phôi rất sớm, khi được cấy vào tử cung có thể tạo ra những con chuột biến đổi gen chỉ trong một tháng, so với một năm khi sử dụng các phương pháp trước đó. Các phiên bản CRISPR bổ sung, chẳng hạn như chỉnh sửa cơ bản—hoán đổi một chữ cái di truyền cho một chữ cái khác—và chỉnh sửa nguyên tố—cắt DNA mà không cắt cả hai sợi—tăng cường hơn nữa tính linh hoạt của bộ công cụ trong kỹ thuật tạo ra các chất hữu cơ biến đổi gen (suy nghĩ bộ não nhỏ) và động vật. CRISPR đã nhanh chóng thiết lập hàng chục mô hình cho một số căn bệnh nguy hiểm và khó hiểu nhất của chúng ta, bao gồm các loại ung thư khác nhau, bệnh Alzheimer và chứng loạn dưỡng cơ Duchenne—một chứng rối loạn thoái hóa trong đó cơ bắp dần dần bị lãng phí. Hàng chục thử nghiệm dựa trên CRISPR hiện đang trong các tác phẩm.
CRISPR cũng đẩy nhanh quá trình sàng lọc di truyền trong thời đại dữ liệu lớn. Thay vì nhắm mục tiêu vào một gen tại một thời điểm, giờ đây có thể làm im lặng hoặc kích hoạt song song hàng nghìn gen, tạo thành một loại đá Rosetta để chuyển những nhiễu loạn di truyền thành những thay đổi sinh học. Điều này đặc biệt quan trọng để hiểu được các tương tác di truyền, chẳng hạn như những tương tác trong bệnh ung thư hoặc lão hóa mà trước đây chúng ta không biết và đạt được cơ sở mới để phát triển thuốc.
Nhưng một thành tựu nổi bật của CRISPR là chỉnh sửa ghép kênh. Giống như việc gõ đồng thời nhiều phím đàn piano, loại kỹ thuật di truyền này nhắm vào nhiều vùng DNA cụ thể, nhanh chóng thay đổi cấu trúc di truyền của bộ gen trong một lần.
Công nghệ này hoạt động trong thực vật và động vật. Trong hàng nghìn năm, con người đã dày công lai tạo các loại cây trồng với các đặc điểm mong muốn—có thể là màu sắc, kích thước, mùi vị, dinh dưỡng hoặc khả năng phục hồi bệnh tật. CRISPR có thể giúp chọn lọc nhiều tính trạng hoặc thậm chí thuần hóa cây trồng mới chỉ trong một thế hệ. Bò tót không sừng do CRISPR tạo ra, cà chua giàu dinh dưỡng, và động vật trang trại siêu cơ bắp và cá đã là hiện thực. Với dân số thế giới đạt 8 tỷ vào năm 2022 và hàng triệu người bị đói, CRISPR-red-crops có thể cứu cánh—nghĩa là, nếu mọi người sẵn sàng chấp nhận công nghệ.
Con đường phía trước
Chúng ta sẽ đi đâu từ đây?
Đối với các tác giả, chúng ta cần nâng cao hơn nữa hiệu quả của CRISPR và tạo dựng niềm tin. Điều này có nghĩa là quay lại những điều cơ bản để tăng độ chính xác và độ chính xác chỉnh sửa của công cụ. Ở đây, các nền tảng để phát triển nhanh chóng enzym Cas, thành phần “cắt kéo” của bộ máy CRISPR, là rất quan trọng.
Đã có những thành công: một phiên bản Cas, ví dụ, hoạt động như một lan can bảo vệ cho thành phần nhắm mục tiêu—"chó săn máu" sgRNA. Trong CRISPR cổ điển, sgRNA hoạt động một mình, nhưng trong phiên bản cập nhật này, nó gặp khó khăn trong việc liên kết mà không có sự trợ giúp của Cas. Thủ thuật này giúp chỉnh sửa phù hợp với một vị trí DNA cụ thể và tăng độ chính xác để quá trình cắt hoạt động như dự đoán.
Các chiến lược tương tự cũng có thể tăng cường độ chính xác với ít tác dụng phụ hơn hoặc chèn các gen mới vào các tế bào như tế bào thần kinh và các tế bào khác không còn phân chia. Mặc dù đã có thể với chỉnh sửa chính, nhưng hiệu quả của nó có thể là Thấp hơn 30 lần hơn cơ chế CRISPR cổ điển.
Các tác giả cho biết: “Mục tiêu chính của chỉnh sửa chính trong thập kỷ tới là nâng cao hiệu quả mà không ảnh hưởng đến độ tinh khiết của sản phẩm chỉnh sửa—một kết quả có khả năng biến chỉnh sửa chính thành một trong những công cụ linh hoạt nhất để chỉnh sửa chính xác”.
Nhưng có lẽ quan trọng hơn là việc giao hàng, vốn vẫn là một nút cổ chai, đặc biệt là đối với phương pháp trị liệu. Hiện tại, CRISPR thường được sử dụng trên các tế bào bên ngoài cơ thể được truyền trở lại—như trong trường hợp của CAR-T—hoặc trong một số trường hợp, được buộc vào vật mang vi-rút hoặc được bọc trong bong bóng chất béo và tiêm vào cơ thể. Đã có những thành công: trong 2021, FDA đã phê duyệt cảnh quay dựa trên CRISPR đầu tiên để giải quyết một bệnh về máu di truyền, bệnh amyloidosis transthyretin.
Tuy nhiên, cả hai chiến lược đều có vấn đề: không nhiều loại tế bào có thể sống sót qua phương pháp điều trị CAR-T—sẽ chết khi được đưa trở lại vào cơ thể—và việc nhắm mục tiêu vào các mô và cơ quan cụ thể hầu như nằm ngoài tầm với của các liệu pháp tiêm.
Các tác giả cho biết, một bước tiến quan trọng trong thập kỷ tới là đưa hàng hóa CRISPR vào mô mục tiêu mà không gây hại và giải phóng trình chỉnh sửa gen tại vị trí đã định. Mỗi bước trong số này, mặc dù có vẻ đơn giản trên giấy tờ, đều đưa ra những thách thức riêng đòi hỏi cả kỹ thuật sinh học và đổi mới phải vượt qua.
Cuối cùng, CRISPR có thể phối hợp với các tiến bộ công nghệ khác, các tác giả cho biết. Ví dụ, bằng cách khai thác hình ảnh tế bào và học máy, chúng ta có thể sớm thiết kế các trình chỉnh sửa bộ gen hiệu quả hơn nữa. Nhờ vào trình tự DNA nhanh hơn và rẻ hơn, sau đó chúng ta có thể dễ dàng theo dõi các hậu quả chỉnh sửa gen. Những dữ liệu này sau đó có thể cung cấp một loại cơ chế phản hồi để thiết kế các trình chỉnh sửa bộ gen thậm chí còn mạnh mẽ hơn trong một vòng lặp hoàn hảo.
Tác động trong thế giới thực
Các tác giả cho biết, mặc dù việc mở rộng hơn nữa hộp công cụ CRISPR đang nằm trong chương trình nghị sự, nhưng công nghệ này đã đủ trưởng thành để tác động đến thế giới thực trong thập kỷ thứ hai của nó.
Trong tương lai gần, chúng ta sẽ thấy “ngày càng có nhiều phương pháp điều trị dựa trên CRISPR chuyển sang các giai đoạn thử nghiệm lâm sàng sau này”. Nhìn xa hơn, công nghệ này, hoặc các biến thể của nó, có thể biến việc cấy ghép nội tạng từ lợn sang người thành thói quen, thay vì thử nghiệm. Sàng lọc quy mô lớn để tìm các gen dẫn đến lão hóa hoặc thoái hóa não hoặc bệnh tim - kẻ giết người hàng đầu của chúng ta ngày nay - có thể mang lại các phương pháp điều trị dự phòng dựa trên CRISPR. Đó không phải là nhiệm vụ dễ dàng: chúng ta cần cả kiến thức về di truyền học làm cơ sở cho các bệnh di truyền nhiều mặt—tức là, khi nhiều gen xuất hiện—và một cách để cung cấp các công cụ chỉnh sửa cho mục tiêu của chúng. Các tác giả cho biết: “Nhưng những lợi ích tiềm năng có thể thúc đẩy sự đổi mới trong những lĩnh vực này vượt xa những gì có thể đạt được hiện nay”.
Tuy nhiên, quyền lực càng lớn thì trách nhiệm càng lớn. CRISPR đã phát triển với tốc độ chóng mặt và các cơ quan quản lý cũng như công chúng vẫn đang phải vật lộn để bắt kịp. Có lẽ ví dụ nổi tiếng nhất là của Trẻ sơ sinh CRISPR, nơi các thí nghiệm được thực hiện chống lại các nguyên tắc đạo đức toàn cầu đẩy ra một tập đoàn quốc tế đặt ra ranh giới đỏ cho việc chỉnh sửa tế bào mầm của con người.
Tương tự, các sinh vật biến đổi gen (GMO) vẫn là một chủ đề gây tranh cãi. Mặc dù CRISPR chính xác hơn nhiều so với các công cụ di truyền trước đây, nhưng người tiêu dùng sẽ quyết định có nên chào đón hay không một thế hệ mới của thực phẩm tiến hóa của con người—cả thực vật và động vật.
đó là các cuộc hội thoại quan trọng cần diễn ngôn toàn cầu khi CRISPR bước vào thập kỷ thứ hai. Nhưng đối với các tác giả, tương lai có vẻ tươi sáng.
Họ nói: “Giống như trong sự ra đời của chỉnh sửa bộ gen CRISPR, sự kết hợp giữa tính tò mò khoa học và mong muốn mang lại lợi ích cho xã hội sẽ thúc đẩy thập kỷ đổi mới tiếp theo trong công nghệ CRISPR”. “Bằng cách tiếp tục khám phá thế giới tự nhiên, chúng ta sẽ khám phá ra những điều không thể tưởng tượng được và đưa nó vào sử dụng trong thế giới thực vì lợi ích của hành tinh này.”
Ảnh: NIH
- Phân phối nội dung và PR được hỗ trợ bởi SEO. Được khuếch đại ngay hôm nay.
- Platoblockchain. Web3 Metaverse Intelligence. Khuếch đại kiến thức. Truy cập Tại đây.
- nguồn: https://singularityhub.com/2023/01/25/crisprs-wild-first-decade-only-scratches-the-surface-of-its-potential/
- 2020
- a
- có khả năng
- tăng tốc
- Chấp nhận
- chính xác
- thành tích
- hành vi
- thêm vào
- tiến
- tiên tiến
- tiến bộ
- sự xuất hiện
- chống lại
- cơ quan
- chương trình nghị sự
- Lão hóa
- nông nghiệp
- trước
- Mục tiêu
- giảm bớt
- cô đơn
- Đã
- Mặc dù
- Alzheimer
- đạn dược
- và
- động vật
- động vật
- phê duyệt
- khu vực
- Hỗ trợ
- tác giả
- trở lại
- cơ sở
- Khái niệm cơ bản
- hưởng lợi
- Lợi ích
- Berkeley
- Ngoài
- lớn
- Dữ Liệu Lớn.
- Tỷ
- ràng buộc
- máu
- Bloomberg
- thân hình
- tăng
- Thúc đẩy mạnh mẽ
- Brain
- mang lại
- xây dựng
- xây dựng lòng tin
- Ung thư
- không thể
- trường hợp
- trường hợp
- Catch
- Tế bào
- thách thức
- tỷ lệ cược
- Những thay đổi
- thay đổi
- rẻ hơn
- cổ điển
- Lâm sàng
- các thử nghiệm lâm sàng
- mã
- màu sắc
- kết hợp
- Đến
- so
- thành phần
- toàn diện
- ảnh hưởng
- Hậu quả
- tập đoàn
- Người tiêu dùng
- tiếp tục
- gây tranh cãi
- cuộc hội thoại
- có thể
- tín dụng
- CRISPR
- quan trọng
- cây trồng
- sự tò mò
- Hiện nay
- Cắt
- cắt
- dữ liệu
- thập kỷ
- Phòng thủ
- cung cấp
- giao hàng
- phát triển
- Phát triển
- khám phá
- Bệnh
- bệnh
- dna
- xuống
- hàng chục
- giấc mơ
- lái xe
- thuốc
- suốt trong
- mỗi
- Đầu
- dễ dàng
- biên tập viên
- hiệu quả
- hiệu ứng
- hiệu quả
- hiệu quả
- đóng gói
- ky sư
- Kỹ Sư
- Nhập cảnh
- đặc biệt
- thành lập
- thành lập
- đạo đức
- Ngay cả
- phát triển
- ví dụ
- mở rộng
- khám phá
- FAME
- trang trại
- NHANH
- fda
- thông tin phản hồi
- chiến đấu
- Tên
- Linh hoạt
- tập trung
- thực phẩm
- hình thức
- từ
- Full
- xa hơn
- tương lai
- đạt được
- nói chung
- tạo ra
- thế hệ
- kỹ thuật di truyền
- di truyền học
- Toàn cầu
- Go
- mục tiêu
- đi
- tốt nghiệp
- lớn hơn
- hướng dẫn
- Tiêu đề
- chăm sóc sức khỏe
- Trái Tim
- giúp đỡ
- giúp
- tại đây
- Cao
- Đánh dấu
- HTTPS
- Nhân loại
- Hình ảnh
- Va chạm
- quan trọng
- cải thiện
- in
- Bao gồm
- Tăng lên
- tăng
- Tăng
- đáng kinh ngạc
- sự đổi mới
- tương tác
- Quốc Tế
- IT
- Jennifer
- chỉ một
- Key
- phím
- kẻ giết người
- Loại
- kiến thức
- quy mô lớn
- dẫn
- học tập
- cho vay
- bức thư
- Cuộc sống
- Dòng
- còn
- tìm kiếm
- NHÌN
- máy
- học máy
- máy móc thiết bị
- Chủ yếu
- làm cho
- trang điểm
- nhiều
- trưởng thành
- có nghĩa
- cơ chế
- phương pháp
- hàng triệu
- mô hình
- sửa đổi
- Màn Hình
- tháng
- chi tiết
- hiệu quả hơn
- hầu hết
- di chuyển
- nhiều mặt
- nhiều
- Tự nhiên
- Thiên nhiên
- Gần
- Cần
- Neurons
- Mới
- tiếp theo
- NHS
- NIH
- giải thưởng Nobel
- khét tiếng
- con số
- ONE
- nguyên
- Nền tảng khác
- Khác
- bên ngoài
- Vượt qua
- riêng
- Giấy
- Song song
- qua
- con đường
- nước
- người
- có lẽ
- hành tinh
- Cây cối
- Nền tảng
- plato
- Thông tin dữ liệu Plato
- PlatoDữ liệu
- Rất nhiều
- dân số
- có thể
- tiềm năng
- có khả năng
- quyền lực
- mạnh mẽ
- Thực tế
- Độ chính xác
- dự đoán
- dự đoán
- quà
- trước
- trước đây
- Thủ tướng Chính phủ
- giải thưởng
- vấn đề
- Sản phẩm
- cho
- công khai
- đặt
- nhanh chóng
- đạt
- Đạt
- thực
- thế giới thực
- Thực tế
- gần đây
- đỏ
- nhà quản lý
- phát hành
- vẫn
- vẫn còn
- yêu cầu
- nghiên cứu
- nhà nghiên cứu
- khả năng phục hồi
- trách nhiệm
- Giàu
- lộ trình
- Vai trò
- Nói
- Khoa học
- Hướng đạo
- sàng lọc
- màn hình
- Thứ hai
- định
- sự thiếu
- nên
- bên
- Sự im lặng
- Đơn giản
- đồng thời
- kể từ khi
- duy nhất
- website
- Kích thước máy
- chậm rãi
- So
- Xã hội
- một số
- riêng
- tốc độ
- Spot
- quay
- giai đoạn
- Các bước
- Vẫn còn
- STONE
- chiến lược
- Đấu tranh
- Đấu tranh
- Sinh viên
- như vậy
- đau khổ
- Bề mặt
- tồn tại
- Mục tiêu
- nhắm mục tiêu
- nhắm mục tiêu
- mục tiêu
- Nhiệm vụ
- công nghệ
- Công nghệ
- Sản phẩm
- Khái niệm cơ bản
- thế giới
- cung cấp their dịch
- trị liệu
- hàng ngàn
- thời gian
- thời gian
- đến
- bây giờ
- bên nhau
- Hộp công cụ
- công cụ
- hàng đầu
- chủ đề
- Tháp
- thử nghiệm
- NIỀM TIN
- XOAY
- loại
- UN
- cơ bản
- sự hiểu biết
- cập nhật
- sử dụng
- khác nhau
- linh hoạt
- phiên bản
- chào mừng
- Điều gì
- Là gì
- liệu
- cái nào
- trong khi
- CHÚNG TÔI LÀ
- Hoang dã
- sẽ
- sẵn sàng
- không có
- Won
- Công việc
- công trinh
- thế giới
- năm
- năm
- Năng suất
- zephyrnet