Các nhà nghiên cứu tại Trung tâm Y tế Đại học Duke đã phát triển một hệ thống phát hiện hỗ trợ máy tính (CAD) dựa trên học sâu để xác định các di căn não khó phát hiện trên hình ảnh cộng hưởng từ. Thuật toán thể hiện độ nhạy và độ đặc hiệu tuyệt vời, vượt trội so với các hệ thống CAD khác đang được phát triển. Công cụ này cho thấy tiềm năng cho phép xác định sớm hơn các di căn não mới nổi, cho phép chúng được nhắm mục tiêu bằng phương pháp phẫu thuật phóng xạ lập thể (SRS) khi chúng xuất hiện lần đầu tiên và đối với một số bệnh nhân, giảm số lần điều trị cần thiết.
SRS, sử dụng các chùm photon hội tụ chính xác để cung cấp liều lượng bức xạ cao tới các mục tiêu trong não trong một buổi xạ trị duy nhất, đang phát triển thành phương pháp điều trị chăm sóc tiêu chuẩn cho những bệnh nhân có số lượng di căn não hạn chế. Tuy nhiên, để nhắm mục tiêu di căn, trước tiên nó phải được xác định trên hình ảnh MR. Thật không may, khoảng 10% là không, 30% đối với những kích thước nhỏ hơn 3 mm, ngay cả khi được xem xét bởi các chuyên gia thần kinh học.
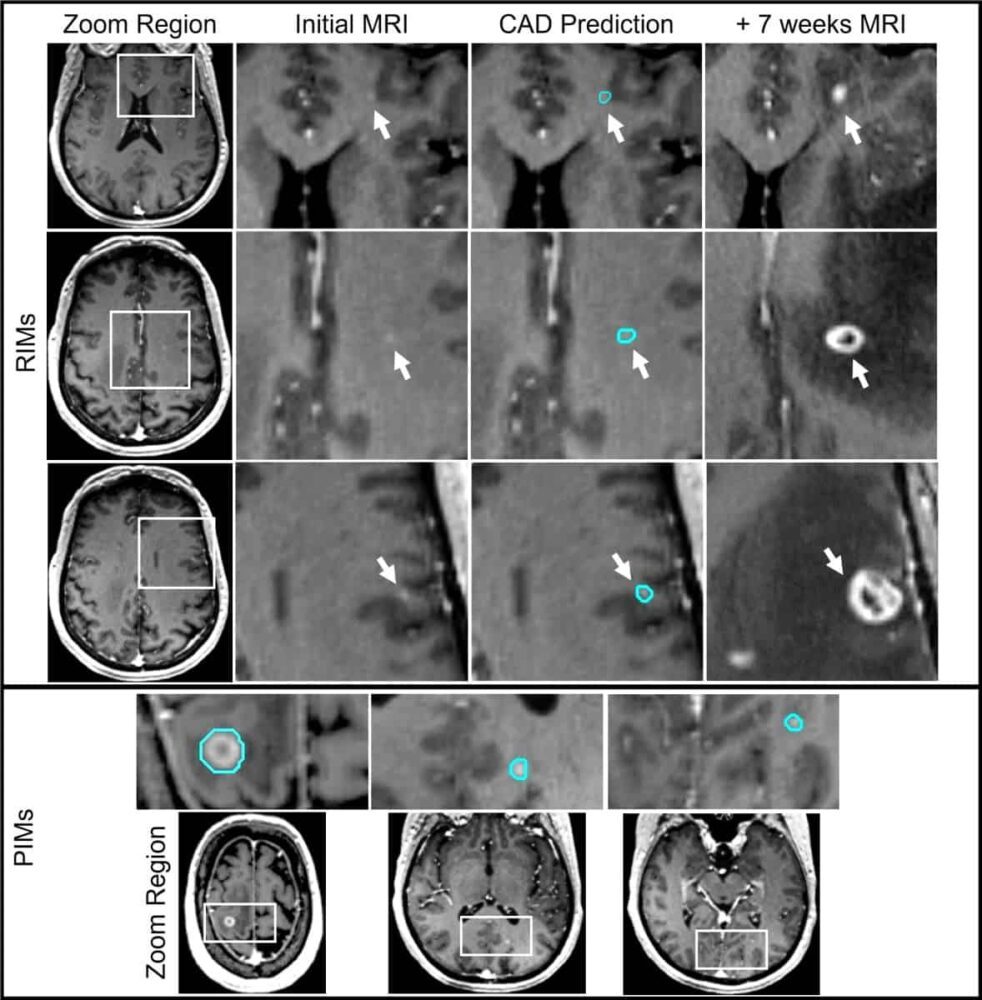
Khi những di căn não chưa được phát hiện này – mà các nhà nghiên cứu gọi là di căn được xác định hồi cứu (RIM) – được xác định trong các lần quét MRI tiếp theo, thì thường cần phải điều trị SRS lần thứ hai. Phương pháp điều trị như vậy rất tốn kém, có thể gây khó chịu và xâm lấn, đôi khi cần phải cố định đầu với khung được cố định vào hộp sọ bằng ghim.
Tại Hội nghị thường niên ASTRO gần đây, Devon Godfrey giải thích rằng các nhà nghiên cứu đã thiết kế hệ thống CAD dựa trên mạng thần kinh tích chập (CNN) đặc biệt để cải thiện khả năng phát hiện và phân đoạn các RIM khó phát hiện và các di căn tiềm năng rất nhỏ được xác định (PIM). Godfrey và các đồng nghiệp mô tả việc thử nghiệm và xác nhận hệ thống này trong Tạp chí quốc tế về ung thư học phóng xạ Vật lý sinh học.
Nhóm đã đào tạo công cụ CAD trên dữ liệu MRI (chuỗi tiếng vang độ dốc bị hỏng được tăng cường độ tương phản) từ 135 bệnh nhân với 563 di căn não. Các hình ảnh được thu thập bằng máy quét MRI 1.5 T và 3.0 T từ các nhà cung cấp khác nhau tại nhiều địa điểm của Duke Health. Tổng cộng, bộ dữ liệu bao gồm 491 PIM có đường kính trung bình là 6.7 mm và 72 RIM từ 32 bệnh nhân, với đường kính trung bình là 2.7 mm.
Để xác định RIM, các nhà nghiên cứu đã xem xét các hình ảnh MR ban đầu của từng bệnh nhân để tìm kiếm các dấu hiệu tăng cường độ tương phản ở vị trí chính xác nơi phát hiện di căn sau đó. Sau khi xem xét, họ đã phân loại từng RIM là đáp ứng các tiêu chí chẩn đoán dựa trên hình ảnh (+DC) hoặc không có đủ thông tin hình ảnh (-DC) để được xác định là di căn.
Các nhà nghiên cứu đã chọn ngẫu nhiên bộ dữ liệu của RIM và PIM thành năm nhóm, sử dụng bốn nhóm trong số này để phát triển mô hình và thuật toán và một nhóm làm nhóm thử nghiệm. Họ báo cáo: “Việc bao gồm cả RIM +DC và -DC dẫn đến độ nhạy cao nhất đối với mọi loại và kích thước di căn não, đồng thời mang lại tỷ lệ dương tính giả thấp nhất và giá trị tiên đoán dương tính cao nhất”. “Điều này cho thấy lợi ích rõ ràng của việc bao gồm một mẫu di căn não nhỏ đầy thách thức quá mức vào dữ liệu đào tạo CAD.”
Đối với PIM và +DC RIM – có đặc điểm di căn rõ ràng trên MRI – mô hình đạt được độ nhạy tổng thể là 93%, từ 100% đối với các tổn thương có đường kính lớn hơn 6 mm đến 79% đối với các tổn thương có đường kính nhỏ hơn 3 mm. Tỷ lệ dương tính giả cũng thấp một cách ấn tượng, trung bình là 2.7 trên mỗi người, so với từ 35 đến XNUMX trong các hệ thống CAD khác có độ nhạy phát hiện tương đương đối với các tổn thương nhỏ.
Hệ thống CAD cũng có thể phát hiện một số RIM -DC trong cả bộ phát triển và bộ thử nghiệm. Việc xác định di căn não ở giai đoạn sớm nhất này sẽ là một lợi thế lâm sàng lớn, vì những tổn thương như vậy sau đó có thể được theo dõi kỹ lưỡng hơn bằng hình ảnh, điều trị nhanh chóng nếu cần.
Nhóm Duke hiện đang làm việc để cải thiện độ chính xác của công cụ CAD bằng cách sử dụng nhiều chuỗi MR. Godfrey giải thích rằng các nghiên cứu MRI não hầu như luôn bao gồm nhiều chuỗi MR tạo ra thông tin duy nhất về mọi điểm ảnh ba chiều trong não. Ông nói: “Chúng tôi tin rằng việc kết hợp thông tin bổ sung có sẵn từ các trình tự khác này sẽ cải thiện độ chính xác của nó.
Godfrey lưu ý rằng các nhà nghiên cứu chỉ còn vài tuần nữa là khởi động một nghiên cứu sử dụng lâm sàng tương lai mô phỏng hệ thống CAD hiện có để điều tra xem công cụ này tác động như thế nào đến việc ra quyết định lâm sàng của cả bác sĩ X quang và bác sĩ ung thư bức xạ.
Học sâu giúp các bác sĩ X quang phát hiện ung thư phổi trên phim X-quang ngực
“Nhiều chuyên gia về thần kinh học và bác sĩ ung thư bức xạ thần kinh thực hiện SRS sẽ được chụp cộng hưởng từ não. Họ sẽ được yêu cầu tìm bất kỳ tổn thương nào có thể là di căn não, đánh giá mức độ tin cậy của họ và cho biết liệu họ có điều trị tổn thương bằng SRS hay không, dựa trên sự xuất hiện của nó trong hình ảnh,” ông nói. Thế giới vật lý. “Sau đó, chúng tôi sẽ trình bày cho họ các dự đoán về CAD và đánh giá tác động của CAD đối với các quyết định lâm sàng của từng bác sĩ.”
Nếu nghiên cứu mô phỏng này mang lại kết quả đầy hứa hẹn, Godfrey dự đoán sẽ triển khai công cụ CAD để giúp xác định các di căn não đầy thách thức trong tương lai ở những bệnh nhân mới đang được điều trị tại phòng khám Ung thư Bức xạ Duke theo một phác đồ nghiên cứu, có lẽ ngay từ giữa năm 2023.