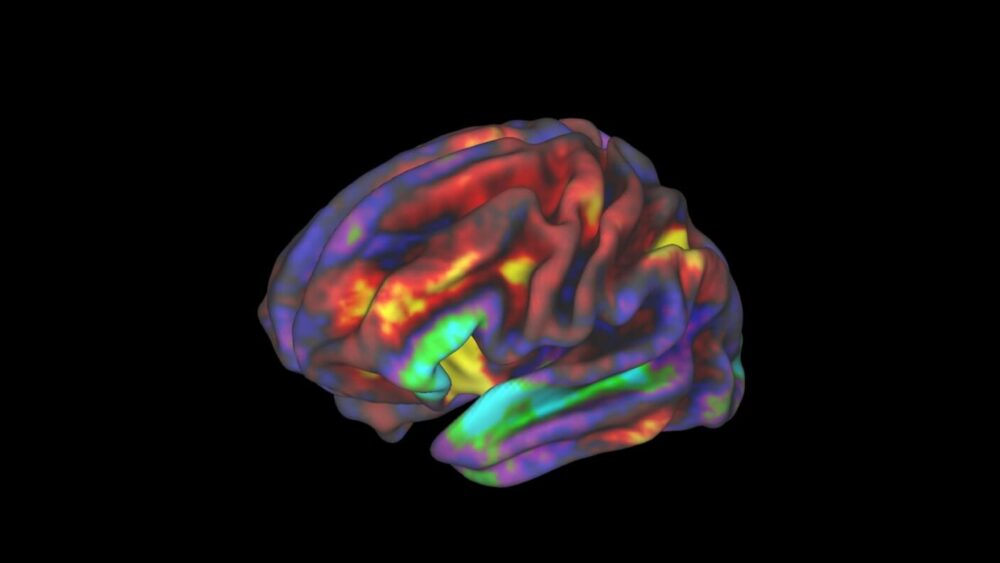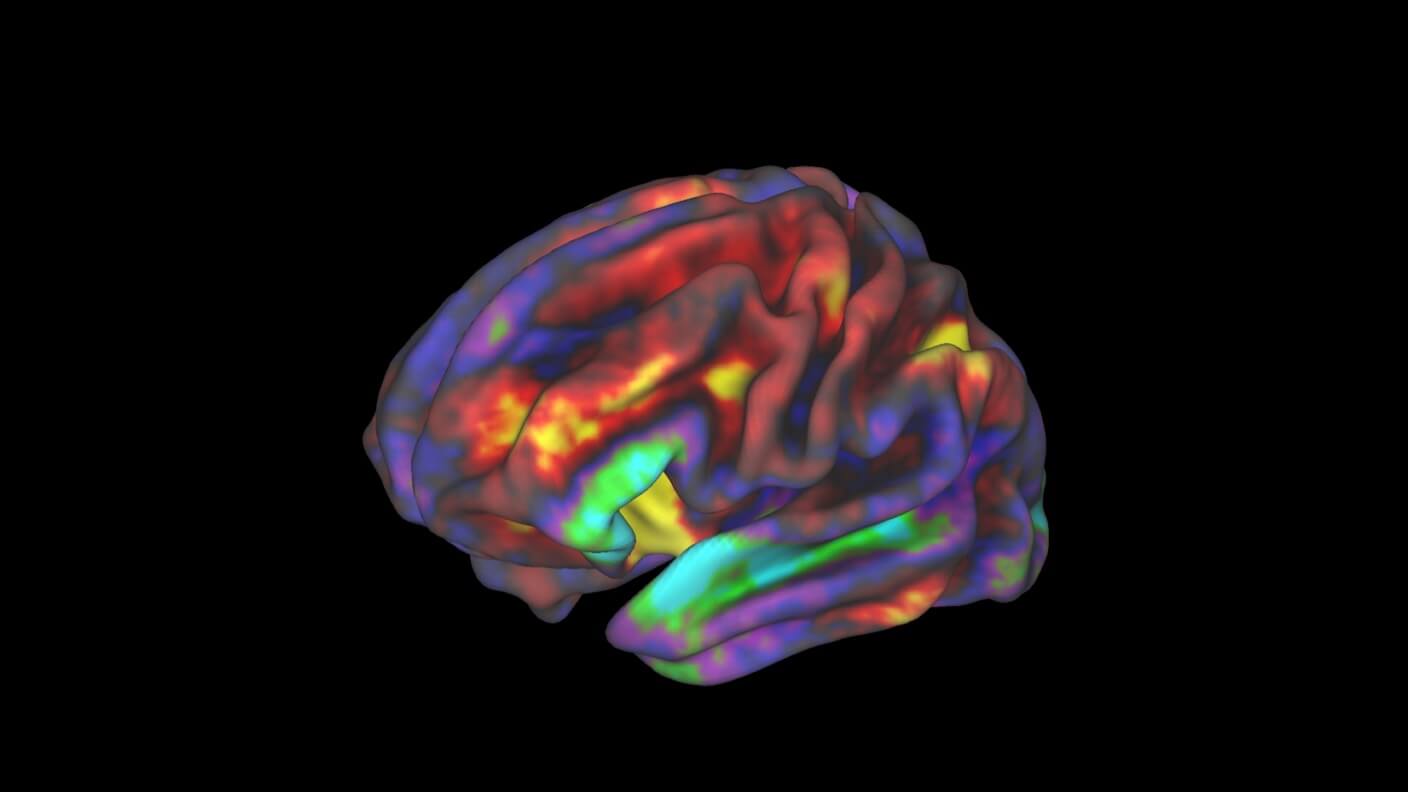
Ved begyndelsen af det 20. århundrede bemærkede Dr. Alois Alzheimer ejendommelige ændringer i en nyudtaget hjerne. Hjernen havde tilhørt en 50-årig kvinde, som gradvist mistede sin hukommelse og kæmpede med søvn, øget aggression og til sidst paranoia.
Under mikroskopet var hendes hjerne fyldt med sammenfiltringer af proteinklumper. Mærkeligt nok havde skinnende fedtbobler også ophobet sig inde i hjerneceller, men de var ikke neuroner – hjernecellerne, der gnister af elektricitet og ligger til grund for vores tanker og minder. I stedet er de fede poser bygget op i støttende hjerneceller kaldet glia.
Forskere har længe troet, at giftige proteinklynger fører til eller forværrer Alzheimers sygdom. Årtiers arbejde med det formål at nedbryde disse klumper er for det meste mislykkedes - og har fået bestræbelsen til kaldenavnet "drømmenes kirkegård". Der har været en sejr for nylig. I begyndelsen af 2023, godkendte den amerikanske fødevare- og lægemiddeladministration et lægemiddel til Alzheimers, der en smule bremsede kognitivt fald ved at hæmme proteinklumper, skønt midt i megen kontrovers over sin sikkerhed.
Et stigende antal eksperter udforsker andre måder at bekæmpe sind-spiseforstyrrelsen på. Stanfords Dr. Tony Wyss-Coray mener, at et svar kan komme fra den originale kilde; Alois Alzheimers første beskrivelser af fedtbobler inde i gliaceller - men med et moderne genetisk twist.
In en ny undersøgelse, holdet målrettede fedtbobler som en potentiel årsag til Alzheimers sygdom. Ved at bruge doneret hjernevæv fra mennesker med lidelsen udpegede de en celletype, der er særligt sårbar over for fedtaflejringer - mikroglia, hjernens vigtigste immunceller.
Ikke alle mennesker med Alzheimers havde alt for fede mikroglia. De, der gjorde det, havde en specifik variant af et gen, kaldet APOE4. Forskere har længe vidst, at APOE4 øger risikoen for Alzheimers, men årsagen hertil er forblevet et mysterium.
Fedtboblerne kan være svaret. Laboratoriefremstillede mikrogliaceller fra mennesker med APOE4 akkumulerede hurtigt bobler og spyede dem ud på naboceller. Når de blev behandlet med væsker, der indeholder boblerne, udviklede raske neuroner klassiske tegn på Alzheimers sygdom.
Resultaterne afslører en ny sammenhæng mellem genetiske risikofaktorer for Alzheimers og fedtbobler i hjernens immunceller. skrev i deres papir.
"Dette åbner en ny vej for terapeutisk udvikling," University of Pennsylvanias Dr. Michal Haney, som ikke var involveret i undersøgelsen, fortalt New Scientist.
Det glemmende gene
To typer proteiner har været kernen i Alzheimers forskning.
Den ene er beta-amyloid. Disse proteiner starter som tjavsede tråde, men efterhånden griber de fat i hinanden og danner store klumper, der samler neuronernes yderside. En anden synder er tau. Normalt uskadelig, danner tau til sidst sammenfiltringer inde i neuroner, der ikke let kan nedbrydes.
Sammen hæmmer proteinerne normale neuronfunktioner. Opløsning eller blokering af disse klumper skulle i teorien genoprette neuronal sundhed, men de fleste behandlinger har vist minimal eller ingen forbedring af hukommelse eller kognition i kliniske forsøg.
I mellemtiden har undersøgelser på hele genomet fundet ud af, at et gen kaldet APOE er en genetisk regulator af sygdommen. Det kommer i flere varianter: APOE2 er beskyttende, hvorimod APOE4 øger sygdomsrisikoen op til 12 gange - og får sit kaldenavn "glemme genet." Undersøgelser er undervejs til genetisk at levere beskyttende varianter, der udsletter de negative konsekvenser af APOE4. Forskere håber, at denne tilgang kan standse hukommelse eller kognitive mangler, før de opstår.
Men hvorfor er nogle APOE-varianter beskyttende, mens andre ikke er det? Fedtbobler kan være skylden.
Cellulær gastronomi
De fleste celler indeholder små bobler af fedt. Kaldt "lipiddråber", de er en væsentlig energikilde. Boblerne interagerer med andre cellulære komponenter for at kontrollere en celles stofskifte.
Hver boble har en kerne af indviklet arrangerede fedtstoffer omgivet af en fleksibel molekylær "klæbefolie". Lipiddråber kan hurtigt vokse eller skrumpe i størrelse for at buffere toksiske niveauer af fedtmolekyler i cellen og dirigere immunreaktioner mod infektioner i hjernen.
APOE er et hovedgen, der regulerer disse lipiddråber. Den nye undersøgelse spurgte, om fedtdepoter er årsagen til, at APOE4 øger risikoen for Alzheimers sygdom.
Holdet kortlagde først alle proteiner i forskellige typer celler i hjernevæv doneret fra mennesker med Alzheimers. Nogle havde den farlige APOE4-variant; andre havde APOE3, hvilket ikke øger sygdomsrisikoen. I alt analyserede holdet omkring 100,000 celler - inklusive neuroner og utallige andre hjernecelletyper, såsom immuncellens mikroglia.
Ved at sammenligne resultaterne fra de to genetiske varianter fandt holdet en markant forskel. Mennesker med APOE4 havde langt højere niveauer af et enzym, der genererer lipiddråber, men kun i mikroglia. Dråberne samlet omkring kernen - som huser vores genetiske materiale - svarende til Alois Alzheimers første beskrivelse af fede aflejringer.
Lipiddråberne øgede også niveauet af farlige proteiner i Alzheimers sygdom, herunder amyloid og tau. I en standard kognitiv test i mus korrelerede flere lipiddråber til dårligere ydeevne. Ligesom mennesker havde mus med APOE4-varianten langt mere fede mikroglia end dem med den "neutrale" APOE3, og immuncellerne havde højere niveauer af inflammation.
Selvom dråberne akkumulerede inde i mikroglia, skadede de også let nærliggende neuroner.
I en test transformerede holdet hudceller fra mennesker med APOE4 til en stamcelle-lignende tilstand. Med en specifik dosis kemikalier skubbede de cellerne til at udvikle sig til neuroner med APOE4-genotypen.
De indsamlede derefter sekreter fra mikroglia med enten høje eller lave niveauer af lipiddråber og behandlede de konstruerede neuroner med væskerne. Sekreter med lave niveauer af fedtbobler skadede ikke cellerne. Men neuroner, der fik doser høje i lipiddråber, ændrede hurtigt tau - et klassisk Alzheimers protein - til dets sygdomsfremkaldende form. Til sidst døde disse neuroner.
Det er ikke første gang, der har været fedtbobler forbundet med Alzheimers sygdom, men vi har nu en klarere forståelse af hvorfor. Lipiddråber akkumuleres i mikroglia med APOE4, der transformerer disse celler til en inflammatorisk tilstand, der skader nærliggende neuroner - potentielt fører til deres død. Undersøgelsen tilføjer til det seneste arbejde, der fremhæver uregelmæssige immunresponser i hjernen som en væsentlig årsag til Alzheimers og andre neurodegenerative sygdomme.
Det er endnu uklart, om sænkning af lipiddråberniveauer kan lindre Alzheimers symptomer hos mennesker med APOE4, men holdet er ivrige efter at prøve.
En vej er genetisk at hæmme enzymet, der danner lipiddråberne i APOE4 mikroglia. En anden mulighed er at bruge lægemidler til at aktivere cellens indbyggede bortskaffelsessystem – dybest set en boble fuld af syre – for at nedbryde fedtboblerne. Det er en velkendt strategi, der tidligere er blevet brugt til at ødelægge giftige proteinklumper, men den kunne omarbejdes for at fjerne lipiddråber.
"Vores resultater tyder på en sammenhæng mellem genetiske risikofaktorer for Alzheimers sygdom med ophobning af mikroglial lipiddråber ... potentielt giver terapeutiske strategier for Alzheimers sygdom," skrev holdet i deres papir.
Som et næste skridt undersøger de, om den beskyttende APOE2-variant kan forhindre ophobning af lipiddråber i mikroglia og måske i sidste ende redde hjernens hukommelse og kognition.
Billede Credit: Richard Watts, PhD, University of Vermont og Fair Neuroimaging Lab, Oregon Health and Science University
- SEO Powered Content & PR Distribution. Bliv forstærket i dag.
- PlatoData.Network Vertical Generative Ai. Styrk dig selv. Adgang her.
- PlatoAiStream. Web3 intelligens. Viden forstærket. Adgang her.
- PlatoESG. Kulstof, CleanTech, Energi, Miljø, Solenergi, Affaldshåndtering. Adgang her.
- PlatoHealth. Bioteknologiske og kliniske forsøgs intelligens. Adgang her.
- Kilde: https://singularityhub.com/2024/03/15/this-gene-increases-the-risk-of-alzheimers-scientists-finally-know-why/
- :har
- :er
- :ikke
- $OP
- 000
- 100
- 2020
- 20.
- a
- Ophobe
- Akkumuleret
- akkumulering
- aktivere
- Tilføjer
- administration
- mod
- Rettet
- Alle
- også
- Skønt
- Alzheimer
- Alzheimers
- Midt
- an
- analyseret
- ,
- En anden
- besvare
- tilgang
- godkendt
- ER
- omkring
- anbragt
- AS
- At
- Avenue
- Battle
- BE
- været
- før
- mellem
- blokering
- Brain
- Hjerneceller
- Pause
- Breaking
- Broken
- boble
- buffer
- bygget
- indbygget
- men
- by
- kaldet
- CAN
- celle
- Celler
- Århundrede
- ændret
- Ændringer
- Classic
- klar
- klarere
- Klinisk
- kliniske forsøg
- kognition
- kognitive
- Kom
- kommer
- komponenter
- Konsekvenser
- indeholder
- kontrol
- Core
- kunne
- skaber
- kredit
- Dangerous
- Død
- årtier
- Afvis
- levere
- indskud
- beskrivelse
- ødelægge
- udvikle
- udviklet
- Udvikling
- DID
- døde
- forskel
- forskellige
- direkte
- Sygdom
- sygdomme
- sygdom
- bortskaffelse
- Er ikke
- doneret
- dosis
- doser
- ned
- dr
- drømme
- driver
- medicin
- Narkotika
- døbt
- hver
- ivrige
- Tidligt
- nemt
- enten
- elektricitet
- bestræbe sig
- energi
- manipuleret
- især
- til sidst
- forværre
- eksperter
- Udforskning
- faktorer
- retfærdig
- langt
- Fedt
- fda
- Endelig
- fund
- Fornavn
- første gang
- fleksibel
- mad
- Til
- formular
- formularer
- fundet
- fra
- fuld
- funktioner
- indsamlede
- genererer
- genetiske
- given
- glia
- gradvist
- forståelse
- Grow
- Dyrkning
- havde
- skade
- skader
- Have
- Helse
- sund
- Hjerte
- hende
- Høj
- højere
- fremhæve
- håber
- huse
- HTTPS
- Mennesker
- if
- immun
- in
- Herunder
- Forøg
- øget
- Stigninger
- infektioner
- indvendig
- i stedet
- interagere
- ind
- involverede
- IT
- ITS
- jpg
- Kend
- kendt
- lab
- stor
- føre
- førende
- niveauer
- ligesom
- LINK
- lidt
- Lang
- tabte
- Lav
- lave niveauer
- Sænkning
- Main
- større
- Kan..
- Memories
- Hukommelse
- Metabolisme
- Mikroskop
- mindste
- Moderne
- molekylær
- mere
- mest
- for det meste
- flere
- utal
- Mystery
- Natur
- negativ
- tilstødende
- Neuroner
- Ny
- næste
- ingen
- normal
- Normalt
- nu
- nummer
- forekomme
- of
- off
- ONE
- kun
- på
- åbner
- Option
- or
- Oregon
- original
- Andet
- Andre
- vores
- ud
- uden for
- i løbet af
- Papir
- ejendommelige
- Mennesker
- ydeevne
- måske
- phd
- plato
- Platon Data Intelligence
- PlatoData
- potentiale
- tidligere
- Beskyttende
- Protein
- Proteiner
- leverer
- hurtigt
- let
- grund
- nylige
- regulerings-
- regulator
- forblevet
- fjernet
- forskning
- forskere
- reaktioner
- genoprette
- Resultater
- Risiko
- risikofaktorer
- groft
- R
- Sikkerhed
- Gem
- Videnskab
- forskere
- bør
- vist
- Skilte
- Størrelse
- hud
- søvn
- nogle
- Kilde
- Spark
- specifikke
- standard
- skarp
- starte
- Tilstand
- Stem
- Trin
- Tråde
- strategier
- Strategi
- undersøgelser
- Studere
- sådan
- tyder
- Støtte
- omgivet
- Symptomer
- målrettet
- hold
- prøve
- end
- at
- deres
- Them
- derefter
- teori
- Der.
- Disse
- de
- tænker
- denne
- dem
- tænkte
- toften
- tid
- til
- Tony
- omdannet
- omdanne
- behandlet
- behandlinger
- forsøg
- prøv
- TUR
- Twist
- to
- typen
- typer
- afdække
- Underliggende
- forståelse
- universitet
- us
- amerikansk mad
- brug
- anvendte
- ved brug af
- Variant
- Vermont
- Sårbar
- var
- watt
- måder
- we
- Kendt
- hvornår
- ud fra følgende betragtninger
- hvorvidt
- som
- mens
- WHO
- hvorfor
- vinde
- tørre
- med
- kvinde
- Arbejde
- værre
- wrap
- skrev
- endnu
- zephyrnet