Rhodopsin, proteinet, der gør det muligt for mennesker og andre hvirveldyr at sanse lys, tilhører familien af lysfølsomme G-proteinkoblede receptorer (GPCR'er). Det kommer først i signaltransduktionsvejen, for at synet kan begynde. Når først den absorberer en foton, sker der en øjeblikkelig (inden for 200 fs) konformationsændring i nethinden, en kromofor placeret inde i rhodopsin. Denne tidlige strukturelle ændring initierer de cellulære signaltransduktionsprocesser, der sætter tidlige stadier af synet. Imidlertid forbliver detaljer om de intramolekylære hændelser i realtid, hvorigennem den fotoaktiverede nethinde inducerer aktiveringsbegivenhederne inde i rhodopsin, uklare.
For at udfylde dette videnshul har forskere ved Paul Scherrer Instituttet (PSI) i Schweiz brugte ultrahurtig tidsopløst krystallografi til at studere konformationelle ændringer i rhodopsin, efter at det absorberer en foton. Deres resultater, rapporteret i Natur, forklare, hvordan retinal kun absorberer en del af fotonenergien, og lagrer den resterende energi for at give næring til de konformationelle ændringer, der er forbundet med dannelsen af den G-proteinbindende signaltilstand.
For at registrere og analysere aktiveringsmekanismen for nethindekromophoren på atomskalaen og med ultrahurtig (picosecond) tidsmæssig opløsning, brugte holdet tidsopløst seriel femtosekundkrystallografi (TR-SFX) ved stuetemperatur.
Til deres eksperimenter dyrkede forskerne først rhodopsin-mikrokrystaller af høj kvalitet og brugte derefter TR-SFX til at generere serier af diffraktionsmønsterbilleder af krystallerne. Mere præcist brugte de en optisk laserpuls til at fotoaktivere proteinmolekylerne i krystallen og derefter – efter en bestemt tidsforsinkelse – sonderede de strukturen med en røntgenimpuls fra en røntgenfri elektronlaser (XFEL). Ved at optage med XFEL, som faktisk er et meget højhastighedskamera, indsamlede forskerne serielle rammer fra titusindvis af krystaller orienteret på tilfældig vis.

Analyserne udført af holdet inkluderede modellering af rhodopsinstrukturen for elektrondensitetsændringer sammen med strukturel raffinement mod krystallografiske observationer. Dette afslørede, at lys-induceret isomerisering (hvor et molekyle skifter mellem to distinkte konformationer) med en bøjning i den retinale kromofor fortsætter i 1 ps, givet at det første metastabile mellemprodukt af rhodopsin vises 200 fs efter fotoaktivering. Så 100 ps senere antager rhodopsin-strukturen en mere afslappet konformation. Derved tyder resultaterne på, at proteinet anvender aktive (eller funktionelle) zoner i GPCR-strukturvejene til energiafledning.

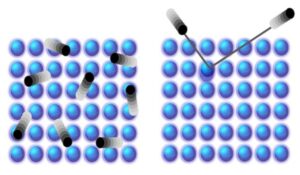
Forbindelse af prikkerne for kunstigt at genoprette synet
Et højdepunkt i denne nye undersøgelse er, at stuetemperaturstrukturen afslører elektrontæthed for alle tidligere beskrevne funktionelle og strukturelle vandmolekyler, inklusive dem, der spiller en rolle senere i fotoaktiveringsprocessen. Forskerne bemærker, at tidligere strukturer, der blev løst under kryogene forhold, ikke opnåede dette. Følgelig viser den nye højopløselige SFX-struktur af rhodopsin hele det vandmedierede hydrogenbindingsnetværk i proteinet.
Undersøgelsen kaster lys over de tidligste stadier af synet og afslører, at ultrahurtig energispredning i rhodopsin sker gennem konserverede rester af GPCR-aktiveringsveje, hvilket baner vejen for at studere de tidlige aktiveringshændelser i denne største familie af GPCR'er (klasse A).
- SEO Powered Content & PR Distribution. Bliv forstærket i dag.
- PlatoAiStream. Web3 Data Intelligence. Viden forstærket. Adgang her.
- Udmøntning af fremtiden med Adryenn Ashley. Adgang her.
- Køb og sælg aktier i PRE-IPO-virksomheder med PREIPO®. Adgang her.
- Kilde: https://physicsworld.com/a/ultrafast-imaging-sheds-light-on-the-earliest-stages-of-vision/
- :er
- 1
- 100
- 200
- a
- over
- opnå
- Aktivering
- aktiv
- Efter
- mod
- Alle
- an
- analysere
- Analyser
- ,
- kommer til syne
- ER
- forbundet
- At
- begynde
- tilhører
- mellem
- biologi
- obligation
- by
- værelse
- lave om
- Ændringer
- kemi
- klasse
- klik
- kolleger
- kommer
- betingelser
- følgelig
- Krystal
- forsinkelse
- beskrevet
- detaljer
- Diego
- distinkt
- Afdeling
- Tidligt
- effektivt
- muliggør
- energi
- helhed
- begivenheder
- eksperimenter
- Forklar
- mislykkedes
- familie
- udfylde
- fund
- Fornavn
- Til
- formation
- Gratis
- fra
- FS
- Brændstof
- funktionel
- kløft
- generere
- given
- Have
- hoved
- høj kvalitet
- høj opløsning
- Fremhæv
- Hvordan
- Men
- HTTPS
- Mennesker
- Hydrogenering
- billede
- billeder
- Imaging
- umiddelbar
- in
- medtaget
- Herunder
- oplysninger
- Indleder
- undersøgelse
- spørgsmål
- IT
- ITS
- jpg
- viden
- største
- laser
- senere
- lys
- placeret
- måde
- max-bredde
- mekanisme
- metastabil
- modellering
- molekyle
- mere
- Natur
- netværk
- Ny
- of
- on
- engang
- kun
- åbent
- or
- Andet
- del
- Mønster
- Bane
- vedvarer
- fotografering
- Fysik
- Fysik verden
- plato
- Platon Data Intelligence
- PlatoData
- præcist
- tidligere
- tidligere
- behandle
- Processer
- Protein
- puls
- tilfældig
- realtid
- optage
- optagelse
- forblive
- resterende
- rapporteret
- forskning
- forsker
- forskere
- Løsning
- løst
- genoprette
- Resultater
- Revealed
- afslørende
- afslører
- roller
- Værelse
- s
- Scale
- forstand
- seriel
- Series
- sæt
- Shape
- skure
- vist
- Signal
- specificeret
- etaper
- Tilstand
- lagring
- strukturel
- struktur
- Studere
- tyder
- Schweiz
- hold
- tiere
- at
- deres
- derefter
- derved
- de
- denne
- dem
- tusinder
- Gennem
- thumbnail
- tid
- til
- sammen
- sand
- to
- under
- anvendte
- udnytter
- meget
- vision
- Vand
- Vej..
- som
- med
- inden for
- world
- røntgen
- zephyrnet
- zoner