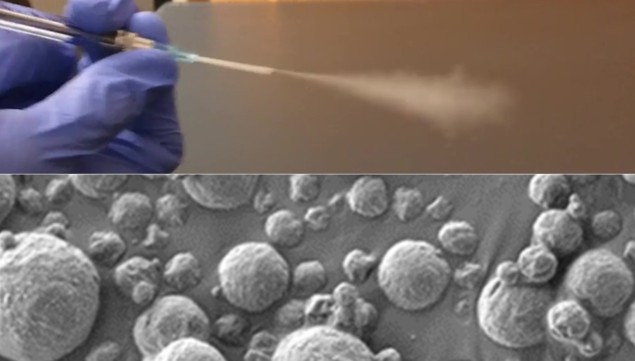
Niedrigdosis-CT, die Goldstandardtechnik zur Diagnose von Lungenkrebs in Risikogruppen, hat in klinischen Studien die Zahl der Lungenkrebstodesfälle um 20–25 % gesenkt. Der Zugang zu dieser Screening-Technologie kann jedoch in ressourcenarmen Umgebungen eingeschränkt sein, was in solchen Regionen zu einer unverhältnismäßig hohen Lungenkrebsmortalität führt. Forscher am Massachusetts Institute of Technology (MIT) hoffen, diese Ungleichheit bei der Früherkennung von Lungenkrebs durch die Entwicklung eines einfachen Tests zu beseitigen, der auf der Inhalation von Nanopartikelsensoren basiert.
Der neue Screening-Test, beschrieben in Wissenschaft Fortschritteist eine nadelfreie Diagnoseplattform namens PATROL, die drei Module integriert: aktivitätsbasierte Nanosensoren (ABNs); eine tragbare Inhalationseinheit; und ein multiplexbarer papierbasierter Lateral-Flow-Assay (LFA).
Die ABNs werden aus Polymernanopartikeln hergestellt, die über Peptidsubstrate mit Reportern wie synthetischen DNA-Barcodes gekoppelt sind. Um einen minimalen Satz von Sonden mit hoher Vorhersagekraft zu identifizieren, untersuchten die Forscher eine Bibliothek von Kandidatenpeptiden, die bei Kontakt mit krebsassoziierten Proteasen gespalten werden. Sie wählten 20 Peptide als potenzielle Nanosensoren aus und führten Tests an Mäusen durch, um eine Kombination von vier ABNs zu identifizieren, die wahrscheinlich genaue diagnostische Ergebnisse liefert.
Um sich einem Screening-Test zu unterziehen, inhaliert der Patient die ABNs, die zu mikrometergroßen Aerosolen formuliert werden, um die Ablagerung in der Lunge zu optimieren. Wenn diese Nanosensoren auf Krebsbiomarker treffen, wie zum Beispiel Lungenkrebs-assoziierte Proteasen, werden die DNA-Barcodes vom Partikel abgespalten und in den Blutkreislauf abgegeben, wo sie sich schließlich im Urin anreichern. Diese Reporter können dann mit einem LFA-basierten Urintest nachgewiesen werden.
Um Urinproben schnell zu analysieren, ohne dass komplexe Laborgeräte erforderlich sind, entwickelte das Team LFAs, die die vier verschiedenen DNA-Barcodes auf einem einzigen Papierstreifen bei Raumtemperatur quantifizieren können. Und da die Nanosensoren mit einem Vernebler oder Handinhalator verabreicht werden, können Patienten den PATROL-Test zu Hause selbst durchführen.
„Wir haben wirklich darauf gedrängt, dass dieser Assay in einer ressourcenarmen Umgebung am Point-of-Care verfügbar ist. Die Idee war also, keine Probenverarbeitung und keine Amplifikation durchzuführen, nur um die Probe direkt auf das Papier bringen zu können und es in 20 Minuten vorlesen“, sagt der leitende Autor Sangeeta Bhatia In einer Pressekonferenz.
Die Forscher stellen fest, dass PATROL in Ländern mit niedrigem und mittlerem Einkommen, in denen CT-Scanner nicht weit verbreitet sind, besonders große Auswirkungen haben könnte. „Unser Ziel war es, eine Methode bereitzustellen, die Krebs mit hoher Spezifität und Sensitivität erkennen kann und gleichzeitig die Schwelle für die Zugänglichkeit senkt, sodass wir hoffentlich die Ressourcenungleichheit und Ungleichheit bei der Früherkennung von Lungenkrebs verbessern können“, fügt Co-Hauptautor hinzu Qian Zhong.
In vivo Bewertung
Die Forscher testeten, ob die Nanosensoren Lungenkrebs bei Mäusen erkennen können, indem sie Tiere 7.5 Wochen nach Beginn der Tumorbildung untersuchten (was wahrscheinlich mit Krebs im Stadium 1 oder 2 beim Menschen korreliert). Sie weisen darauf hin, dass Trockenpulverinhalatoren beim Menschen zwar eine bessere Deposition in der tiefen Lunge ermöglichen, dass sie jedoch durch den Atem ausgelöst werden und für Nagetiere ungeeignet sind. Stattdessen setzten sie die Mäuse in einen Inhalationsturm und setzten sie vernebelten Nanosensoren aus.
Zwei Stunden nach der ABN-Inhalation sammelten die Forscher Urinproben von den Tieren und quantifizierten die Reporter mittels Massenspektrometrie. Sie fanden heraus, dass Substrate, die der Mikroumgebung des Tumors ausgesetzt waren, die DNA-Barcodes in die Zirkulation abgeben und dass sich die Urinsignale aller vier Reporter zwischen tumortragenden und gesunden Mäusen unterschieden. Der Einsatz unbeaufsichtigter algorithmischer Methoden ermöglichte die Unterscheidung aller tumortragenden Mäuse von gesunden Artgenossen.
Sie kamen zu dem Schluss, dass die inhalierbaren ABNs „eine robuste Leistung für die Früherkennung von autochthonen Lungenadenokarzinomen bei Mäusen zeigen“.
Einatmen und erkennen
Abschließend testeten die Forscher die Leistung der gesamten PATROL-Plattform „Inhalieren und Erkennen“. Sie synthetisierten DNA-kodierte ABNs mit einem Durchmesser von etwa 15 nm und verwendeten das gleiche Lungenkrebs-Mausmodell und die gleiche Verneblerabgabe, um die Erkennung von DNA-Reportern im Urin mithilfe des LFA zu validieren.
Der Vergleich der Urinkonzentration jedes Barcodes ergab signifikante Unterschiede in der Spaltung von drei der gemeldeten Sonden (jedoch nicht der vierten) zwischen gesunden und krebskranken Mäusen. Mit LFA erfasste Urinwerte zeigten ähnliche Signal-Rausch-Verhältnisse wie die massenspektroskopischen Messungen. Auch hier konnten unbeaufsichtigte Clustering-Algorithmen alle Mäuse mit Lungenkrebs im Frühstadium klassifizieren.
Die Analyse der Receiver Operating Characteristic (ROC) zeigte, dass drei der Sonden als kompetente Einzelklassifikatoren fungierten, mit Werten für die Fläche unter der ROC-Kurve (AUC) von 0.82, 0.88 und 0.85. Durch die Kombination der vier Sonden erhöhte sich die AUC auf 0.93. Mit einer Spezifität von 100 % erkannte das LFA DNA-Reporter mit einer Sensitivität von 75.2 %, vergleichbar mit der Sensitivität der Mikro-CT.
Das Lungenkrebs-Screening erhöht das Langzeitüberleben dramatisch
Das Team untersuchte auch das Sicherheitsprofil der inhalierbaren ABNs und stellte sieben Tage nach der Verabreichung einer Einzeldosis ABNs durch Vernebelung keine allgemeine Toxizität oder Verstopfung des Gefäßsystems bei Mäusen fest.
„Insgesamt birgt PATROL ein großes klinisches Potenzial, nicht nur eine empfindliche und spezifische Lungenkrebserkennung in frühen Stadien zu erreichen, sondern auch einen einfachen Einsatz in ressourcenbeschränkten Umgebungen zu ermöglichen“, schließen die Forscher. Als nächstes planen sie, menschliche Biopsieproben zu analysieren, um zu sehen, ob die Sensorpanels auch Krebserkrankungen beim Menschen erkennen können, und hoffentlich gefolgt von klinischen Studien an menschlichen Patienten.
- SEO-gestützte Content- und PR-Distribution. Holen Sie sich noch heute Verstärkung.
- PlatoData.Network Vertikale generative KI. Motiviere dich selbst. Hier zugreifen.
- PlatoAiStream. Web3-Intelligenz. Wissen verstärkt. Hier zugreifen.
- PlatoESG. Kohlenstoff, CleanTech, Energie, Umwelt, Solar, Abfallwirtschaft. Hier zugreifen.
- PlatoHealth. Informationen zu Biotechnologie und klinischen Studien. Hier zugreifen.
- Quelle: https://physicsworld.com/a/inhalable-nanosensors-could-increase-access-to-lung-cancer-screening/
- :hast
- :Ist
- :nicht
- :Wo
- 1
- 15%
- 2%
- 20
- 361
- 7
- 75
- a
- Fähig
- abn
- Zugang
- Zugänglichkeit
- genau
- Adresse
- Fügt
- Nach der
- aufs Neue
- algorithmisch
- Algorithmen
- Alle
- ebenfalls
- Verstärkung
- an
- analysieren
- Analyse
- und
- Tiere
- jedem
- ca.
- SIND
- Bereich
- AS
- At
- erreichen
- keiner
- Autor
- Verfügbarkeit
- verfügbar
- basierend
- BE
- zwischen
- beide
- aber
- by
- namens
- CAN
- Krebs
- Kandidat
- Merkmal
- Die Durchblutung
- klassifizieren
- Klinische
- klinische Versuche
- Clustering
- Kombination
- Vereinigung
- vergleichbar
- kompetent
- Komplex
- konzentrieren
- Konzentration
- Schluss
- geschlossen
- korreliert
- könnte
- Kollegen
- Ländern
- gekoppelt
- Kurve
- Tage
- Todesfälle
- geliefert
- liefern
- Lieferanten
- Einsatz
- beschrieben
- entdecken
- erkannt
- Entdeckung
- entwickelt
- Entwicklung
- Diagnose
- Diagnose
- Unterschiede
- anders
- Differenzierung
- Frau
- do
- Nicht
- empfohlen
- Dramatisch
- trocknen
- jeder
- Früh
- Startup-Gründer
- Einfache
- ermöglichen
- freigegeben
- Begegnung
- Ganz
- Ausrüstung
- schließlich
- Untersuchen
- ausgesetzt
- Belichtung
- Fluss
- gefolgt
- Aussichten für
- unten stehende Formular
- gefunden
- vier
- Vierte
- für
- Allgemeines
- ABSICHT
- Kundenziele
- Gold
- Gold Standard
- groß
- Gruppen
- Haben
- gesund
- GUTE
- hält
- Startseite
- ein Geschenk
- Hoffentlich
- STUNDEN
- aber
- HTTPS
- human
- Humans
- Idee
- identifizieren
- if
- Impact der HXNUMXO Observatorien
- zu unterstützen,
- in
- beinhaltet
- Erhöhung
- hat
- Steigert
- Information
- beantragen müssen
- Institut
- Integriert
- interagieren
- in
- Problem
- IT
- jpg
- nur
- Labor
- führenden
- Bibliothek
- wahrscheinlich
- Limitiert
- langfristig
- kostengünstig
- senken
- gemacht
- Masse
- Massachusetts
- Massachusetts Institute of Technology
- max-width
- Messungen
- Methode
- Methoden
- minimal
- Minuten
- MIT
- Modell
- Module
- Need
- Neu
- weiter
- nicht
- beachten
- of
- bieten
- on
- einzige
- die
- Optimieren
- or
- Tafel
- Platten
- Papier
- auf Papierbasis
- besonders
- Vertrauen bei Patienten
- Patienten
- Patrouille
- Leistung
- durchgeführt
- Physik
- Physik-Welt
- Plan
- Plattform
- Plato
- Datenintelligenz von Plato
- PlatoData
- tragbar
- Potenzial
- Werkzeuge
- Presse
- Verarbeitung
- Profil
- Proteine
- die
- Schieben
- setzen
- quantifiziert
- schnell
- Verhältnisse
- Lesen Sie mehr
- wirklich
- Reduziert
- Regionen
- freigegeben
- Berichtet
- Reporter
- Forscher
- Ressourcen
- Die Ergebnisse
- Revealed
- Recht
- robust
- Zimmer
- Sicherheit
- gleich
- Sample
- sah
- sagt
- Scan
- Scannen
- Wissenschaft
- regelmäßigen Abständen
- sehen
- ausgewählt
- Senior
- empfindlich
- Sensitivität
- Sensor
- Sensoren
- kompensieren
- Einstellung
- Einstellungen
- sieben
- beleuchtete
- zeigte
- Konzerte
- Signale
- signifikant
- ähnlich
- Einfacher
- Single
- So
- spezifisch
- Spezifität
- Spektroskopie
- Stufe
- Stufen
- Standard
- begonnen
- Erklärung
- so
- Oberteil
- synthetisch
- Team
- Technik
- Technologie
- Test
- getestet
- Tests
- zur Verbesserung der Gesundheitsgerechtigkeit
- Das
- Sie
- dann
- Diese
- vom Nutzer definierten
- fehlen uns die Worte.
- nach drei
- Schwelle
- Daumennagel
- zu
- Tower
- Studien
- was immer dies auch sein sollte.
- für
- unterziehen
- unterziehen
- Einheit
- auf
- -
- benutzt
- verwendet
- Verwendung von
- BESTÄTIGEN
- Werte
- wurde
- we
- Wochen
- waren
- ob
- welche
- während
- weit verbreitet
- mit
- ohne
- weltweit wie ausgehandelt und gekauft ausgeführt wird.
- Zephyrnet












