Die Strahlentherapie ist eine der häufigsten Krebsbehandlungen, die die Überlebenszeiten effektiv verlängert und die Heilungsraten für Krebspatienten erhöht. Strahlentherapie-induzierte Knochenschäden – einschließlich verringerter Knochenmasse, erhöhter Knochenbrüchigkeit und einem höheren Risiko für Frakturen und Osteonekrose – bleiben jedoch ein häufiges Problem, für das es derzeit keine wirksamen Gegenmaßnahmen gibt.
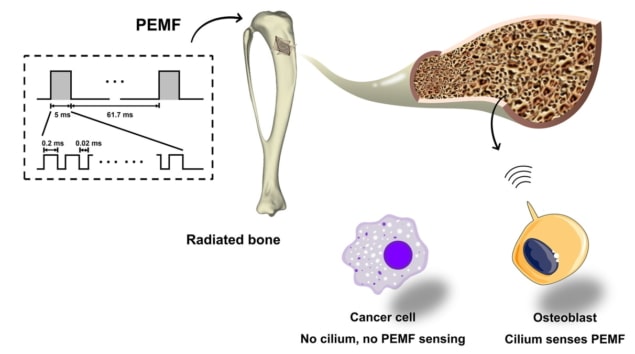
Strahlung verursacht diesen Schaden, indem sie das Wachstum, Überleben und die Reifung von knochenbildenden Zellen, den sogenannten Osteoblasten, unterdrückt und so die Knochenbildung hemmt. Ein potenzielles Heilmittel könnte die Exposition gegenüber nicht-invasiven elektromagnetischen Feldern (EMFs) sein, von denen bekannt ist, dass sie das Wachstum und die Differenzierung von Osteoblasten stimulieren und die Auswirkungen der Bestrahlung abschwächen könnten. Jetzt hat ein Forschungsteam in China die optimale EMF-Wellenform identifiziert, um die Wirksamkeit einer solchen Behandlung zu maximieren, und die Ergebnisse in veröffentlicht Wissenschaft Fortschritte.
DaJing, von Vierte Militärmedizinische Universität, und Kollegen unterzogen Knochenzellen zunächst einer EMF-Stimulation mit verschiedenen Wellenformen, darunter sinusförmige EMF, Einzelpuls-EMF und Pulsed-Burst-EMF (PEMF). Um die Reaktion der Zellen zu beurteilen, überwachten sie in Echtzeit intrazelluläre Calciumionen (Ca2+)-Signalisierung, eine der frühesten zellulären Reaktionen auf äußere Reize.
Das Team fand heraus, dass PEMF robusteres intrazelluläres Ca induzierte2+ Signalisierung in bestrahlten Osteoblasten als die anderen Wellenformen, gekennzeichnet durch einzigartiges Ca2+ Oszillationen mit mehreren Ca2+ Spikes. Weitere Analysen zeigten, dass eine zuvor nicht identifizierte PEMF-Wellenform mit einer Magnetfeldstärke von 2 mT und einer Frequenz von 15 Hz die stärkste Reaktion bei Osteoblasten hervorrief. Im Gegensatz dazu hatte diese PEMF-Wellenform keine Wirkung auf andere Arten von bestrahlten Knochenzellen (Osteoklasten und Osteozyten).
Als nächstes untersuchten die Forscher, ob PEMF, das unter Verwendung dieser optimalen Parameter verabreicht wurde, den strahleninduzierten Knochenverlust mildern könnte in vivo. In Studien an Ratten setzten sie ein Hinterbein zwei 8-Gy-Dosen einer fokalen Bestrahlung aus (im Abstand von einem Tag) und verwendeten Mikro-CT, um die Knochenstruktur 45 Tage später zu beurteilen. Die bestrahlten Gliedmaßen zeigten einen signifikanten trabekulären Knochenverlust, einschließlich einer etwa 50 %igen Abnahme des Knochenvolumenanteils und der Knochenmineraldichte im Vergleich zur nicht bestrahlten Seite.
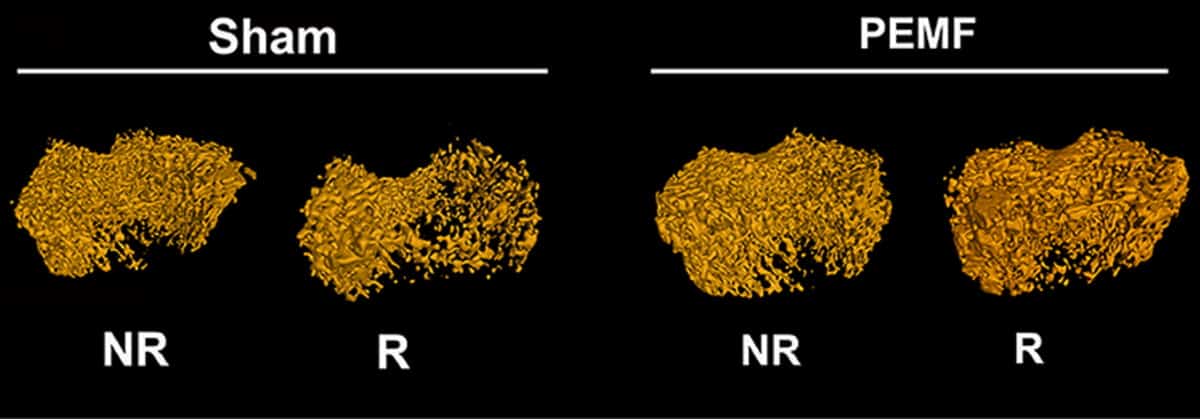
Eine zweite Gruppe von Ratten erhielt während der 2 Tage nach der Bestrahlung täglich Ganzkörper-PEMF (45 h/Tag). Diese Behandlung stellte die Knochenmasse und die mechanischen Eigenschaften in bestrahlten Hinterbeinen auf das Niveau von nicht bestrahlten Gliedmaßen wieder her, indem Osteoblasten gerettet wurden. Das Team stellte fest, dass PEMF keinen Einfluss auf das Körpergewicht oder die Nahrungsaufnahme der Tiere hatte.
Nachdem gezeigt wurde, dass eine PEMF-Exposition den strahleninduzierten Knochenschwund mildern kann, ist es auch wichtig, dass das PEMF die Tumorbehandlung nicht nachteilig beeinflusst. Vor diesem Hintergrund verglichen die Forscher die Empfindlichkeit von Osteoblasten und verschiedenen Tumorzellen (Brustkrebs-, Dickdarmkrebs-, bösartige Melanom- und Osteosarkomzellen) gegenüber PEMF.
Die Bestrahlung verringerte die Lebensfähigkeit der Zellen und förderte die Apoptose in allen Zelltypen. Entscheidend ist, dass PEMF, obwohl es die Lebensfähigkeit der Osteoblasten verbesserte und die Apoptose der Osteoblasten hemmte, zu keinem Zeitpunkt eine Auswirkung auf die Lebensfähigkeit oder Apoptose in irgendeiner der Tumorzellen hatte.
Lebende Bioink könnte die Knochenreparatur und -regeneration verbessern
Die Forscher führen diese Selektivität auf das Vorhandensein von primären Zilien zurück – Sinnesorganellen, die extrazelluläre mechanische Signale erkennen und übersetzen – die als PEMF-Sensoren fungieren. Diese primären Zilien sind in Osteoblasten reichlich vorhanden, fehlen jedoch in den meisten Tumorzellen. In einem Experiment, in dem die Bildung von primären Zilien in bestrahlten Osteoblasten blockiert wurde, verschwand die PEMF-vermittelte Steigerung des Überlebens und der Differenzierung von Osteoblasten fast vollständig.
„Angesichts der Tatsache, dass Osteoblasten unter allen Knochenzelltypen besonders strahlenempfindlich sind, scheint dieses PEMF-Regime, das die spezifische Aktivierung von Osteoblasten induziert, ein vielversprechender und hocheffizienter Ansatz gegen strahleninduzierte Knochenschäden zu sein“, schlussfolgern die Forscher.