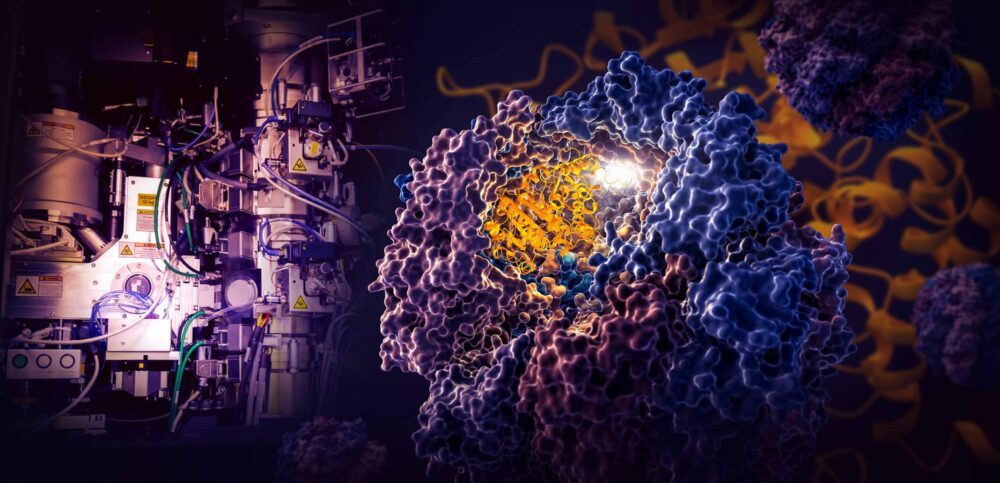
Μια μελέτη ορόσημο από ερευνητές στο Εθνικό Εργαστήριο Επιταχυντή SLAC του Τμήματος Ενέργειας και στο Πανεπιστήμιο του Στάνφορντ αποκαλύπτει πώς μια μικροσκοπική κυτταρική μηχανή που ονομάζεται TRiC κατευθύνει την αναδίπλωση της τουμπουλίνης, μιας ανθρώπινης πρωτεΐνης που είναι το δομικό στοιχείο των μικροσωληνίσκων που χρησιμεύουν ως ικριώματα και σύστημα μεταφοράς του κυττάρου. .
Μέχρι τώρα, οι επιστήμονες πίστευαν ότι το TRiC και παρόμοια μηχανήματα, γνωστά ως chaperonins, παρέχουν παθητικά ένα περιβάλλον που ευνοεί την αναδίπλωση, αλλά δεν συμμετέχουν άμεσα σε αυτό.
Έως και το 10% των πρωτεϊνών στα κύτταρά μας, καθώς και εκείνων στα φυτά και τα ζώα, λαμβάνουν έμπρακτη βοήθεια από αυτούς τους μικρούς θαλάμους για να αναδιπλωθούν στο τελικό, ενεργό σχήμα τους, υπολόγισαν οι ερευνητές.
Πολλές από τις πρωτεΐνες που αναδιπλώνονται με τη βοήθεια του TRiC συνδέονται στενά με ανθρώπινες ασθένειες, συμπεριλαμβανομένων ορισμένων καρκίνων και νευροεκφυλιστικών διαταραχών όπως το Πάρκινσον, το Χάντινγκτον και οι ασθένειες του Αλτσχάιμερ, δήλωσε η καθηγήτρια του Στάνφορντ Τζούντιθ Φράιντμαν, μια από τις επικεφαλής συγγραφείς της μελέτης.
Στην πραγματικότητα, είπε, πολλά αντικαρκινικά φάρμακα έχουν σχεδιαστεί για να διαταράσσουν την τουμπουλίνη και τους μικροσωληνίσκους που σχηματίζει, οι οποίοι είναι πραγματικά σημαντικοί για την κυτταρική διαίρεση. Έτσι, η στόχευση της διαδικασίας αναδίπλωσης τουμπουλίνης με τη βοήθεια TRiC θα μπορούσε να προσφέρει μια ελκυστική αντικαρκινική στρατηγική.
Η ομάδα ανέφερε τα αποτελέσματα της δεκαετούς μελέτης της σε μια εργασία που δημοσιεύτηκε στο Κύτταρο σήμερα.
«Αυτή είναι η πιο συναρπαστική δομή πρωτεΐνης που έχω δουλέψει στην 40χρονη καριέρα μου». είπε ο καθηγητής SLAC/Stanford Wah Chiu, πρωτοπόρος στην ανάπτυξη και χρήση κρυογονικής ηλεκτρονικής μικροσκοπίας (cryo-EM) και διευθυντής του τμήματος cryo-EM και βιοαπεικονίσεων της SLAC.
«Όταν γνώρισα την Τζούντιθ πριν από 20 χρόνια», αυτός είπε, «Μιλήσαμε για το αν μπορούσαμε να δούμε τις πρωτεΐνες να διπλώνουν. Αυτό είναι κάτι που οι άνθρωποι προσπαθούσαν να κάνουν εδώ και χρόνια και τώρα το κάναμε».
Οι ερευνητές κατέγραψαν τέσσερα διαφορετικά βήματα στη διαδικασία αναδίπλωσης κατευθυνόμενη από το TRiC σε σχεδόν ατομική ανάλυση με κρυο-ΕΜ και επιβεβαίωσαν αυτό που είδαν με βιοχημικές και βιοφυσικές αναλύσεις.
Στο πιο βασικό επίπεδο, είπε ο Frydman, αυτή η μελέτη λύνει το μακροχρόνιο αίνιγμα του γιατί η τουμπουλίνη δεν μπορεί να διπλωθεί χωρίς τη βοήθεια του TRiC: «Πραγματικά αλλάζει το παιχνίδι για να φέρουμε επιτέλους έναν νέο τρόπο για να κατανοήσουμε πώς οι πρωτεΐνες αναδιπλώνονται στο ανθρώπινο κύτταρο».
Διπλώνοντας τα μακαρόνια σε λουλούδια
Οι πρωτεΐνες παίζουν ουσιαστικούς ρόλους σχεδόν σε ό,τι κάνει ένα κύτταρο και το να ανακαλύψουμε πώς αναδιπλώνονται στην τελική τους τρισδιάστατη κατάσταση είναι μια από τις πιο σημαντικές αναζητήσεις στη χημεία και βιολογία.
Όπως το θέτει ο Chiu, «Μια πρωτεΐνη ξεκινάει ως μια σειρά αμινοξέων που μοιάζει με σπαγγέτι, αλλά δεν μπορεί να λειτουργήσει μέχρι να διπλωθεί σε ένα λουλούδι με το σωστό σχήμα».
Από τα μέσα της δεκαετίας του 1950, η εικόνα μας για το πώς αναδιπλώνονται οι πρωτεΐνες έχει διαμορφωθεί από πειράματα που έγιναν με τη χρήση μικρών πρωτεϊνών από τον ερευνητή του Εθνικού Ινστιτούτου Υγείας, Christian Anfinsen. Ανακάλυψε ότι αν ξεδίπλωνε μια μικρή πρωτεΐνη, θα επανέλθει αυθόρμητα στο ίδιο σχήμα και κατέληξε στο συμπέρασμα ότι οι οδηγίες για να το κάνει αυτό κωδικοποιήθηκαν στην αλληλουχία αμινοξέων της πρωτεΐνης. Ο Anfinsen μοιράστηκε το Νόμπελ του 1972 χημεία για αυτή την ανακάλυψη.
Τριάντα χρόνια αργότερα, οι ερευνητές ανακάλυψαν ότι οι εξειδικευμένες κυτταρικές μηχανές βοηθούν τις πρωτεΐνες να διπλώνουν. Αλλά η επικρατούσα άποψη ήταν ότι η λειτουργία τους περιοριζόταν στο να βοηθήσουν τις πρωτεΐνες να πραγματοποιήσουν την αυθόρμητη αναδίπλωση τους προστατεύοντάς τες από το να παγιδευτούν ή να κολλήσουν μαζί.
Ένας τύπος βοηθητικής μηχανής, που ονομάζεται chaperonin, περιέχει έναν θάλαμο σαν βαρέλι που συγκρατεί τις πρωτεΐνες στο εσωτερικό τους ενώ διπλώνουν. Το TRiC εντάσσεται σε αυτή την κατηγορία.
Ο θάλαμος TRiC είναι μοναδικός στο ότι αποτελείται από οκτώ διαφορετικές υπομονάδες που σχηματίζουν δύο στοιβαγμένους δακτυλίους. Ένας μακρύς, λεπτός κλώνος πρωτεΐνης τουμπουλίνης διοχετεύεται στο άνοιγμα του θαλάμου από ένα βοηθητικό μόριο που έχει σχήμα μέδουσας. Στη συνέχεια το καπάκι του θαλάμου κλείνει και αρχίζει το δίπλωμα. Όταν τελειώσει, ανοίγει το καπάκι και φεύγει η τελειωμένη, διπλωμένη τουμπουλίνη.
Δεδομένου ότι η τουμπουλίνη δεν μπορεί να διπλωθεί χωρίς το TRiC, φάνηκε ότι το TRiC μπορεί να κάνει περισσότερα από το να βοηθάει παθητικά την τουμπουλίνη να αναδιπλωθεί αυθόρμητα. Αλλά πώς ακριβώς λειτουργεί αυτό; Αυτή η νέα μελέτη απαντά σε αυτό το ερώτημα και καταδεικνύει ότι, τουλάχιστον για πρωτεΐνες όπως η τουμπουλίνη, η έννοια της «αυθόρμητης αναδίπλωσης» δεν ισχύει. Αντίθετα, το TRiC ενορχηστρώνει άμεσα την αναδιπλούμενη οδό που οδηγεί στη σωστά διαμορφωμένη πρωτεΐνη.
Αν και οι πρόσφατες εξελίξεις στην τεχνητή νοημοσύνη ή AI, μπορούν να προβλέψουν την τελική, διπλωμένη δομή των περισσότερων πρωτεϊνών, είπε ο Frydman, η τεχνητή νοημοσύνη δεν δείχνει πώς μια πρωτεΐνη αποκτά το σωστό σχήμα. Αυτή η γνώση είναι θεμελιώδης για τον έλεγχο της αναδίπλωσης στο κύτταρο και την ανάπτυξη θεραπειών για ασθένειες αναδίπλωσης. Για να επιτευχθεί αυτός ο στόχος, οι ερευνητές πρέπει να καταλάβουν τα λεπτομερή βήματα της διαδικασίας αναδίπλωσης όπως συμβαίνει στο κελί.
Ένας κυψελοειδές θάλαμος αναλαμβάνει την ευθύνη
Πριν από δέκα χρόνια, οι Frydman, Chiu και οι ερευνητικές τους ομάδες αποφάσισαν να εμβαθύνουν στο τι συμβαίνει στον θάλαμο TRIC.
«Σε σύγκριση με τους απλούστερους πτυσσόμενους θαλάμους σαπερονινών στα βακτήρια, το TRiC στα ανθρώπινα κύτταρα είναι μια πολύ ενδιαφέρουσα και περίπλοκη μηχανή». είπε ο Φράιντμαν. «Κάθε μία από τις οκτώ υπομονάδες της έχει διαφορετικές ιδιότητες και παρουσιάζει μια ξεχωριστή επιφάνεια μέσα στον θάλαμο, και αυτό αποδεικνύεται πολύ σημαντικό».
Οι επιστήμονες ανακάλυψαν ότι το εσωτερικό αυτού του μοναδικού θαλάμου κατευθύνει τη διαδικασία αναδίπλωσης με δύο τρόπους.

(Yanyan Zhao/Πανεπιστήμιο Στάνφορντ)
Καθώς το καπάκι του θαλάμου κλείνει πάνω από μια πρωτεΐνη, εμφανίζονται περιοχές ηλεκτροστατικού φορτίου στα εσωτερικά του τοιχώματα. Προσελκύουν αντίθετα φορτισμένα μέρη του πρωτεϊνικού κλώνου της τουμπουλίνης και ουσιαστικά τα κολλούν στον τοίχο για να δημιουργήσουν το κατάλληλο σχήμα και διαμόρφωση για το επόμενο βήμα της αναδίπλωσης. Εν τω μεταξύ, οι «ουρές» της υπομονάδας TRiC που κρέμονται από το τοίχωμα του θαλάμου αρπάζουν την πρωτεΐνη τουμπουλίνης σε συγκεκριμένους χρόνους και σημεία για να την αγκυρώσουν και να τη σταθεροποιήσουν.
Για να ξεκινήσετε, το ένα άκρο του κλώνου τουμπουλίνης γαντζώνεται σε μια μικρή τσέπη στον τοίχο και διπλώνει. Στη συνέχεια, το άλλο άκρο συνδέεται σε διαφορετικό σημείο, δημιουργώντας μια μεγάλη θηλιά. Ο βρόχος διπλώνει με τρόπο που τον φέρνει ακριβώς δίπλα στην πρώτη διπλωμένη περιοχή.
Στο τρίτο βήμα, μέρος του μεσαίου τμήματος διπλώνει για να σχηματίσει τον πυρήνα της πρωτεΐνης, μαζί με θύλακες όπου το GTP, ένα μόριο που αποθηκεύει και απελευθερώνει ενέργεια για να τροφοδοτήσει το έργο του κυττάρου, μπορεί να συνδεθεί.
Τέλος, το υπόλοιπο τμήμα πρωτεΐνης διπλώνει. Το μόριο της τουμπουλίνης είναι τώρα έτοιμο για δράση.
"Αυτά τα δομικά στιγμιότυπα των ενδιάμεσων σταδίων της αναδιπλούμενης ακολουθίας δεν έχουν δει ποτέ πριν από κρυοηλεκτρονική μικροσκοπία." είπε ο Φράιντμαν.
Ένας δυνατός συνδυασμός τεχνικών
Η ομάδα της επιβεβαίωσε την αναδιπλούμενη ακολουθία με μια προκλητική σειρά βιοχημικών και βιοφυσικών δοκιμών που απαιτούσαν χρόνια δουλειάς.
Η ερμηνεία αυτών των αποτελεσμάτων επέτρεψε στους ερευνητές να δημιουργήσουν μια εικόνα του μεταβαλλόμενου σχήματος της τουμπουλίνης καθώς αναδιπλώνεται μέσα στον θάλαμο TRiC, που ταίριαζε με τις εικόνες που δημιουργούνται από το κρυο-ΕΜ.
«Είναι πολύ ισχυρό να μπορείς να πηγαίνεις μπρος-πίσω μεταξύ αυτών των τεχνικών, γιατί τότε μπορείς πραγματικά να ξέρεις ότι αυτό που βλέπεις αντικατοπτρίζει αυτό που συμβαίνει στο κελί». είπε ο Φράιντμαν.
"Η επιστήμη μας εξέπληξε με μια πραγματικά ενδιαφέρουσα λύση που δεν θα είχα προβλέψει."
Η μελέτη προσφέρει επίσης ενδείξεις για την κατανόηση του τρόπου με τον οποίο αυτό το αναδιπλούμενο σύστημα εξελίχθηκε σε ευκαρυωτικά κύτταρα, τα οποία αποτελούν φυτά, ζώα και ανθρώπους, αλλά όχι σε απλούστερα κύτταρα όπως αυτά των βακτηρίων και των αρχαίων. Καθώς οι πρωτεΐνες έγιναν όλο και πιο περίπλοκες για να εξυπηρετήσουν τις ανάγκες των ευκαρυωτικών κυττάρων, οι ερευνητές προτείνουν, σε κάποιο σημείο δεν μπορούσαν να διπλωθούν στα σχήματα που χρειάζονταν για να εκτελέσουν πιο περίπλοκες εργασίες χωρίς λίγη βοήθεια. Οι ευκαρυωτικές πρωτεΐνες και ο θάλαμος σαπερονίνης τους πιθανότατα εξελίχθηκαν μαζί, ξεκινώντας πιθανώς με τον τελευταίο κοινό πρόγονο όλων των ευκαρυωτικών οργανισμών πριν από περίπου 2.7 δισεκατομμύρια χρόνια.
Λόγω της πολυπλοκότητας των αναλύσεων και του μεσοδιαστήματος της πανδημίας, η μελέτη διήρκεσε τόσο πολύ που πολλοί από τους ανθρώπους που εργάστηκαν σε αυτήν έχουν προχωρήσει σε άλλες δουλειές. Περιλαμβάνουν τους μεταδιδακτορικούς ερευνητές Daniel Gestaut και Miranda Collier από την ομάδα του Frydman, οι οποίοι πραγματοποίησαν το βιοχημικό μέρος του έργου και το ώθησαν προς τα εμπρός, και τους Yanyan Zhao, Soung-Hun Roh, Boxue Ma και Greg Pintilie από την ομάδα του Chiu, που εκτέλεσαν το cryo. -ΕΜ αναλύσεις. Πρόσθετοι συνεισφέροντες ήταν ο Junsun Park, φοιτητής στην ομάδα του Roh, και ο Alexander Leitner από το ETH στη Ζυρίχη της Ελβετίας.
Το έργο υποστηρίχθηκε από επιχορηγήσεις στους Wah Chiu και Judith Frydman από το NIH και επιχορηγήσεις στον Soung-Hun Roh, ο οποίος είναι τώρα επίκουρος καθηγητής στο Εθνικό Πανεπιστήμιο της Σεούλ, από το Εθνικό Ίδρυμα Ερευνών της Κορέας και το Ίδρυμα Suh Kyungbae (SUHF).
Εφημερίδα αναφοράς
- Daniel Gestaut et al., Δομική οπτικοποίηση του μονοπατιού αναδίπλωσης τουμπουλίνης κατευθυνόμενη από ανθρώπινη συναερονίνη TRiC/CCT. Κύτταρο, 8 Δεκεμβρίου 2022 DOI: 10.1016 / j.cell.2022.11.014