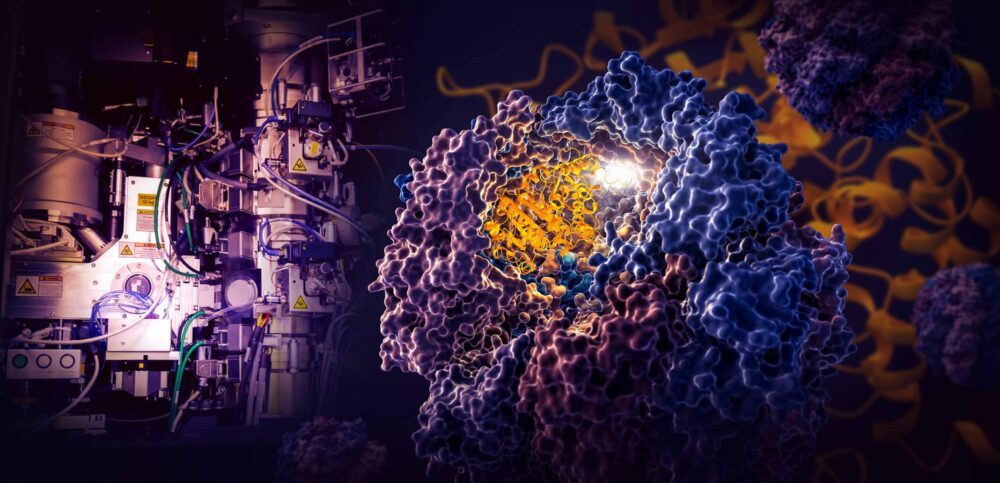
Un estudio histórico realizado por investigadores del Laboratorio Nacional de Aceleradores SLAC del Departamento de Energía y la Universidad de Stanford revela cómo una pequeña máquina celular llamada TRiC dirige el plegamiento de la tubulina, una proteína humana que es el componente básico de los microtúbulos que sirven como andamiaje y sistema de transporte de la célula. .
Hasta ahora, los científicos pensaban que TRiC y máquinas similares, conocidas como chaperoninas, proporcionan pasivamente un entorno propicio para el plegamiento, pero no participan directamente en él.
Hasta el 10% de las proteínas en nuestras células, así como las de las plantas y los animales, obtienen ayuda práctica de estas pequeñas cámaras para plegarse en sus formas activas finales, estimaron los investigadores.
Muchas de las proteínas que se pliegan con la ayuda de TRiC están íntimamente relacionadas con enfermedades humanas, incluidos ciertos tipos de cáncer y trastornos neurodegenerativos como el Parkinson, el Huntington y el Alzheimer, dijo la profesora de Stanford Judith Frydman, una de las autoras principales del estudio.
De hecho, dijo, muchos medicamentos contra el cáncer están diseñados para alterar la tubulina y los microtúbulos que forma, que son realmente importantes para la división celular. Por lo tanto, enfocarse en el proceso de plegamiento de tubulina asistido por TRiC podría proporcionar una estrategia atractiva contra el cáncer.
El equipo informó los resultados de su estudio de una década en un artículo publicado en Celular .
“Esta es la estructura proteica más emocionante en la que he trabajado en mis 40 años de carrera”, dijo el profesor Wah Chiu de SLAC/Stanford, pionero en el desarrollo y uso de la microscopía electrónica criogénica (crio-EM) y director de la división de bioimagen y crio-EM de SLAC.
“Cuando conocí a Judith hace 20 años”, él dijo, “Hablamos sobre si podíamos ver cómo se plegaban las proteínas. Eso es algo que la gente ha estado tratando de hacer durante años, y ahora lo hemos hecho”.
Los investigadores capturaron cuatro pasos distintos en el proceso de plegamiento dirigido por TRiC a una resolución casi atómica con crio-EM y confirmaron lo que vieron con análisis bioquímicos y biofísicos.
En el nivel más básico, dijo Frydman, este estudio resuelve el antiguo enigma de por qué la tubulina no puede plegarse sin la ayuda de TRiC: "Realmente es un cambio de juego al traer finalmente una nueva forma de entender cómo se pliegan las proteínas en la célula humana".
Doblando espaguetis en flores
Las proteínas juegan un papel esencial en prácticamente todo lo que hace una célula, y descubrir cómo se pliegan en sus estados 3D finales es una de las búsquedas más importantes en química y biología.
Como dice Chiu, “Una proteína comienza como una cadena de aminoácidos que parece espagueti, pero no puede funcionar hasta que se pliega en una flor con la forma correcta”.
Desde mediados de la década de 1950, nuestra imagen de cómo se pliegan las proteínas ha sido formada por experimentos realizados con proteínas pequeñas por el investigador de los Institutos Nacionales de Salud Christian Anfinsen. Descubrió que si desdoblaba una proteína pequeña, volvería espontáneamente a la misma forma y concluyó que las instrucciones para hacerlo estaban codificadas en la secuencia de aminoácidos de la proteína. Anfinsen compartió el Premio Nobel de 1972 en química por este descubrimiento.
Treinta años después, los investigadores descubrieron que las máquinas celulares especializadas ayudan a que las proteínas se plieguen. Pero la opinión predominante era que su función se limitaba a ayudar a las proteínas a llevar a cabo su plegamiento espontáneo al protegerlas de quedar atrapadas o unirse.
Un tipo de máquina auxiliar, llamada chaperonina, contiene una cámara en forma de barril que contiene proteínas en su interior mientras se pliegan. TRiC encaja en esta categoría.
La cámara TRiC es única porque consta de ocho subunidades diferentes que forman dos anillos apilados. Una hebra larga y delgada de proteína tubulina se introduce en la abertura de la cámara mediante una molécula auxiliar con forma de medusa. Luego, la tapa de la cámara se cierra y comienza el plegado. Cuando termina, la tapa se abre y la tubulina terminada y doblada sale.
Dado que la tubulina no puede plegarse sin TRiC, parece que TRiC puede hacer más que ayudar pasivamente a la tubulina a plegarse espontáneamente. ¿Pero cómo, exactamente, Cómo funciona eso? Este nuevo estudio responde a esa pregunta y demuestra que, al menos para proteínas como la tubulina, el concepto de "plegamiento espontáneo" no se aplica. En cambio, TRiC orquesta directamente la vía de plegamiento que conduce a la proteína con la forma correcta.
Aunque los avances recientes en inteligencia artificial, o IA, pueden predecir la estructura plegada final de la mayoría de las proteínas, dijo Frydman, la IA no muestra cómo una proteína alcanza su forma correcta. Este conocimiento es fundamental para controlar el plegamiento de la célula y desarrollar terapias para las enfermedades del plegamiento. Para lograr este objetivo, los investigadores deben descubrir los pasos detallados del proceso de plegamiento tal como ocurre en la célula.
Una cámara celular se hace cargo
Hace diez años, Frydman, Chiu y sus equipos de investigación decidieron profundizar en lo que sucede en la cámara TRIC.
"En comparación con las cámaras de plegamiento más simples de las chaperoninas en las bacterias, el TRiC en las células humanas es una máquina muy interesante y complicada". dijo Friedman. “Cada una de sus ocho subunidades tiene propiedades diferentes y presenta una superficie distinta dentro de la cámara, y esto resulta ser realmente importante”.
Los científicos descubrieron que el interior de esta cámara única dirige el proceso de plegado de dos maneras.

(Yanyan Zhao/Universidad de Stanford)
A medida que la tapa de la cámara se cierra sobre una proteína, aparecen áreas de carga electrostática en sus paredes internas. Atraen partes con carga opuesta de la cadena de proteína de tubulina y esencialmente las adhieren a la pared para crear la forma y configuración adecuadas para el siguiente paso en el plegamiento. Mientras tanto, las "colas" de la subunidad TRiC que cuelgan de la pared de la cámara agarran la proteína tubulina en momentos y lugares específicos para anclarla y estabilizarla.
Para empezar, un extremo del hilo de tubulina se engancha en un pequeño bolsillo en la pared y se pliega. Luego, el otro extremo se une en un lugar diferente, creando un gran lazo. El lazo se pliega de tal manera que lo lleva justo al lado de la primera área doblada.
En el paso tres, parte de la sección central se pliega para formar el núcleo de la proteína, junto con bolsillos donde se puede conectar GTP, una molécula que almacena y libera energía para impulsar el trabajo de la célula.
Finalmente, la sección de proteína restante se pliega. La molécula de tubulina ya está lista para la acción.
"Estas instantáneas estructurales de etapas intermedias en la secuencia de plegamiento nunca antes se habían visto mediante microscopía crioelectrónica". dijo Friedman.
Una poderosa combinación de técnicas.
Su equipo confirmó la secuencia de plegamiento con una desafiante serie de pruebas bioquímicas y biofísicas que requirieron años de trabajo.
La interpretación de esos resultados permitió a los investigadores construir una imagen de la forma cambiante de la tubulina a medida que se pliega dentro de la cámara TRiC, que coincidía con las imágenes generadas por crio-EM.
"Es muy poderoso poder ir y venir entre estas técnicas, porque entonces realmente puedes saber que lo que ves refleja lo que está sucediendo en la célula". dijo Friedman.
“La ciencia nos ha sorprendido con una solución realmente interesante que no hubiera previsto”.
El estudio también ofrece pistas para comprender cómo evolucionó este sistema de plegamiento en las células eucariotas, que forman las plantas, los animales y los humanos, pero no en células más simples como las de las bacterias y las arqueas. A medida que las proteínas se volvieron más y más complejas para satisfacer las necesidades de las células eucariotas, sugieren los investigadores, en algún momento no pudieron plegarse en las formas que necesitaban para realizar trabajos más complicados sin un poco de ayuda. Las proteínas eucariotas y su cámara de chaperoninas probablemente evolucionaron juntas, posiblemente comenzando con el último ancestro común de todos los organismos eucariotas hace unos 2.7 millones de años.
Debido a la complejidad de los análisis y al interludio de la pandemia, el estudio se prolongó tanto que muchas de las personas que trabajaron en él se trasladaron a otros trabajos. Incluyen a los investigadores postdoctorales Daniel Gestaut y Miranda Collier del grupo de Frydman, quienes llevaron a cabo la parte bioquímica del proyecto y lo impulsaron, y Yanyan Zhao, Soung-Hun Roh, Boxue Ma y Greg Pintilie del grupo de Chiu, quienes realizaron el crio -Análisis EM. Los colaboradores adicionales incluyeron a Junsun Park, un estudiante del grupo de Roh, y Alexander Leitner de ETH en Zúrich, Suiza.
El trabajo fue apoyado por subvenciones a Wah Chiu y Judith Frydman del NIH y subvenciones a Soung-Hun Roh, quien ahora es profesor asistente en la Universidad Nacional de Seúl, de la Fundación Nacional de Investigación de Corea y la Fundación Suh Kyungbae (SUHF).
Diario de Referencia
- Daniel Gestaut et al., Visualización estructural de la vía de plegamiento de la tubulina dirigida por la chaperonina humana TRiC/CCT. Celular, 8 de diciembre de 2022 DOI: 10.1016 / j.cell.2022.11.014