Un nuevo tipo de modelo informático que puede revelar el daño por radiación a nivel celular podría mejorar los resultados de la radioterapia en pacientes con cáncer de pulmón.
romano bauer, neurocientífico computacional de la Universidad de Surrey en el Reino Unido, en colaboración con marcar durante y Nicolò Cogno Desde GSI Helmholtzzentrum para Schwerionenforschung en Alemania, creó el modelo que simula cómo la radiación interactúa con los pulmones célula por célula.
Más de la mitad de todos los pacientes con cáncer de pulmón reciben tratamiento con radioterapia. Aunque este enfoque es eficaz, deja hasta el 30% de los receptores con lesiones inducidas por la radiación. Estos pueden desencadenar afecciones graves que afectan la respiración, como fibrosis (en la que el revestimiento de los alvéolos (sacos de aire) de los pulmones se engrosa y se endurece) y neumonitis (cuando las paredes de los alvéolos se inflaman).
Para limitar el daño por radiación al tejido sano y al mismo tiempo matar las células cancerosas, la radioterapia se administra en varias “fracciones” separadas. Esto permite administrar una dosis más alta, y por lo tanto más efectiva, en general porque algunas de las células sanas dañadas pueden repararse a sí mismas entre cada fracción.
Actualmente, los esquemas de fraccionamiento de radioterapia se eligen en función de experiencias pasadas y modelos estadísticos generalizados, por lo que no están optimizados para pacientes individuales. En cambio, la medicina personalizada podría lograrse gracias a este nuevo modelo que, como señala Durante, director del Departamento de Biofísica de GSI explica, analiza “la toxicidad en los tejidos a partir de las reacciones celulares básicas y, por lo tanto, [es] capaz de predecir lo que le sucede a cualquier paciente” cuando se eligen diferentes esquemas de fraccionamiento.
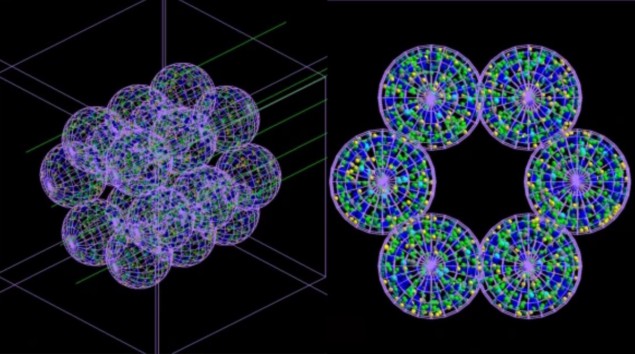
El equipo desarrolló un modelo "basado en agentes" (ABM, por sus siglas en inglés) que consiste en unidades o agentes que interactúan separados, que en este caso imitan las células pulmonares, junto con un simulador de Monte Carlo. El ABM, descrito en Medicina de las comunicaciones, construye una representación de un segmento alveolar que consta de 18 alvéolos de 260 µm de diámetro cada uno. A continuación, se llevan a cabo simulaciones Monte Carlo de la irradiación de estos alvéolos a escala microscópica y nanoscópica, y la información sobre la dosis de radiación administrada a cada célula y su distribución se devuelve al ABM.
El ABM utiliza esta información para determinar si cada célula vivirá o morirá y genera los resultados finales en forma de una imagen en 3D. Fundamentalmente, el modelo acoplado puede simular el paso del tiempo y así mostrar la gravedad del daño por radiación (y la progresión de las afecciones médicas que puede causar) horas, días, meses o incluso años después del tratamiento.
“Lo que me pareció muy interesante es que estas simulaciones computacionales arrojaron resultados que coincidían con varias observaciones experimentales de diferentes grupos, laboratorios y hospitales. Por lo tanto, nuestro enfoque computacional podría utilizarse en principio en el ámbito clínico”, afirma Bauer, portavoz de la organización internacional Colaboración BioDynaMo, cuyo objetivo es incorporar nuevos métodos computacionales a la atención sanitaria a través del paquete de software utilizado para construir este modelo.
Bauer empezó a trabajar en modelos computacionales de cáncer después de que un amigo cercano muriera a causa de la enfermedad con tan solo 34 años. "Cada cáncer es diferente y cada persona es diferente, con diferentes formas de órganos, predisposiciones genéticas y estilos de vida", explica. Su esperanza es que la información de exploraciones, biopsias y otras pruebas pueda incorporarse al nuevo modelo para proporcionar una imagen de cada individuo. Luego se podría crear un protocolo de terapia asistida por IA que generaría un plan de tratamiento personalizado que mejore las posibilidades de supervivencia del paciente.
La planificación específica del paciente podría mejorar los resultados de la radioterapia
Actualmente, Bauer está buscando colaboradores de otras disciplinas, incluida la física, para ayudar a avanzar hacia un ensayo clínico que siga a pacientes con cáncer de pulmón durante varios años. Mientras tanto, el equipo pretende ampliar el uso del modelo a otras áreas de la medicina.
Durante, por ejemplo, espera estudiar la infección viral con este modelo de pulmón, ya que "puede predecir la neumonitis inducida por la infección por COVID-19". Mientras tanto, Bauer ha comenzado a simular el desarrollo de circuitos en el cerebro de bebés prematuros, con el objetivo de comprender mejor “en qué momento intervenir y cómo”.
- Distribución de relaciones públicas y contenido potenciado por SEO. Consiga amplificado hoy.
- PlatoData.Network Vertical Generativo Ai. Empodérate. Accede Aquí.
- PlatoAiStream. Inteligencia Web3. Conocimiento amplificado. Accede Aquí.
- PlatoESG. Carbón, tecnología limpia, Energía, Ambiente, Solar, Gestión de residuos. Accede Aquí.
- PlatoSalud. Inteligencia en Biotecnología y Ensayos Clínicos. Accede Aquí.
- Fuente: https://physicsworld.com/a/modelling-lung-cells-could-help-personalize-radiotherapy/
- :posee
- :es
- :no
- $ UP
- 135
- 3d
- a
- Poder
- Nuestra Empresa
- AC
- alcanzado
- administrado
- afectar
- Después
- años de edad
- agentes
- paquete de capacitación DWoVH
- AIRE
- Todos
- permite
- Aunque
- an
- y
- cualquier
- enfoque
- somos
- áreas
- AS
- At
- Atrás
- basado
- básica
- base
- BE
- porque
- a las que has recomendado
- comenzó
- comenzado
- mejores
- entre
- respiración
- llevar
- build
- construye
- by
- PUEDEN
- Cáncer
- Células cancerígenas
- llevado a
- case
- Causa
- (SCD por sus siglas en inglés),
- Células
- posibilidades
- elegido
- Clínico
- Cerrar
- de cerca
- colaboración
- colaboradores
- computational
- computadora
- condiciones
- Que consiste
- contraste
- podría
- acoplado
- COVID-19
- creado
- crucialmente
- En la actualidad
- dañar
- Días
- liberado
- Departamento
- descrito
- desarrollado
- Desarrollo
- El
- murió
- una experiencia diferente
- Director
- disciplinas
- Enfermedades
- dosificar
- cada una
- Eficaz
- Incluso
- Cada
- emocionante
- Expandir
- experience
- experimental
- Explica
- Fed
- final
- siguiendo
- formulario
- encontrado
- fracción
- Amigo
- Desde
- Generalizado
- genéticas
- Alemania
- objetivo
- Grupo
- A Mitad
- que sucede
- he
- la salud
- saludable
- ayuda
- más alto
- su
- esperanza
- con la esperanza
- hospitales
- HORAS
- Cómo
- HTTPS
- i
- mejorar
- mejora
- in
- Incluye
- INSTRUMENTO individual
- información
- lesiones
- ejemplo
- tiene la intención
- interactuando
- interactúa
- Internacional
- intervenir
- dentro
- IT
- SUS
- jpg
- solo
- matanza
- labs
- Nivel
- estilos de vida
- LIMITE LAS
- revestimiento
- Etiqueta LinkedIn
- para vivir
- MIRADAS
- emparejado
- max-ancho
- Puede..
- Mientras tanto
- servicios
- medicina
- métodos
- microscópico
- modelo
- modelización
- modelos
- meses
- más,
- movimiento
- Naturaleza
- Nuevo
- Next
- of
- on
- optimizado
- or
- solicite
- Otro
- nuestros
- salir
- resultados
- salida
- salidas
- Más de
- total
- passage
- pasado
- paciente
- los pacientes
- persona
- personalizar
- Personalizado
- Física
- Mundo de la física
- imagen
- plan
- planificar
- Platón
- Inteligencia de datos de Platón
- PlatónDatos
- punto
- predecir
- Prematuro
- principio
- progresión
- protocolo
- proporcionar
- Radioterapia
- reacciones
- destinatarios
- reparación
- representación
- Resultados
- género
- dice
- Escala
- escanea
- esquemas
- la búsqueda de
- segmento
- separado
- grave
- pólipo
- Varios
- en forma de
- Mostrar
- simular
- simulaciones
- simulador
- So
- Software
- algo
- portavoz
- Comience a
- estadístico
- Sin embargo
- ESTUDIO
- tal
- suite
- Surrey
- supervivencia
- adaptado
- equipo
- pruebas
- Muchas Gracias
- esa
- La
- el Reino Unido
- sí mismos
- luego
- terapia forestal
- por lo tanto
- Estas
- así
- uña del pulgar
- Así
- equipo
- a
- hacia
- tratados
- del mismo día
- juicio
- detonante
- verdadero
- tipo
- Uk
- comprensión
- unidades que
- utilizan el
- usado
- usos
- usando
- diversos
- muy
- vía
- virales
- ¿
- cuando
- sean
- que
- mientras
- dentro de
- Actividades:
- rutina de ejercicio
- trabajando
- mundo
- se
- años
- zephyrnet