Kujutage ette iseliikuvate radioisotoopidega kaetud osakeste armeed, mis on 2500–10,000 XNUMX korda väiksemad kui tolmukübemed, mis kehasse süstides otsivad vähkkasvajaid ja kinnituvad nende külge, hävitades need. Kõlab nagu ulme? Mitte nii põievähiga hiirte puhul.
Hispaania teadlased teatavad, et radioaktiivset joodi sisaldavad nanoosakesed, mis karbamiidiga reageerimisel liiguvad, suudavad eristada vähkkasvajaid tervetest kudedest. Need "nanobotid" tungivad läbi kasvaja rakuvälisesse maatriksisse ja kogunevad sellesse, võimaldades radionukliidravil jõuda oma täpse sihtmärgini. aastal läbi viidud uuringus Kataloonia Bioinseneri instituut (IBEC) Barcelonas oli hiirtel, kes said seda ravi ühekordse annuse, põie kasvajate suurus 90% vähem võrreldes ravimata loomadega.
See uudne lähenemisviis võib ühel päeval põievähi ravis revolutsiooni teha. Maailma Terviseorganisatsiooni ülemaailmse vähivaatluskeskuse andmetel on põievähk maailmas kümnendal kohal, 600,000. aastal diagnoositi üle 2022 220,000 uue juhtumi ja üle XNUMX XNUMX surmajuhtumi kogu maailmas.
Lihastesse mitteinvasiivset põievähki, mis moodustab 75% juhtudest, ravitakse praegu kasvaja resektsiooniga, millele järgneb kemoteraapia või immunoteraapia ravimite intravesikaalne süstimine põide. Ravimi kohaletoimetamine on aga eriti keeruline uroteeli (kuseteede sisemust vooderdava koe) vähese läbilaskvuse, uriini sisu täitmise ja sellele järgneva ravimite väljapesemise tõttu. Protsess on patsientidele ka ebamugav, kuna nad peavad pikali olles aeg-ajalt oma keha pöörama, et ravimid jõuaksid põieseina kõikidele külgedele. Pärast ravi on viie aasta jooksul kordumise risk 30–70%.
Kliiniliste tulemuste parandamiseks juhtivteadur Samuel Sanchez ja kolleegide eesmärk on välja töötada uuenduslikud ja tõhusamad põievähi ravimeetodid ning vähendada selle käigus retsidiivide esinemissagedust. Lisaks vähendaks üheannuseline ravi märkimisväärselt ravikulusid, mis praegu nõuavad kuus kuni 14 haiglaravi.
Meeskond lõi mesopoorsetest ränidioksiidi nanoosakestest nanobotid, mille pinnal on erinevad funktsionaalsed komponendid. Nende hulka kuuluvad PET-i visualiseerimiseks või radionukliidraviks kasutatavad radioisotoobid ja valguureaas, mis reageerib uriinis leiduva karbamiidiga ja võimaldab nanoboti tõukejõu.
Sisestamine Loodus Nanotehnoloogia, teatavad teadlased, et kui nad lisasid 300 mM uureat sisaldavale lahusele tilga nanoboteid, ilmutasid nanobotid kubisevat liikumist, moodustades aktiivsed ja jõulised rinded ja kolmemõõtmelised keerised. Ilma karbamiidita settisid nanobotid lihtsalt lisamiskoha lähedal.
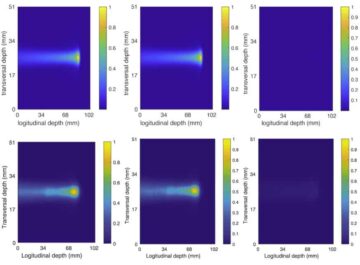
Uurida, kas nanobotid võivad jõuda kasvajani in vivo, hindas meeskond nende käitumist kasvajat kandvatel hiirtel. Positronemissioontomograafia (PET) pildid näitasid, et radioaktiivselt märgistatud nanobottide signaalid paiknesid MRI abil kindlaks määratud kasvaja asukohaga koos, kusjuures radioaktiivsust nähti peamiselt kasvaja sihtpunktis. Ainult hiirtel, kellele süstiti nanoboteid ja karbamiidi, ilmnes kasvaja massi oluline kogunemine – vees manustatud nanobotid ja vees või uureas manustatud kontroll-nanoosakesed (ilma ureaasita) näitasid kasvaja minimaalset omastamist.
Teadlased viitavad sellele, et nanobotite liikuvus aitab neil tungida kasvaja massi. "Nanobotidel puuduvad kasvaja äratundmiseks spetsiifilised antikehad ja kasvajakude on tavaliselt jäigem kui terve kude, kuid põiekasvajate puhul see nii ei ole," selgitab kaasautor. Meritxell Serra Casablancas IBEC-ist. "Me täheldasime, et need nanorobotid võivad lagundada kasvaja rakuvälist maatriksit, suurendades lokaalselt pH-d iseliikuva keemilise reaktsiooni kaudu. See nähtus soodustas kasvaja suuremat levikut. Teadlased usuvad, et nanobotid põrkuvad uroteeliga, nagu oleks see sein, kuid tungivad läbi kasvaja, mis on käsnlikum.
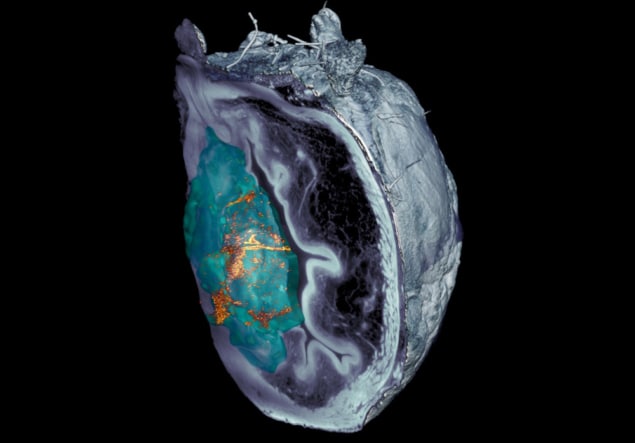
Meeskond märgib, et nanobotite tuvastamine tükeldatud koe mikroskoopiapiltidel oli keeruline. Pärast seda, kui konfokaalse optilise mikroskoopia tehnikad ebaõnnestusid, leidsid teadlased aadressil IRB Barcelona töötas välja tasapinnalisel laservalgustusel põhineva valgus-lehepõhise mikroskoopiasüsteemi, mis on võimeline skaneerima põie erinevaid kihte ja looma kogu elundi 3D-rekonstruktsiooni.
"Meie väljatöötatud hajutatud elastne valguslehtmikroskoopia süsteem võimaldas meil kõrvaldada kasvaja enda peegelduva valguse, võimaldades meil enneolematu eraldusvõimega tuvastada ja leida nanoosakesi kogu elundis ilma eelneva märgistamiseta," ütleb ta. Julien Colombelli IRB Barcelonast.

Tehtud bakterid meelitavad kasvajatesse vähki tapvaid radioisotoope
Selle tehnika terapeutilise toime hindamiseks märgistas meeskond nanobotid jood-131-ga (131Mina, radionukliidraviks tavaliselt kasutatav radioisotoop) ja manustasin neid kasvajat kandvatele hiirtele. Ravi kaotatud annusega 131Karbamiidi I-nanobotid peatasid kasvaja kasvu, samas kui suured annused 131Uureas manustatud I-nanobotid vähendasid kasvaja mahtu peaaegu 90% võrreldes ravimata loomadega.
Sánchez räägib Füüsika maailm et meeskonna järgmised sammud on kapseldada praegu keemiaravis kasutatavad väikesed ravimid ja jätkata nanobotite kui ravimikandjate efektiivsuse testimist. Lõpuks kavatsevad nad nanoboteid laiendada ja uurida regulatiivseid teid, et liikuda järgmise kolme kuni nelja aasta jooksul esimeste kliiniliste uuringute poole IBEC-i spinoffi kaudu. Nanobots Therapeutics.
- SEO-põhise sisu ja PR-levi. Võimenduge juba täna.
- PlatoData.Network Vertikaalne generatiivne Ai. Jõustage ennast. Juurdepääs siia.
- PlatoAiStream. Web3 luure. Täiustatud teadmised. Juurdepääs siia.
- PlatoESG. Süsinik, CleanTech, Energia, Keskkond päikeseenergia, Jäätmekäitluse. Juurdepääs siia.
- PlatoTervis. Biotehnoloogia ja kliiniliste uuringute luureandmed. Juurdepääs siia.
- Allikas: https://physicsworld.com/a/self-propelling-nanobots-shrink-bladder-tumours-in-mice-by-90/
- :on
- :mitte
- $ UP
- 000
- 10
- 135
- 14
- 2022
- 220
- 300
- 3d
- 600
- a
- võime
- Vastavalt
- Kontod
- Kogunema
- kogunemine
- aktiivne
- lisatud
- lisamine
- Lisaks
- manustatud
- pärast
- eesmärk
- Materjal: BPA ja flataatide vaba plastik
- Lubades
- Ka
- an
- ja
- loomad
- lähenemine
- OLEME
- Armee
- arreteeriti
- AS
- hinnatud
- At
- kinnitage
- meelitada
- autor
- Bakterid
- Barcelona
- põhineb
- käitumine
- Uskuma
- vahel
- asutused
- keha
- Murdma
- kuid
- by
- CAN
- vähk
- võimeline
- vedajad
- juhul
- juhtudel
- raske
- keemiline
- kliiniline
- Kliinilistes uuringutes
- kolleegidega
- Põrkuvad
- COM
- ühine
- tavaliselt
- võrreldes
- komponendid
- läbi
- sisu
- jätkama
- kontrollida
- Maksma
- loodud
- loomine
- Praegu
- päev
- surmad
- esitatud
- tarne
- kindlaksmääratud
- arendama
- arenenud
- erinev
- eristama
- annus
- alla
- uimasti
- Narkootikumide
- kaks
- Tolm
- mõju
- Tõhus
- efektiivsus
- kõrvaldama
- emissioon
- võimaldama
- lubatud
- võimaldab
- võimaldades
- Kogu
- EU
- hindama
- lõpuks
- uurima
- eksponeeritud
- Selgitab
- Ebaõnnestunud
- Ilukirjandus
- täitmine
- esimene
- viis
- Järgneb
- Järel
- eest
- neli
- Alates
- funktsionaalne
- Globaalne
- Ülemaailmselt
- suurem
- Kasv
- olnud
- Olema
- Tervis
- tervislik
- aitab
- aga
- HTTPS
- identifitseerima
- identifitseerimiseks
- if
- pildid
- immuunravi
- parandama
- in
- sisaldama
- kasvav
- info
- uuenduslik
- sees
- kavatsevad
- sisse
- probleem
- IT
- ITS
- ise
- jpg
- märgistamine
- puudus
- laser
- kihid
- Led
- valgus
- nagu
- vooder
- kohapeal
- Madal
- Mass
- maatriks
- max laiuse
- mai..
- Mikroskoopia
- minimaalne
- liikuvus
- rohkem
- kõige
- liikumine
- liikuma
- MRI
- loodus
- Lähedal
- peaaegu
- Vajadus
- Uus
- järgmine
- meeles
- romaan
- observatoorium
- of
- on
- ONE
- ainult
- or
- tulemusi
- üle
- eriti
- teed
- patsientidel
- hõlvamine
- nähtus
- Füüsika
- Füüsika maailm
- Platon
- Platoni andmete intelligentsus
- PlatoData
- pluss
- positsioon
- vajadus
- eelkõige
- Peamine
- Eelnev
- protsess
- Propell
- tõukejõu
- Valk
- Rates
- jõudma
- reaktsioon
- reageerib
- vastuvõtmine
- ära tundma
- kordumine
- vähendama
- vähendamine
- kajastatud
- regulatiivne
- aru
- Vajab
- Teadlased
- resolutsioon
- murranguliseks muuta
- Oht
- ütleb
- Skaala
- skaneerimine
- laiali
- teadus
- Ulme
- Otsing
- nähtud
- näitas
- Küljed
- signaale
- märgatavalt
- lihtsalt
- ühekordne
- site
- SIX
- SUURUS
- väike
- väiksem
- So
- lahendus
- helid
- Hispaania
- konkreetse
- Sammud
- Uuring
- järgnev
- mahukas
- soovitama
- süsteem
- sihtmärk
- meeskond
- tehnikat
- ütleb
- test
- kui
- et
- .
- maailm
- oma
- Neile
- ennast
- ravi
- Need
- nad
- see
- kolm
- kolmemõõtmeline
- Läbi
- läbi kogu
- thumbnail
- korda
- et
- suunas
- töödeldud
- ravi
- ravi
- uuringutes
- tõsi
- Pöörake
- tüüpiliselt
- enneolematu
- peale
- omastamine
- us
- Kasutatud
- eri
- kaudu
- visualiseerimine
- maht
- Sein
- oli
- Vesi
- we
- olid
- millal
- kas
- mis
- kuigi
- koos
- jooksul
- ilma
- maailm
- oleks
- aastat
- sephyrnet