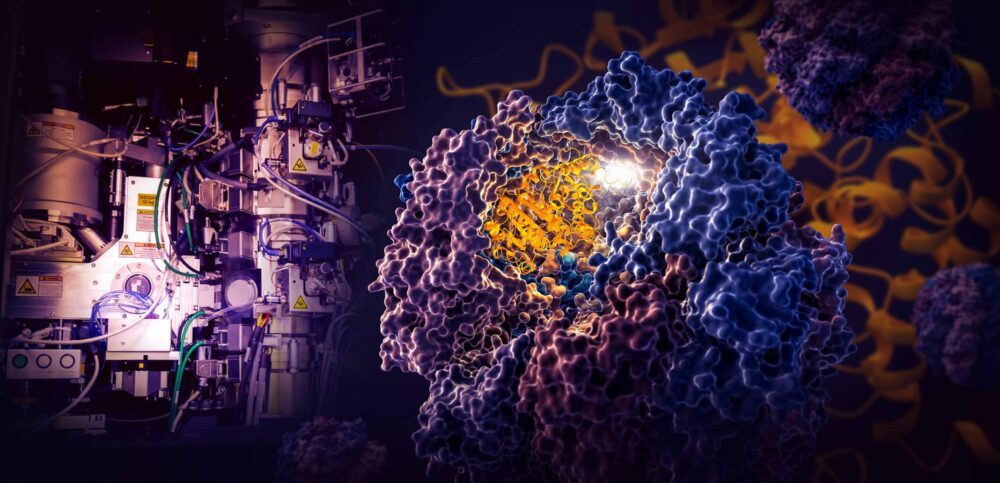
Energiaministeriön SLAC National Accelerator Laboratoryn ja Stanfordin yliopiston tutkijoiden maamerkkitutkimus paljastaa, kuinka pieni TRIC-niminen solukone ohjaa tubuliinin, ihmisen proteiinin, laskostumista, joka on solun rakennustelineinä ja kuljetusjärjestelmänä toimivien mikrotubulusten rakennuspalikka. .
Tähän asti tiedemiehet uskoivat, että TRIC ja vastaavat koneet, jotka tunnetaan nimellä chaperonins, tarjoavat passiivisesti taittoa edistävän ympäristön, mutta eivät osallistu siihen suoraan.
Tutkijat arvioivat, että jopa 10 % soluissamme olevista proteiineista sekä kasveissa ja eläimissä olevista proteiineista saa käytännön apua näistä pienistä kammioista taittuessaan lopulliseen, aktiiviseen muotoonsa.
Monet TRiC:n avulla laskostuvat proteiinit liittyvät läheisesti ihmisten sairauksiin, mukaan lukien tiettyihin syöpiin ja hermostoa rappeutuviin sairauksiin, kuten Parkinsonin, Huntingtonin ja Alzheimerin tauteihin, sanoi Stanfordin professori Judith Frydman, yksi tutkimuksen johtajista.
Itse asiassa hän sanoi, että monet syöpälääkkeet on suunniteltu häiritsemään tubuliinia ja sen muodostamia mikrotubuluksia, jotka ovat todella tärkeitä solujen jakautumiselle. Joten kohdistaminen TRIC-avusteiseen tubuliinin taittoprosessiin voisi tarjota houkuttelevan syövän vastaisen strategian.
Ryhmä raportoi vuosikymmenen kestäneen tutkimuksensa tuloksista vuonna julkaistussa paperissa Solu tänään.
"Tämä on jännittävin proteiinirakenne, jonka parissa olen työskennellyt 40-vuotisen urani aikana." sanoi SLAC/Stanfordin professori Wah Chiu, kryogeenisen elektronimikroskopian (cryo-EM) kehittämisen ja käytön pioneeri ja SLAC:n kryo-EM- ja biokuvantamisosaston johtaja.
"Kun tapasin Judithin 20 vuotta sitten", hän sanoi, "Puhuimme siitä, voisimmeko nähdä proteiinien laskostuvan. Se on jotain, jota ihmiset ovat yrittäneet tehdä vuosia, ja nyt olemme tehneet sen.
Tutkijat vangitsivat neljä erillistä vaihetta TRiC-ohjatussa taittoprosessissa lähes atomiresoluutiolla kryo-EM:llä ja vahvistivat näkemänsä biokemiallisilla ja biofysikaalisilla analyyseillä.
Perustasolla Frydman sanoi, että tämä tutkimus ratkaisee pitkäaikaisen arvoituksen siitä, miksi tubuliini ei voi taittua ilman TRIC:n apua: "Se on todellakin pelin muuttaja tuomalla vihdoin uuden tavan ymmärtää proteiinien laskostumista ihmissolussa."
Spagetin taittaminen kukiksi
Proteiineilla on olennainen rooli käytännössä kaikessa, mitä solu tekee, ja sen selvittäminen, kuinka ne taittuvat lopulliseen 3D-tilaansa, on yksi kemian ja tieteen tärkeimmistä tehtävistä. biologia.
Kuten Chiu sanoo, "Proteiini alkaa aminohappojen sarjana, joka näyttää spagettia, mutta se ei voi toimia ennen kuin se on taitettu juuri oikean muotoiseksi kukaksi."
1950-luvun puolivälistä lähtien kuvaamme proteiinien laskostumisesta on muokannut National Institutes of Healthin tutkijan Christian Anfinsenin pienillä proteiineja käyttävillä kokeilla. Hän havaitsi, että jos hän avaisi pienen proteiinin, se ponnahtaa spontaanisti takaisin samaan muotoon, ja päätteli, että ohjeet sen tekemiseen oli koodattu proteiinin aminohapposekvenssissä. Anfinsen jakoi Nobel-palkinnon vuonna 1972 kemia tälle löydökselle.
Kolmekymmentä vuotta myöhemmin tutkijat havaitsivat, että erikoistuneet solukoneet auttavat proteiineja laskostumaan. Mutta vallitseva näkemys oli, että niiden toiminta rajoittui auttamaan proteiineja suorittamaan spontaanin laskostumisensa suojaamalla niitä loukkuun jäämiseltä tai yhteensulautumiselta.
Eräs apukonetyyppi, jota kutsutaan chaperoniiniksi, sisältää tynnyrimäisen kammion, joka pitää proteiinit sisällään, kun ne taittuvat. TRIC sopii tähän kategoriaan.
TRiC-kammio on ainutlaatuinen siinä mielessä, että se koostuu kahdeksasta eri alayksiköstä, jotka muodostavat kaksi pinottua rengasta. Pitkä, laiha tubuliiniproteiinijuoste kuljettaa kammion aukkoon meduusan muotoisen apumolekyylin avulla. Sitten kammion kansi sulkeutuu ja taittaminen alkaa. Kun se on valmis, kansi avautuu ja valmis, taitettu tubuliini lähtee.
Koska tubuliini ei voi laskostaa ilman TRiC:tä, näytti siltä, että TRiC voi tehdä muutakin kuin passiivisesti auttaa tubuliinia laskostumaan spontaanisti. Mutta miten se tarkalleen ottaen toimii? Tämä uusi tutkimus vastaa tähän kysymykseen ja osoittaa, että ainakaan proteiineihin, kuten tubuliiniin, "spontaanien laskostumisen" käsite ei päde. Sen sijaan TRIC ohjaa suoraan laskostumisreittiä, joka johtaa oikein muotoiltuun proteiiniin.
Vaikka tekoälyn tai tekoälyn viimeaikaiset edistysaskeleet voivat ennustaa useimpien proteiinien valmiin, laskostetun rakenteen, Frydman sanoi, tekoäly ei osoita, kuinka proteiini saavuttaa oikean muotonsa. Tämä tieto on perustavanlaatuista laskostumisen hallinnassa solussa ja hoitojen kehittämisessä laskostumissairauksiin. Tämän tavoitteen saavuttamiseksi tutkijoiden on selvitettävä solussa tapahtuvan taittoprosessin yksityiskohtaiset vaiheet.
Solukkokammio ottaa vastuun
Kymmenen vuotta sitten Frydman, Chiu ja heidän tutkimusryhmänsä päättivät syventyä siihen, mitä TRIC-kammiossa tapahtuu.
"Verrattuna yksinkertaisempiin bakteerien kaperoniinien taittokammioihin, ihmisen solujen TRiC on erittäin mielenkiintoinen ja monimutkainen kone." Frydman sanoi. "Jokaisella sen kahdeksasta alayksiköstä on erilaiset ominaisuudet ja erillinen pinta kammion sisällä, ja tämä osoittautuu todella tärkeäksi."
Tutkijat havaitsivat, että tämän ainutlaatuisen kammion sisäpuoli ohjaa taittoprosessia kahdella tavalla.

(Yanyan Zhao / Stanfordin yliopisto)
Kun kammion kansi sulkeutuu proteiinin päälle, sen sisäseinille ilmestyy sähköstaattista varausta. Ne houkuttelevat tubuliiniproteiinisäikeen vastakkaisesti varautuneita osia ja kiinnittävät ne olennaisesti seinään luodakseen oikean muodon ja konfiguraation seuraavaa taittamisen vaihetta varten. Sillä välin TRIC-alayksikön "hännät", jotka riippuvat kammion seinästä, tarttuvat tubuliiniproteiiniin tiettyinä aikoina ja paikoissa ankkuroimaan ja vakauttamaan sen.
Aluksi tubuliininauhan toinen pää kiinnittyy seinässä olevaan pieneen taskuun ja taittuu. Sitten toinen pää kiinnittyy eri kohtaan, jolloin syntyy suuri silmukka. Silmukka taittuu siten, että se tuo sen heti ensimmäisen taitetun alueen viereen.
Kolmannessa vaiheessa osa keskiosasta taittuu muodostaen proteiinin ytimen sekä taskut, joihin GTP, molekyyli, joka varastoi ja vapauttaa energiaa solun työn tehostamiseksi, voi liittyä.
Lopuksi jäljellä oleva proteiiniosa taittuu. Tubuliinimolekyyli on nyt valmis toimintaan.
"Näitä rakenteellisia tilannekuvia taittosekvenssin välivaiheista ei ole koskaan ennen nähty kryoelektronimikroskoopilla." Frydman sanoi.
Tehokas sekoitus tekniikoita
Hänen tiiminsä vahvisti taittosekvenssin haastavilla biokemiallisilla ja biofysikaalisilla testeillä, jotka vaativat vuosien työtä.
Näiden tulosten tulkitseminen antoi tutkijoille mahdollisuuden rakentaa kuvan tubuliinin muuttuvasta muodosta, kun se taittuu TRiC-kammion sisällä, mikä vastasi kryo-EM:n luomia kuvia.
"On erittäin voimakasta pystyä liikkumaan edestakaisin näiden tekniikoiden välillä, koska silloin voit todella tietää, että näkemäsi heijastaa sitä, mitä solussa tapahtuu." Frydman sanoi.
"Tiede on yllättänyt meidät todella mielenkiintoisella ratkaisulla, jota en olisi osannut ennustaa."
Tutkimus tarjoaa myös vihjeitä sen ymmärtämiseen, kuinka tämä taittuva järjestelmä kehittyi eukaryoottisoluissa, jotka muodostavat kasveja, eläimiä ja ihmisiä, mutta ei yksinkertaisemmissa soluissa, kuten bakteerien ja arkkien soluissa. Kun proteiineista tuli yhä monimutkaisempia palvelemaan eukaryoottisten solujen tarpeita, tutkijat ehdottavat, että jossain vaiheessa ne eivät voineet taittua muotoihin, joita he tarvitsivat monimutkaisempien töiden suorittamiseen ilman pientä apua. Eukaryoottiproteiinit ja niiden kaperoniinikammio kehittyivät todennäköisesti yhdessä, mahdollisesti alkaen kaikkien eukaryoottisten organismien viimeisestä yhteisestä esi-isästä noin 2.7 miljardia vuotta sitten.
Analyysien monimutkaisuuden ja pandemian välivaiheen vuoksi tutkimus jatkui niin kauan, että monet sen parissa työskennelleet ovat siirtyneet muihin töihin. Heihin kuuluvat tutkijatohtori Daniel Gestaut ja Miranda Collier Frydmanin ryhmästä, jotka suorittivat projektin biokemiallisen osan ja työnsivät sitä eteenpäin, sekä Yanyan Zhao, Soung-Hun Roh, Boxue Ma ja Greg Pintilie Chiun ryhmästä, jotka suorittivat kryon. -EM-analyysit. Muita osallistujia olivat Junsun Park, Rohin ryhmän opiskelija, ja Alexander Leitner ETH:sta Zürichistä, Sveitsistä.
Työtä tukivat Korean kansallisen tutkimussäätiön ja Suh Kyungbae Foundationin (SUHF) apurahat Wah Chiulle ja Judith Frydmanille NIH:sta sekä apurahoista Soung-Hun Rohille, joka on nyt apulaisprofessori Soulin kansallisessa yliopistossa.
Lehden viite
- Daniel Gestaut et ai., Ihmisen chaperoniinin TRiC/CCT:n ohjaaman tubuliinin laskostumisreitin rakenteellinen visualisointi. Solu, 8. joulukuuta 2022 DOI: 10.1016 / j.cell.2022.11.014