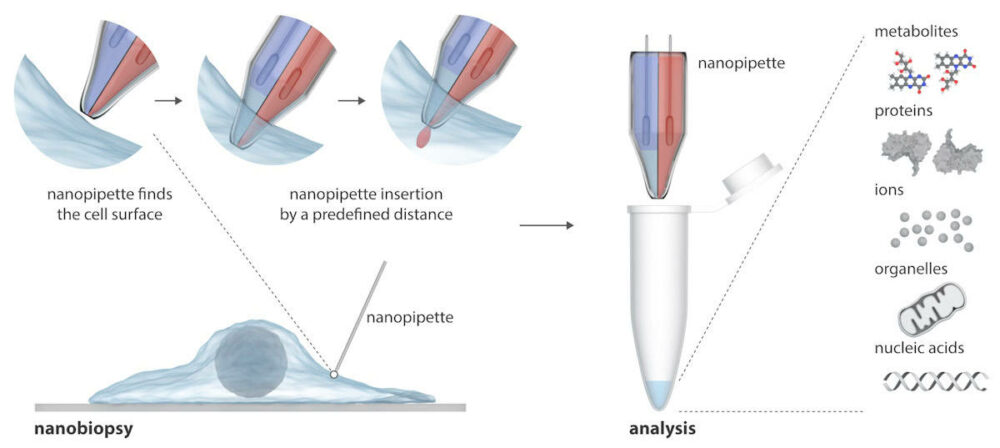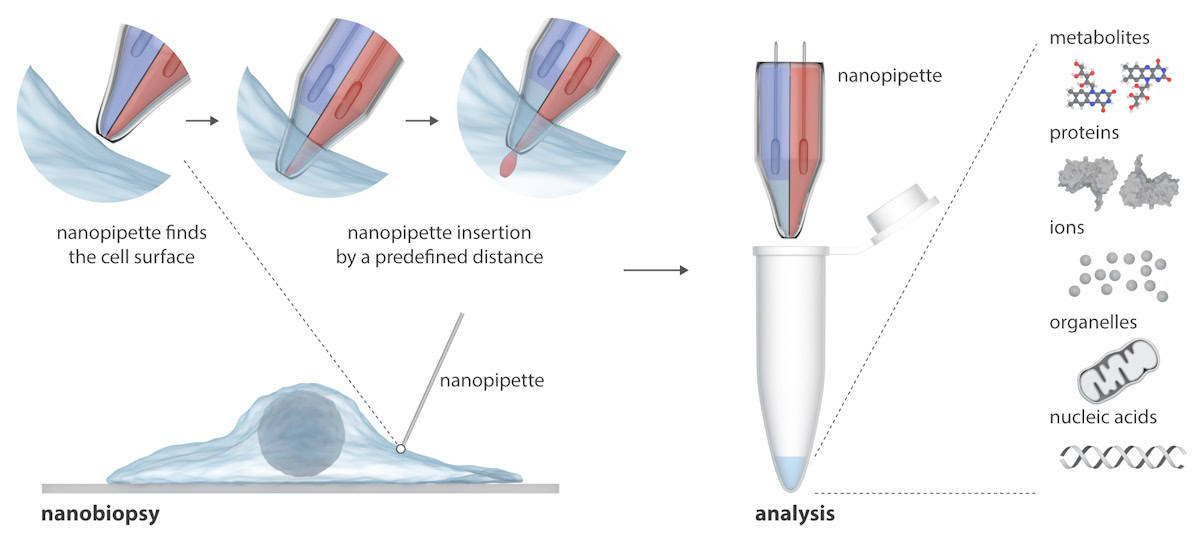
Le glioblastome (GBM) est la forme de cancer du cerveau la plus mortelle et la plus agressive. Presque toutes les tumeurs réapparaissent après le traitement, à mesure que les cellules survivantes se transforment en formes plus résilientes au fil du temps pour résister à d’autres traitements. Pour relever ce défi, les scientifiques du Université de Leeds ont conçu une nouvelle nanopipette à double corps et l'ont utilisée pour étudier les trajectoires des cellules vivantes individuelles du GBM à mesure qu'elles changent en réponse au traitement.
La nanopipette se compose de deux aiguilles nanoscopiques qui peuvent simultanément injecter des molécules exogènes dans une cellule et en extraire des échantillons de cytoplasme. La nanopipette est intégrée dans un microscope à conduction ionique à balayage (SICM) pour réaliser des nanobiopsies de cellules vivantes en culture. Contrairement aux techniques existantes d'étude de cellules individuelles, qui détruisent généralement la cellule, la nanopipette peut effectuer des biopsies répétées d'une cellule vivante sans la tuer, permettant ainsi des études longitudinales du comportement d'une cellule individuelle au fil du temps.
Ecrire dans Science Advances, les chercheurs expliquent que le SICM fonctionne en mesurant le courant ionique entre une électrode insérée dans une nanopipette en verre et une électrode de référence immergée dans une solution électrolytique contenant les cellules. La nanobiopsie est réalisée lorsqu'un courant ionique traverse le nanopore à l'extrémité de la nanopipette après avoir appliqué une tension entre les deux électrodes. Dans leur nanopipette à double corps, un corps agit comme une seringue électrochimique pour effectuer des extractions cytoplasmiques ; le second contient une solution électrolytique aqueuse qui fournit un courant ionique stable pour un positionnement précis et une nanoinjection avant la nanobiopsie.
La plateforme semi-automatique permet l’extraction de volumes femtolitres de cytoplasme et l’injection simultanée dans des cellules individuelles. La plate-forme permet un positionnement automatisé de la nanopipette à l'aide d'un contrôle par rétroaction (le courant ionique chute lorsque la nanopipette s'approche de l'échantillon), tandis que la détection de signatures de courant particulières indique une pénétration réussie de la membrane d'une seule cellule.
Études longitudinales
Pour prouver le concept de la capacité de la plateforme, les chercheurs ont réalisé une nanobiopsie longitudinale d'une cellule GBM (et de sa progéniture), profilant les changements d'expression génique sur 72 heures. Ils ont réalisé une nanobiopsie avant le traitement, pendant le traitement par radiothérapie et chimiothérapie et après le traitement.
« Notre méthode est robuste et reproductible, permettant la pénétration membranaire et la nanoinjection à travers différents types de cellules avec des propriétés mécaniques distinctes », écrivent les co-chercheurs principaux Lucy Stead ainsi que le Paolo Actis. « Le taux de réussite moyen de la nanoinjection est de 0.89 ± 0.07. L’ARNm intracellulaire est ensuite extrait.
Les chercheurs ont étudié la réponse des cellules GBM au traitement standard de 2 Gy de rayonnement et 30 µM de témozolomide. Ils ont suivi visuellement des cellules individuelles et leur progéniture pendant 72 heures, 98 % restant dans le champ de vision du microscope pendant cette période – un facteur important pour effectuer une analyse longitudinale.
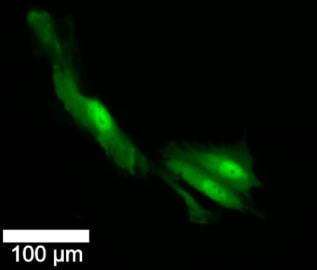
Le premier jour, les chercheurs ont biopsié, injecté un colorant fluorescent et photographié chaque cellule. Au jour 1, la moitié des cellules ont reçu une irradiation et une chimiothérapie, tandis que les autres ont servi de contrôle. Toutes les cellules ont été imagées aux jours 2 et 2, puis biopsiées et réinjectées au jour 3.
Dans les cellules ayant subi des nanobiopsies au premier jour, la survie était similaire entre les cellules traitées et non traitées, et les taux de division cellulaire étaient comparables dans les deux groupes. Après 1 h, 72 % des cellules témoins non traitées (non biopsiées) ont survécu, contre 63 % des cellules biopsiées traitées. Il n’y avait aucune différence dans les taux de mortalité ultérieure des sous-types cellulaires au jour 25, quel que soit le traitement. Cependant, une proportion beaucoup plus grande de cellules non traitées ont changé de sous-type au fil du temps ou ont produit une descendance avec un sous-type différent que les cellules traitées.
"Cela suggère que les cellules non traitées sont nettement plus plastiques sur une période de trois jours que les cellules traitées", écrivent les chercheurs. « Les scores phénotypiques cellulaires des échantillons appariés du jour 1 et longitudinaux ont révélé que les cellules traitées ont tendance à conserver le même phénotype pendant le traitement, tandis que les cellules non traitées sont plus susceptibles de changer d'état transcriptionnel sur 72 heures, ce qui suggère que le traitement induit ou sélectionne une stabilité transcriptionnelle élevée. dans cette lignée cellulaire GBM établie.
"Il s'agit d'une avancée majeure", déclare Stead. « C'est la première fois que nous disposons d'une technologie qui nous permet de réellement surveiller les changements qui se produisent après le traitement, plutôt que de simplement les supposer. Ce type de technologie va fournir un niveau de compréhension que nous n’avions tout simplement jamais eu auparavant. Et cette nouvelle compréhension et cette nouvelle compréhension mèneront à de nouvelles armes dans notre arsenal contre tous les types de cancer.
La nanochirurgie mécanique s'attaque au cancer agressif du cerveau
L’équipe est convaincue que la capacité de ces nanosondes polyvalentes à accéder à l’environnement intracellulaire avec un minimum de perturbations pourrait potentiellement « révolutionner les diagnostics moléculaires, les thérapies géniques et cellulaires ».
"Nos travaux futurs se concentreront sur l'augmentation du débit de la technologie afin que davantage de cellules puissent être analysées", explique Actis. Monde de la physique. « Nous travaillons à améliorer les protocoles d’analyse de l’ARN extrait des cellules afin de recueillir davantage d’informations biologiques. Nous sommes également très désireux d’étudier des modèles biologiques plus avancés de cancer du cerveau basés sur des cellules et des organoïdes dérivés de patients.
- Contenu propulsé par le référencement et distribution de relations publiques. Soyez amplifié aujourd'hui.
- PlatoData.Network Ai générative verticale. Autonomisez-vous. Accéder ici.
- PlatoAiStream. Intelligence Web3. Connaissance Amplifiée. Accéder ici.
- PlatonESG. Carbone, Technologie propre, Énergie, Environnement, Solaire, La gestion des déchets. Accéder ici.
- PlatoHealth. Veille biotechnologique et essais cliniques. Accéder ici.
- La source: https://physicsworld.com/a/single-cell-nanobiopsy-explores-how-brain-cancer-cells-adapt-to-resist-treatment/
- :est
- :ne pas
- :où
- 07
- 1
- 30
- 72
- 89
- a
- capacité
- AC
- accès
- à travers
- actes
- actually
- adapter
- propos
- Avancée
- Après
- après
- encore
- à opposer à
- agressif
- Visée
- Tous
- Permettre
- presque
- aussi
- an
- En cours d'analyse
- selon une analyse de l’Université de Princeton
- ainsi que le
- Application
- approches
- SONT
- AS
- assumer
- At
- Attaques
- Automatisation
- moyen
- basé
- BE
- before
- comportement
- jusqu'à XNUMX fois
- Cerveau
- cancer du cerveau
- percée
- by
- CAN
- Cancer
- Cellules cancéreuses
- cellule
- Cellules
- challenge
- Change
- Modifications
- cliquez
- comparable
- par rapport
- menée
- consiste
- contient
- des bactéries
- contrôles
- convaincu
- Cours
- Culture
- Courant
- journée
- Décès
- un
- détruire
- Détection
- diagnostic
- différence
- différent
- Perturber
- Perturbation
- distinct
- divisé
- Division
- Drops
- pendant
- teindre
- chacun
- non plus
- électrolyte
- permet
- permettant
- Environment
- établies
- existant
- Expliquer
- explore
- expression
- extrait
- extraction
- facteur
- Réactions
- Prénom
- première fois
- Flux
- Focus
- Pour
- Force
- formulaire
- document
- CADRE
- De
- plus
- avenir
- recueillies
- en verre.
- aller
- Groupes
- ait eu
- Half
- Vous avez
- Haute
- détient
- Comment
- Cependant
- HTTPS
- image
- satellite
- immergé
- important
- améliorer
- in
- croissant
- indique
- individuel
- induit
- infographique
- d'information
- injecter
- perspicacité
- des services
- développement
- enquêter
- Les enquêteurs ont
- indépendamment
- aide
- IT
- SES
- jpg
- juste
- Vif
- meurtre
- plus importantes
- couche
- conduire
- Probable
- Gamme
- vie
- maintenir
- largeur maximale
- mesure
- mécanique
- méthode
- Microscope
- minimal
- numériques jumeaux (digital twin models)
- moléculaire
- Surveiller
- PLUS
- (en fait, presque toutes)
- ARNm
- beaucoup
- nanopore
- n'allons jamais
- Nouveauté
- aucune
- roman
- of
- on
- ONE
- ouvert
- or
- Autres
- nos
- plus de
- apparié
- particulier
- voies
- pénétration
- Effectuer
- effectué
- Physique
- Monde de la physique
- Place
- Plastique
- plateforme
- Plateformes
- Platon
- Intelligence des données Platon
- PlatonDonnées
- positionnement
- Post
- défaillances
- précis
- Avant
- Produit
- profilage
- propriétés
- proportion
- protocoles
- fournir
- fournit
- Radiothérapie
- Tarif
- Tarifs
- plutôt
- reçu
- référence
- restant
- répété
- chercheurs
- résilient
- réponse
- Révélé
- ARN
- robuste
- même
- échantillon
- dit
- balayage
- Sciences
- scientifiques
- scores
- Deuxièmement
- sélectionne
- servi
- montrant
- Signatures
- significative
- de façon significative
- similaires
- simplement
- simultanément
- unique
- So
- sur mesure
- groupe de neurones
- Stabilité
- stable
- Standard
- Région
- structures
- études
- Étude
- Étudier
- ultérieur
- succès
- réussi
- Suggère
- survie
- Survécu
- Interrupteur
- commuté
- Prenez
- prise
- ciblage
- équipe
- technique
- techniques
- Technologie
- raconte
- Avoir tendance
- que
- qui
- Les
- leur
- Les
- puis
- thérapies
- thérapie
- Là.
- Ces
- l'ont
- this
- trois
- trois jours
- Avec
- débit
- thumbnail
- fiable
- pointe
- à
- Transformer
- traités
- traitement
- oui
- deux
- type
- types
- Uk
- compréhension
- a subi
- université
- contrairement à
- d'utiliser
- Usages
- en utilisant
- d'habitude
- polyvalente
- très
- visuellement
- Tension
- volumes
- était
- we
- Armes
- ont été
- quand
- qui
- tout en
- sera
- comprenant
- sans
- activités principales
- de travail
- vos contrats
- world
- écrire
- zéphyrnet