La radiothérapie des lésions mobiles est difficile. L'administration du rayonnement thérapeutique à un volume cible planifié peut être affectée par le mouvement des organes, tandis que les déformations anatomiques et les incertitudes de configuration peuvent entraîner des erreurs de ciblage. Si les radio-oncologues disposaient d'une carte de distribution de dose de rayonnement 3D précise et en temps réel, ils seraient en mesure de modifier le niveau ou la trajectoire du rayonnement en ligne pour obtenir des traitements plus efficaces et plus sûrs.
L'imagerie acoustique par rayonnement ionisant (iRAI) est une technologie non invasive qui pourrait fournir cette capacité. En reconstruisant la dose de rayonnement à l'aide d'ondes acoustiques, iRAI peut cartographier le dépôt de dose dans les tumeurs et les tissus sains adjacents et surveiller l'accumulation de dose en temps réel pendant la radiothérapie, sans avoir besoin d'utiliser des sources de rayonnement supplémentaires.
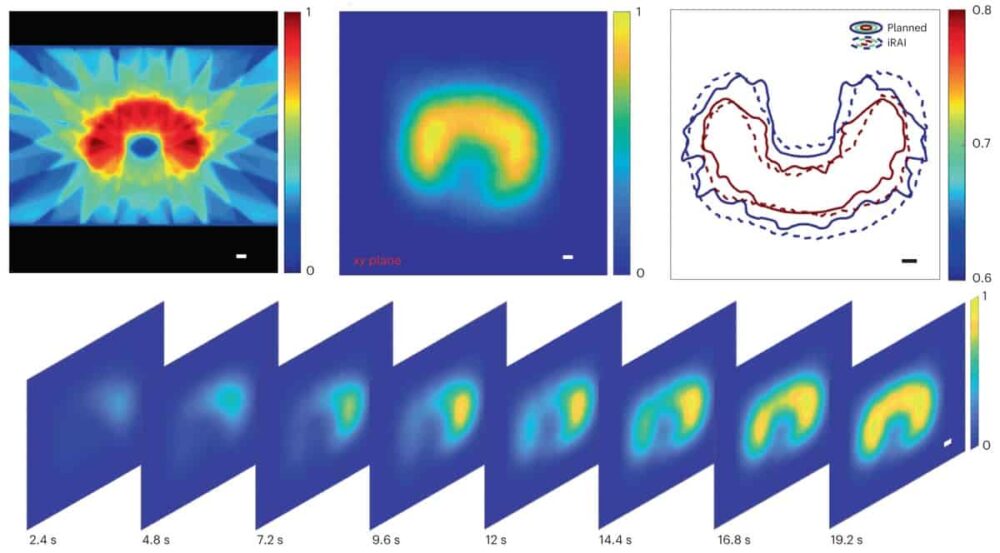
Une équipe de recherche multispécialisée au Université du Michigan ainsi que le Centre du cancer Moffitt a maintenant développé un système d'imagerie volumétrique iRAI de qualité clinique. Le système, décrit dans Nature Biotechnology, ont réalisé une cartographie semi-quantitative 3D de la délivrance d'un faisceau de rayons X profondément dans le corps pendant la radiothérapie d'un patient présentant des métastases hépatiques.
La technique iRAI fonctionne par effet thermoacoustique. Lorsqu'un faisceau de photons pulsés à haute énergie généré par un accélérateur linéaire frappe les tissus corporels, il est absorbé. Cette énergie absorbée se transforme en chaleur, ce qui provoque une dilatation thermique localisée et génère des ondes acoustiques. Ces ondes sont cependant faibles et généralement indétectables par la technologie des ultrasons cliniques.
Le nouveau système iRAI détecte les signaux acoustiques à l'aide d'un transducteur matriciel 2D conçu sur mesure et d'une carte de préamplificateur multicanal assortie, pilotée par un système d'échographie de recherche commercial. Le signal amplifié est ensuite transféré dans un appareil à ultrasons pour construire des images dose-dépendantes en temps réel.
Les chercheurs expliquent que leur système à double modalité, qui combine l'iRAI avec l'imagerie par ultrasons, offre "une solution prometteuse pour résoudre le besoin de surveillance en temps réel de la position du faisceau et d'évaluation en ligne de la dose délivrée pendant la radiothérapie". L'image échographique présente les structures tissulaires morphologiques et le mouvement dans le corps, ainsi que des informations fonctionnelles telles que le flux sanguin et la densité vasculaire, tandis que l'image iRAI peut cartographier et quantifier le dépôt de dose distribué dans l'espace dans différents tissus biologiques.
"Cet essai clinique était une étude pilote visant à évaluer la faisabilité de l'utilisation d'iRAI chez des patients recevant une radiothérapie corporelle stéréotaxique abdominale (SBRT)", explique le chercheur principal clinique Kyle Cuneo du Rogel Cancer Center du Michigan. "Ses résultats nous permettent d'optimiser le système iRAI."
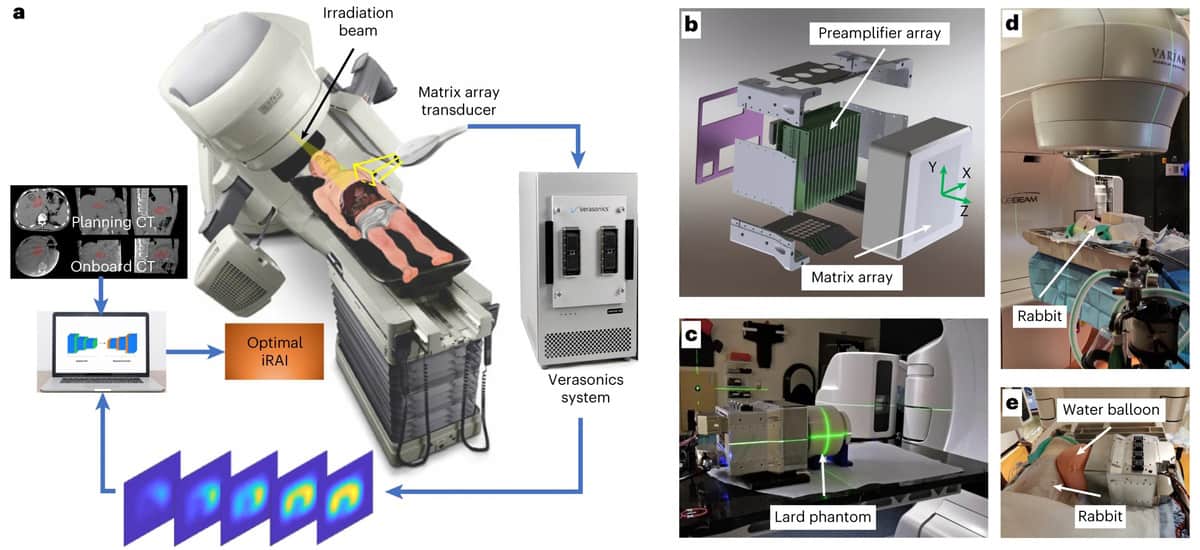
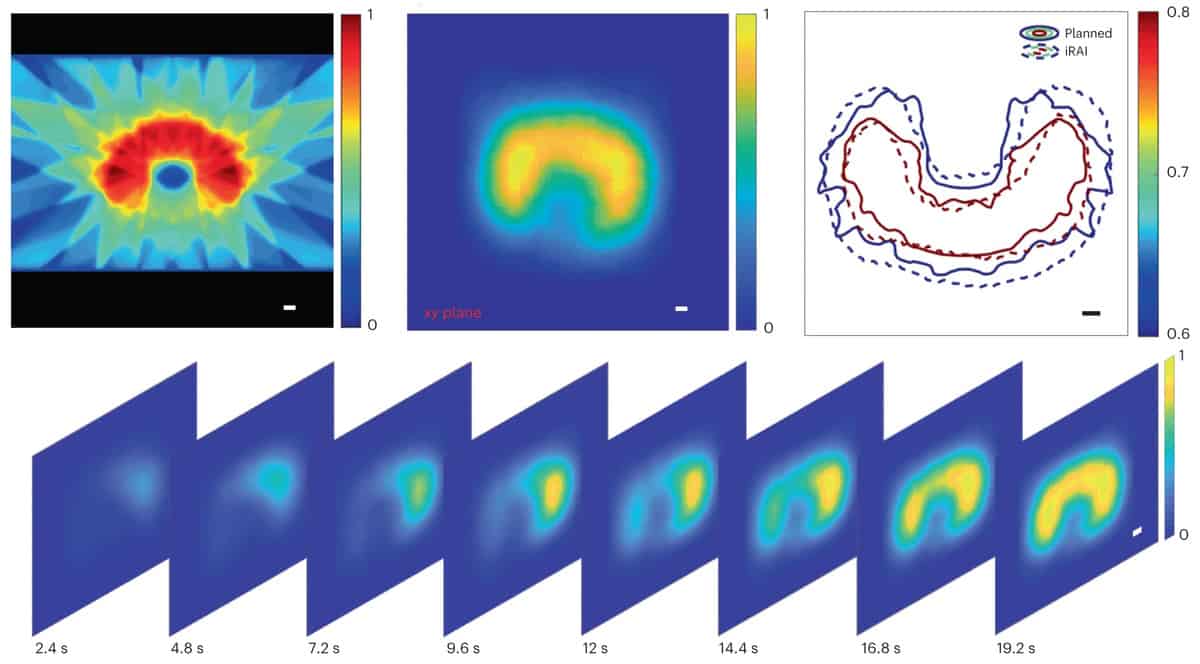
Pour leur étude de preuve de concept, les chercheurs ont validé le système dans un fantôme cylindrique de saindoux, un lapin puis un patient subissant une SBRT abdominale. Pour améliorer le rapport signal sur bruit (SNR) lors de la détection de signaux acoustiques de rayonnement, ils ont sélectionné une fréquence centrale de 0.35 MHz pour correspondre au spectre de puissance des signaux acoustiques générés par l'impulsion de rayons X de 4 µs. Le SNR a été encore amélioré par le préamplificateur à 1024 canaux avec un gain de 46 dB intégré au réseau matriciel 2D et en affichant les images iRAI avec une moyenne de 25 fois.
Après avoir vérifié les performances du système à l'aide du fantôme, l'équipe a créé et testé un plan de traitement clinique pour irradier le foie d'un lapin. Les mesures iRAI ont montré une grande cohérence entre la distribution de dose mesurée et celle générée par le système de planification de traitement.
L'équipe a ensuite préparé des plans de radiothérapie pour le participant à l'étude, avec le plan de traitement pour chaque fraction divisé en deux parties. La première partie était destinée à l'imagerie iRAI et comprenait des faisceaux de 2.087 et 0.877 Gy délivrés respectivement dans les directions antérieure supérieure et inférieure. Cela a été suivi d'un plan d'arcthérapie à modulation volumétrique (sans imagerie iRAI) pour s'assurer que la dose totale de rayonnement délivrée répondait aux exigences cliniques.
Les emplacements des doses et les distributions globales des mesures iRAI correspondaient bien au plan de traitement. L'imagerie volumétrique iRAI a pu cartographier la zone à forte dose avec une grande précision. Les chercheurs notent qu'ils doivent optimiser la précision de la cartographie pour les zones à faible intensité de dose, améliorer la résolution spatiale et développer un protocole d'étalonnage complet pour fournir une mesure de dose absolue, en utilisant des techniques de reconstruction avancées exploitant l'intelligence artificielle.
Subvention chercheur principal Issam El Naqa du Moffitt Cancer Center indique que le système actuel sera complété par une imagerie par ultrasons en temps réel et sera également évalué dans le contexte de scénarios d'accouchement à haut risque tels que la radiothérapie FLASH.
L'imagerie acoustique promet une mesure de dose en temps réel pour la radiothérapie FLASH
« Une application potentielle de cette technologie à l'avenir est la prestation de traitement adaptatif en temps réel. Les techniques de traitement adaptatif actuelles reposent principalement sur des modifications anatomiques de la tumeur et des organes à risque (OAR) », explique Cuneo. « Avec iRAI, nous pouvons utiliser à la fois des informations anatomiques et, plus important encore, des informations dosimétriques pour adapter le plan de radiothérapie. Cela pourrait permettre une augmentation de la dose dans la cible, en particulier dans les situations où il y a un OAR adjacent, et fournir des traitements plus sûrs en quantifiant avec précision la dose réelle délivrée à la cible et aux OAR au cours de chaque fraction.
"Le système a la capacité unique de visualiser le dépôt de rayonnement tout en surveillant le mouvement des organes, permettant une meilleure localisation du rayonnement sur les tumeurs ciblées tout en épargnant les tissus non impliqués de manière économique", ajoute El Naqa. "Cela peut être appliqué de la même manière dans les pays développés et en développement où les ressources financières sont rares, ce qui conduit à une amélioration des soins aux patients et à de meilleurs résultats dans ces endroits."
- Contenu propulsé par le référencement et distribution de relations publiques. Soyez amplifié aujourd'hui.
- Platoblockchain. Intelligence métaverse Web3. Connaissance Amplifiée. Accéder ici.
- La source: https://physicsworld.com/a/dose-tracking-during-radiotherapy-could-enable-safer-cancer-treatments/
- 10
- 2D
- 3d
- a
- Capable
- Absolute
- accélérateur
- accumulation
- précision
- Avec cette connaissance vient le pouvoir de prendre
- avec précision
- atteindre
- atteint
- adapter
- Supplémentaire
- Ajoute
- Avancée
- contrat
- Permettre
- ainsi que le
- Application
- appliqué
- Arc
- Réservé
- domaines
- tableau
- artificiel
- intelligence artificielle
- Évaluation de risque climatique
- augmentée
- moyenne
- basé
- Faisceau
- Améliorée
- jusqu'à XNUMX fois
- sang
- Bleu
- planche
- corps
- Bas et Leggings
- CAD
- Cancer
- les soins
- Causes
- les causes
- Canaux centraux
- central
- difficile
- Modifications
- Infos sur les
- moissonneuses-batteuses
- commercial
- complet
- Composé
- construire
- contexte
- Prix
- pourriez
- d'exportation
- créée
- Courant
- profond
- livré
- livrer
- page de livraison.
- décrit
- développer
- développé
- développement
- Pays en voie de développement
- dispositif
- différent
- distribué
- distribution
- distributions
- divisé
- entraîné
- pendant
- chacun
- effet
- Efficace
- permettre
- permettant
- énergie
- améliorée
- assurer
- également
- Erreurs
- escalade
- notamment
- évalué
- avec des données
- Expliquer
- Explique
- la traduction de documents financiers
- Prénom
- Flash
- flux
- suivi
- fraction
- La fréquence
- De
- fonctionnel
- plus
- avenir
- Gain
- généré
- génère
- Bien
- grade
- la santé
- Haute
- risque élevé
- Cependant
- HTTPS
- image
- satellite
- Imagerie
- impact
- améliorer
- amélioré
- in
- d'information
- des services
- Intelligence
- aide
- IT
- conduisant
- Niveau
- lignes
- Foie
- emplacements
- manière
- Localisation
- cartographie
- Match
- appariés
- assorti
- Matrice
- largeur maximale
- des mesures
- Surveiller
- Stack monitoring
- PLUS
- mouvement
- en mouvement
- Nature
- Besoin
- Nouveauté
- Offres Speciales
- en ligne
- ouvert
- Optimiser
- global
- partie
- les pièces
- patientforward
- patients
- performant
- fantôme
- pilote
- Des endroits
- plan
- prévu
- et la planification de votre patrimoine
- plans
- Platon
- Intelligence des données Platon
- PlatonDonnées
- position
- défaillances
- power
- préparé
- cadeaux
- Directeur
- promet
- prometteur
- protocole
- fournir
- impulsion
- Lapin
- Radiothérapie
- rapport
- réal
- en temps réel
- recevoir
- Exigences
- un article
- chercheurs
- Résolution
- Resources
- RANGÉE
- plus sûre
- économie
- Rare
- scénarios
- choisi
- Signal
- signaux
- situations
- sur mesure
- RÉSOUDRE
- Sources
- Spatial
- Spectre
- Grèves
- études
- Étude
- tel
- haut
- combustion propre
- Target
- des campagnes marketing ciblées,
- ciblage
- équipe
- techniques
- Technologie
- La
- leur
- thermique
- thumbnail
- fiable
- fois
- à
- top
- Total
- Tracking
- trajectoire
- transféré
- transferts
- traitement
- procès
- oui
- incertitudes
- expérience unique et authentique
- us
- utilisé
- d'habitude
- validé
- vérifier
- via
- Voir
- le volume
- vagues
- qui
- tout en
- sera
- sans
- vos contrats
- pourra
- radiographie
- zéphyrnet