Bevezetés
Áprilisban kínai kutatók arról számoltak be, hogy majmoknál olyan eljárással kezdték meg a terhességet, amely látszólag az in vitro megtermékenyítéshez (IVF) hasonlít, amelynek során egy edényben létrehozott embriókat ültettek be cynomolgus majmok méhébe. Úgy tűnt, ebben semmi figyelemre méltó – kivéve, hogy ez nem valódi IVF, mert az embriókat nem megtermékenyítéssel hozták létre. A semmiből, majom embrionális őssejtekből hozták létre, petesejt vagy sperma nélkül. Egyáltalán nem valódi embriók voltak, hanem azok, amelyeket sok kutató embriómodelleknek (vagy néha „szintetikus embrióknak”) nevez.
A több intézményből álló kutatócsoport, vezetésével Zhen Lu a sanghaji State Key Laboratory of Neuroscience-ben, növesztette az embriómodelleket in vitro egy nagyjából kilenc napos fejlődési szakaszig, így egyenértékűek a normál embriók blasztocisztájával. Ezután nyolc nőstény majomba helyezték át a modelleket. A majmok közül háromnál a modellek sikeresen beültettek a méhbe, és tovább fejlődtek. Egyik terhesség sem tartott azonban néhány napnál tovább, mielőtt spontán megszakadt volna.
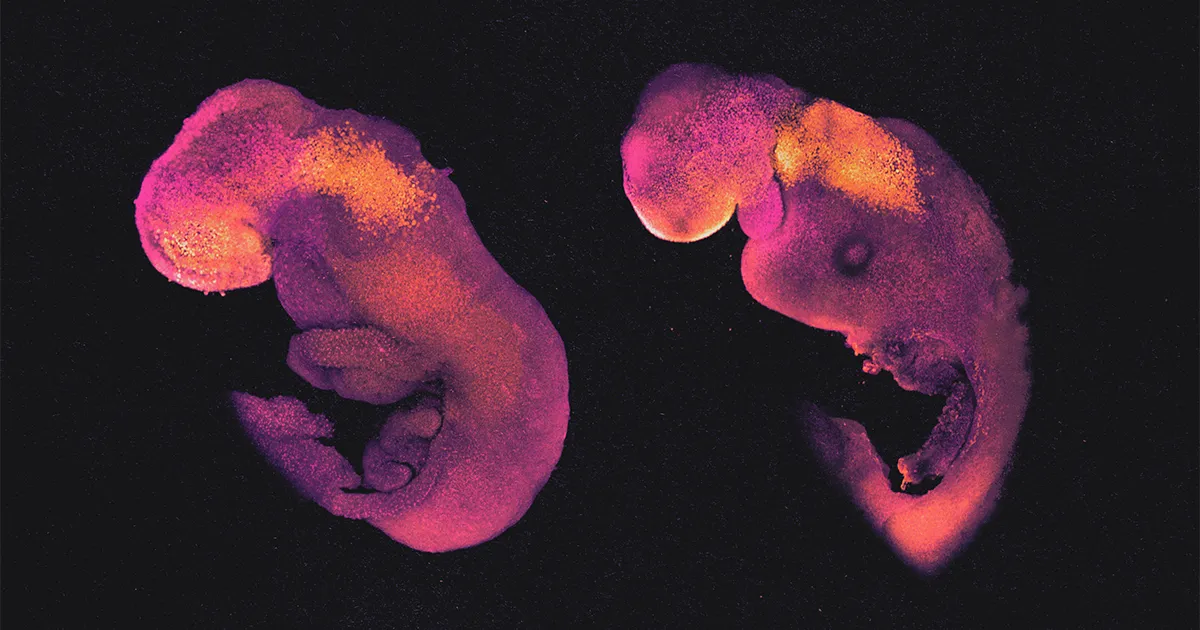
Eközben más kutatócsoportok tavaly kimutatták, hogy ezek az őssejtekből készült embriómodellek milyen messzire képesek fejlődni a teljes organizmusok felé. Csapatok vezetésével Magdalena Zernicka-Goetz a Cambridge-i Egyetemen és általa Jacob Hanna az izraeli Rehovotban található Weizmann Tudományos Intézetben egér őssejtekből készítették őket, és tápanyagokkal teli forgó üvegpalackokban növesztették őket, amelyek egyfajta nyers mesterséges méhként működtek. Körülbelül nyolc nap elteltével sikerült meghatározni azt a központi tengelyt, amely egy normál embrióban gerincoszlop lesz, a születőben lévő fej hagymás foltjával és még egy primitív dobogó szívvel együtt. Szakértőnek kell lennie ahhoz, hogy meg tudja különböztetni ezeket az élőlényeket a hasonló fejlődési szakaszban lévő valódi egérembrióktól.
Senki sem tudja teljesen biztosan, hogy mik az embriómodellek – biológiailag, etikailag vagy jogilag –, vagy hogy végül mivé válhatnak. Rendkívül hasznosak lehetnek a kutatáshoz, feltárják fejlődési folyamataink olyan aspektusait, amelyek korábban a kísérletek számára elérhetetlenek voltak. Egy napon akár szövetek és miniatűr szervek biztosítására is felhasználhatják őket sebészeti átültetéshez. De mély etikai és filozófiai kérdéseket is felvetnek.
Bevezetés
Egészen a közelmúltig az embriómodellek csak vázlatosan hasonlítottak a valódi embriókra, majd csak a növekedés legkorábbi szakaszában. De Zernicka-Goetz, Hanna és mások legújabb kísérletei, köztük a sanghaji beültetési kísérletek, most arra kényszerítenek bennünket, hogy elgondolkodjunk, mennyire és milyen mértékben képesek ezek az entitások újra előidézni a természetes embriók növekedését. Még ha ez jelenleg egy távoli hipotetikus kilátás, egyes kutatók nem látnak okot arra, hogy az embriómodellek miért ne képesek lennének végül egészen babává fejlődni.
Nincs egyértelmű tudományos vagy orvosi indok, amely megengedné nekik, hogy ezt megtegyék, és rengeteg etikai és jogi ok, amiért nem. De még kísérleti eszközként való felhasználásuk is sürgető kérdéseket vet fel szabályozásukkal kapcsolatban. Meddig kell hagyni, hogy az embriómodellek fejlődjenek, mielőtt leállítjuk a munkát? Jelenleg nincs egyértelmű szabályozás, amely korlátozná létrehozásukat, és nincs konszenzus arról, hogyan nézzenek ki az új szabályozások. Bármennyire is ígéretesek az embriómodellek, aggodalmakat vetnek fel azzal kapcsolatban, hogy a kutatás megelőzi azon képességünket, hogy eldönthessük az etikai korlátokat.
„Az embriómodellek azt az ígéretet vagy fenyegetést rejtik magukban, hogy nem csupán egy reális modellt hoznak létre a fontos emberi szervek egyes részeinek fejlődéséről, hanem az összes emberi szerv és szövet reális modelljéhez vezetnek.” Hank Greely, jogász professzor és a Stanford Egyetem Orvosbiológiai Etikai Központjának irányítóbizottságának elnöke – „és potenciálisan új babák létrehozásával”.
Az etikai aggályokon túl azonban az embriómodellek kérdéseket vetnek fel a személyiség meghatározásával kapcsolatban, és hogy mi számít embernek. Megkérdőjelezik, hogyan gondolkodunk arról, amilyenek vagyunk.
Bevezetés
A 14 napos szabály újragondolása
A tankönyvek magabiztosan írják le, hogyan fejlődik a megtermékenyített emberi petesejt egyenletes sejtgömbből egy garnélarák alakú beültetett embrióvá, és válik felismerhetően emberi magzattá. De zavaróan keveset tudunk erről a folyamatról, mert egyes részleteit nem lehet az anyaméhben tanulmányozni az embrió biztonságának veszélyeztetése nélkül. Számos országban törvényes, hogy az emberi embriókat in vitro csak 14 napig neveljék és tanulmányozzák, majd le kell állítani.
Ez a két hét az, amikor bekövetkezik a fejlődés egyik legfontosabb szakasza, az úgynevezett gasztruláció. Mint a fejlődésbiológus Lewis Wolpert úgy fogalmazz: „Nem a születés, a házasság vagy a halál, hanem a gasztruláció az, ami valóban a legfontosabb időszak az életedben.” Ekkor az embrionális sejtek meglehetősen jellegtelen foltja hajtogatni és átrendeződik, hogy megkapja a testfelépítés első jeleit. A sejtek elkezdenek specializálódni azokra a szövetekre, amelyek idegeket, belső szerveket, beleket és egyebeket alkotnak. A primitív csíknak nevezett központi barázda a gerincoszlop előfutáraként alakul ki, amely meghatározza a születőben lévő test központi kétoldali szimmetriatengelyét.
1990-ben, az Egyesült Államok Egészségügyi, Oktatási és Jóléti Minisztériumának és az Egyesült Királyság Warnock-bizottságának évekkel korábbi jelentéseit követően, sok ország úgy döntött, hogy a primitív csík 14 napos kialakulása szabja meg a határt az emberi embriók in vitro fennmaradásának időtartamára. . Ezt a 14 napos szabályt később ben vezették be az iránymutatásokat az Nemzetközi Őssejtkutató Társaság, amelyeket világszerte széles körben követnek a tudósok. Évtizedekig ez kényelmes korlátozás volt, mivel az emberi embriók in vitro növekedése általában már öt-hat nap elteltével leállt, körülbelül abban a szakaszban, amikor normálisan beültetnek a méhnyálkahártyába.
2016-ban azonban Zernicka-Goetz cambridge-i csapata és a fejlődésbiológus Ali Brivanlou a Rockefeller Egyetemen és kollégái is megmutatták, hogy képesek rá IVF egérembriókat termeszteni egészen egészen a gasztrulációs szakaszig, lágy polimer gél mátrixot használva egyfajta méhhelyettesítőként.
Továbbá Hanna és munkatársai 2021-ben megmutatták, hogy képesek természetes egérembriókat termeszteni in vitro messze túl van a gasztruláción. Forgó bioreaktorukkal, amelyben az embriókat tápoldatban és pontosan szabályozott oxigén- és szén-dioxid-szinttel rendelkező atmoszférában tartották, a csapat 12 napig, az egerek teljes vemhességi időszakának felében egérembriókat növesztett. Hanna úgy gondolja, hogy a technológia emberi embriókkal is működhet, és talán hosszú hétig meg tudná termeszteni őket – ha a tudomány céljai felelősségteljesen indokolják a projektet, és a törvény nem tiltja.
A Nemzetközi Őssejtkutató Társaság 2021-ben felülvizsgálta irányelveit, felismerve az új lehetőségeket az emberi embriók posztgastruláció utáni fejlődésével kapcsolatos hasznos információk megszerzésében. eseti alapon, ha tudományosan megalapozható a kiterjesztése. Még egyetlen ország sem módosította törvényeit, hogy kihasználja ezt a szélességi kört.
Bevezetés
Az embriómodellek lehetőséget kínálhatnak arra, hogy ezen az úton haladjunk, még kevesebb jogi és etikai korlátozás mellett. Jogilag nem tekintik őket embrióknak, mert nem képesek életképes organizmusokká növekedni. Tehát még a jelenlegi irányelvek és szabályozások szerint is sok országban, ha az embriómodellek gasztrulációval és azon túl is nevelhetők, első alkalommal válhat legálissá az emberi fejlődés kísérleti tanulmányozása, és talán a vetélést vagy deformitást okozó hibák jobb megértéséhez vezethet.
De ha az embriómodellek valóban ilyen messzire nőhetnek, mikor szűnnek meg modellek lenni, és válnak egyenértékűvé az igazival? Minél jobbak és messzebbre kerülnek a modellek, annál elmosódnak a biológiai és etikai határok.
Ez a dilemma hipotetikus volt, amikor az embriómodellek csak a fejlődés legkorábbi szakaszait tudták összefoglalni. Már nem az.
Őssejtek embrióvá alakítása
Az embriómodellek általában embrionális őssejtekből, a korai embriókból származó „pluripotens” sejtekből készülnek, amelyek a test minden szövettípusává fejlődhetnek. Mire az embrió eléri a blasztocisztás stádiumot – az emberi fejlődés 5. vagy 6. napja körül – több sejttípusból áll. Üreges héja olyan sejtekből áll, amelyek alkotják a méhlepényt (úgynevezett trofoblaszt őssejtek vagy TSC-k) és a tojássárgája zsákot (az extraembrionális endoderma vagy XEN-sejtek). A magzattá váló pluripotens sejtek a blasztociszta falának belsejében lévő foltra korlátozódnak, és ezekből lehet embrionális őssejteket tenyészteni.
Az 1990-es években és a 2000-es évek elején végzett kísérletek kimutatták, hogy az egyik blasztocisztából kivont és egy másikba átvitt embrionális őssejtek még mindig olyan embrióvá válhatnak, amely egészen a teljes születésig egészséges állatként képes fejlődni. De a TSC-k és XEN-sejtek támogatása elengedhetetlen – az embrionális őssejtek önmagukban nem tudnak túljutni a fejlődés első néhány napján, hacsak nem blasztocisztában vannak.
Az újabb kutatások azonban azt mutatják, hogy az adott sejttípusból a semmiből embriószerű struktúrák készíthetők. 2018-ban Zernicka-Goetz és munkatársai kimutatták, hogy az egerekből származó embrionális őssejtek, TSC-k és XEN-sejtek együttesei képesek önszerveződni egy földimogyoró-héj alakú üreges formává, amely megjelenésében egy gasztruláción áteső normál embrióhoz hasonlítható. A gasztruláció előrehaladtával az embrionális őssejtek egy része a belső szervek fejlődésének előzményeként specializálódottabbá és mozgékonyabbá vált.
De ezek a korai embriómodellek hibásak voltak, mondta Zernicka-Goetz, mert a hozzáadott XEN-sejtek túl késői fejlődési stádiumban voltak ahhoz, hogy teljes mértékben betölthessék szerepüket. A probléma megoldására 2021-ben csoportja megtalálta a módját, hogy az embrionális őssejteket korai stádiumú XEN-sejtekké alakítsa. „Amikor [embrionális őssejteket], TSC-ket és ezeket az indukált XEN sejteket egymás mellé helyeztük, most megfelelően gasztrulálni és beindítja a szervek fejlődését” – mondta.
Tavaly nyáron ben TermészetZernicka-Goetz és munkatársai leírták, hogyan használtak egy forgó palackkeltetőt meghosszabbítja a növekedést egérembrió-modelljeikből újabb döntő 24 órával, a 8.5. Aztán a modellek „az agy minden régióját, dobogó szíveket és így tovább” alkották meg – mondta. A törzsükön olyan szegmensek látszottak, amelyek a test különböző részeivé fejlődtek. Volt egy idegcsőjük, egy béljük, valamint a petesejt- és hímivarsejtek elődjei.
Egy második cikkben, amely nagyjából ugyanebben az időben jelent meg Sejt Őssejtcsoportja embrionális őssejteket indukált hogy TSC-kké váljanak valamint XEN cellák. Azok az embriómodellek, amelyeket a forgó inkubátorban tenyésztettek, ugyanilyen előrehaladott állapotba fejlődtek.
Eközben Hanna csapata Izraelben egérembrió-modelleket növesztett hasonló módon, ahogy azt egy papír be Sejt amely röviddel Zernicka-Goetz csoportjának cikke előtt jelent meg. Hanna modelljei is kizárólag embrionális őssejtekből készültek, amelyek közül néhányat genetikailag koaxáltak, hogy TSC- és XEN-sejtekké váljanak. "A teljes szintetikus szervvel teli embrió, beleértve az extra embrionális membránokat is, mind létrehozható, ha csak naiv, pluripotens őssejtekből indulunk ki" - mondta Hanna.
Hanna embriómodelljei, akárcsak a Zernicka-Goetz által készített modellek, átmentek a várható korai fejlődési szakaszokon. 8.5 nap után nyers testalkatúak voltak, fejjel, végtagbimbókkal, szívvel és egyéb szervekkel. Testüket köldökzsinórszerűen egy sejtoszlop erősítette a TSC-kből álló pszeudoplacentához.
"Ezek az embriómodellek nagyon jól összefoglalják a természetes embriogenezist" - mondta Zernicka-Goetz. A fő különbségek a méhlepény helytelen kialakulásának következményei lehetnek, mivel nem tud érintkezni a méhtel. A hibás placentából érkező tökéletlen jelek gátolhatják egyes embrionális szöveti struktúrák egészséges növekedését.
A méhlepény jobb helyettesítője nélkül „meglátjuk, mennyivel fejlődnek tovább ezek a struktúrák” – mondta. Éppen ezért úgy gondolja, hogy a következő nagy kihívás az lesz, hogy az embriómodelleket olyan fejlődési szakaszon vigyék át, amely normális esetben placentát igényel, mint az anya és a magzat keringő vérrendszerének interfészét. Még senki sem talált módot erre in vitro, de azt mondja, hogy csoportja dolgozik ezen.
Hanna elismerte, hogy meglepődött azon, hogy az embriómodellek milyen jól fejlődtek a gasztruláción túl is. Hozzátette azonban, hogy miután 12 évig dolgozol ezen, "minden mérföldkőnél izgatott és meglepődsz, de egy-két nap alatt megszokod, természetesnek veszi, és a következő célra koncentrálsz."
Jun Wu, a dallasi Texasi Egyetem Délnyugati Orvosi Központjának őssejtbiológusa is meglepődött azon, hogy a kizárólag embrionális őssejtekből készült embriómodellek idáig eljuthatnak. "Az a tény, hogy képesek embriószerű struktúrákat kialakítani, egyértelmű korai organogenezissel, arra utal, hogy látszólag működőképes szöveteket nyerhetünk ex utero, tisztán őssejtek alapján" - mondta.
Egy további ráncban kiderül, hogy az embriómodelleket nem kell szó szerint embrionális őssejtekből növeszteni – vagyis tényleges embriókból gyűjtött őssejtekből. Tőled vagy tőlem vett érett sejtekből is növeszthetők, és visszafejlődhetnek őssejtszerű állapotba. Az érett sejttípusok ilyen „fiatalításának” lehetősége volt a forradalmi felfedezés Shinya Yamanaka japán biológus, amely részesedést nyert neki a 2012-as Nobel-díj az élettanban vagy az orvostudományban. Az ilyen átprogramozott sejteket indukált pluripotens őssejteknek nevezik, és úgy állítják elő, hogy érett sejtekbe (például bőrsejtekbe) fecskendeznek be néhány, az embrionális őssejtekben aktív kulcsgént.
Eddig úgy tűnik, hogy az indukált pluripotens őssejtek szinte bármire képesek, amire a valódi embrionális őssejtek képesek, beleértve az embriószerű struktúrák in vitro növekedését. És úgy tűnik, hogy ez a siker megszakítja az utolsó lényeges kapcsolatot az embriómodellek és a valódi embriók között: nincs szükség embrióra a létrehozásukhoz, ami nagyrészt kívül esik a meglévő szabályozásokon.
Növekvő szervek a laborban
Még ha az embriómodellek példátlan hasonlóságot mutatnak is a valódi embriókkal, még mindig sok hiányosságuk van. Nicolas Rivron, a bécsi Molekuláris Biotechnológiai Intézet őssejtbiológusa és embriológusa, valamint Zernicka-Goetz egyik munkatársa elismeri, hogy „az embriómodellek kezdetlegesek, tökéletlenek, nem hatékonyak, és nem képesek élő szervezetet létrehozni”.
A növekvő embriómodellek meghibásodási aránya nagyon magas: a kezdeti sejtcsoportok kevesebb mint 1%-a jut el nagyon messzire. A finom rendellenességek, amelyek többnyire aránytalan szervméretekkel járnak, gyakran elnyomják őket – mondta Hanna. Wu úgy véli, hogy több munkára van szükség ahhoz, hogy megértsük mind a normál embriókkal való hasonlóságokat, mind pedig azokat a különbségeket, amelyek magyarázatot adhatnak arra, hogy az egérembriómodellek miért nem tudtak 8.5 napon túl növekedni.
Ennek ellenére Hanna bízik abban, hogy ezt a határt a kultúreszköz fejlesztésével meg tudják majd hosszabbítani. „Jelenleg a 13.5. napig tudunk méhen kívüli [IVF] egérembriókat nevelni – az emberi embriók megfelelője az 50-60. nap körül lesz” – mondta. "A rendszerünk kinyitja az ajtót."
Hozzátette: "Amikor az emberi fejlődés korai tanulmányozásáról van szó, úgy gondolom, hogy ez az egyetlen lehetséges út."
Marta Shahbazi, egy cambridge-i sejtbiológus, aki az embriogenezissel foglalkozik, egyetért. "Emberek számára egy ekvivalens rendszer [egér embriómodellekkel] valóban hasznos lenne, mert nincs in vivo alternatívánk a gasztruláció és a korai organogenezis tanulmányozására" - mondta.
Bevezetés
Hogy ezt meg lehet-e tenni az emberi sejtekkel, az majd kiderül. „Még mindig lábadozunk a sokkból, hogy egereken is meg lehet csinálni” – mondta Hanna. De mind ő, mind Zernicka-Goetz azt nyilatkozták, hogy biztatásra találtak azok az eredmények, amelyeket már saját laboratóriumaikban láttak emberi őssejtekből kinőtt korai embriómodellekkel. „Ez csak a kezdete egy hosszú tanulási és felfedezési útnak” – mondta Hanna.
Elméletileg a fejlett emberi embriómodellek a transzplantáció és a kutatás szerveinek forrásaivá válhatnak. "Bár az általunk készített szintetikus embriók megkülönböztethetők a természetes embrióktól" - mondta Hanna -, még mindig minden szervük megvan, és a megfelelő helyzetben vannak.
Az embrionális és indukált pluripotens őssejtek in vitro jelenleg arra irányíthatók, hogy kezdetleges miniatűr szervekké (vagyorganoidok”) hasnyálmirigy-, vese- és akár agyszövet. Az organoidok azonban jellemzően nem képesek pontosan reprodukálni a valódi szervek szerkezetét, valószínűleg azért, mert hiányoznak belőlük az alapvető jelek és a többsejtű komponensek, amelyek a valódi embriókban természetesen keletkeznének. "Arra számítunk, hogy ezeket a hibákat ki lehet javítani olyan struktúrák létrehozásával, amelyek összefoglalják a fejlődés során előforduló természetes folyamatokat" - mondta Zernicka-Goetz.
Hanna úgy gondolja, hogy az embriómodellek is használhatók gyógyszercélpontok azonosítására és új terápiák szűrésére, különösen a reproduktív problémákra, mint például a meddőség, a terhesség elvesztése, az endometriózis és a preeclampsia. "Ez etikai és technikai alternatívát jelent az embriók, petesejtek vagy abortuszból származó anyagok felhasználásával szemben, és összhangban van a legújabb ISSCR-irányelvekkel" - mondta. Már alapított egy céget az emberi embriómodellek lehetséges klinikai alkalmazásainak tesztelésére.
De Alfonso Martinez Arias, a cambridge-i és a barcelonai Pompeu Fabra Egyetem fejlődésbiológusa, aki az embrionális őssejtek emlősök fejlődésében betöltött szerepét vizsgálja, hangsúlyozza, hogy az ilyen alkalmazások továbbra sem bizonyítottak. Úgy véli, nehéz belátni, hogy egy ilyen torz változat kifejlesztéséből mennyi mindent lehet megérteni a valódi embriónövekedés kérdéseiről.
Emellett – mondta – mindezt még nem mutatták ki embereken. „Szerintem nem vágyálomokkal kellene előrelépnünk egy területen, hanem tényekkel” – mondta.
Az etikai határ
Amíg az embriómodellek csak modellek maradnak, a kutatásban és az orvostudományban való felhasználásuk nem kelthet sok vitát. "A szubszidiaritásnak nevezett etikai alapelv azt írja elő, hogy egy tudományos vagy orvosbiológiai célt a morálisan legkevésbé problematikus módon kell elérni" - mondta Rivron. A globális egészségügyi problémákkal, például a családtervezéssel kapcsolatos kutatások esetében az embriómodellek tanulmányozása etikailag kevésbé tűnik kihívást jelentő alternatívának, mint az IVF embriókon végzett munka.
„Nem szabad elfelejtenünk, hogy a szintetikus embriók nem valódi embriók” – mondta Hanna. Egyelőre hiányzik belőlük az a kulcsfontosságú lehetőség, hogy valódi magzattá nőjenek, nem is beszélve csecsemővé: ha egerekbe ültetik be őket, nem fejlődnek tovább.
De a további fejlődés képessége központi szerepet játszik az embriómodellek etikai státuszában, és nincs garancia arra, hogy jelenlegi képtelenségük magzatot és élveszületést hozni továbbra is fennáll.
Rivron egyetért azzal, hogy az embriómodelleken végzett munka, amelyet ő és mások végeznek, új szaporodási technológiához vezethet. „Előre láthatjuk, hogy a legteljesebb embriómodellek egy ponton felborulnak, és olyan embriókká válnak, amelyekből egyedek születnek” – mondta. „Úgy gondolom, hogy ezeknek az egyéneknek teljes jogúnak kell lenniük, mint lényeknek, függetlenül attól, hogyan alakultak.”
Emiatt etikusokkal dolgozik azon, hogy kialakítsák e tanulmányok etikai keretét. „Egy napon lehetségessé válhat az őssejtekből előállított emberi embriók asszisztált reprodukciós felhasználása, de ehhez kimerítő előzetes megbeszélésre és értékelésre lenne szükség, hogy biztonságos, társadalmilag és etikailag igazolható-e és kívánatos-e.”
De az etikai kérdések nem csak akkor jelentkeznek, ha a technológiát az emberi reprodukcióra használják. Greely úgy véli, hogy „ha egy embriómodell „elég hasonló” egy „normális” emberi embrióhoz, akkor azt emberi embrióként kell kezelni a törvényi és szabályozási célokra, beleértve, de nem kizárólagosan a 14 napos szabályt vagy bármilyen felülvizsgálatot. belőle.”
Mi számít elég hasonlónak? Ez a kritérium akkor teljesülne – mondta –, ha az embriómodell jelentős valószínűséggel képes élő emberi baba születésére.
A baj az, hogy nagyon nehéz lehet biztosan tudni, hogy ez a helyzet, ha nem ültetünk be emberi embriómodellt a méhbe. Egy ilyen entitás etikai státuszának meghatározásának egyetlen módja lehet etikátlan.
A majom embriómodellekkel végzett kínai csapathoz hasonló munka azonban kizárhatja ezt a bizonytalanságot. Ha ezek az embriószerű entitások terhességet indukálhatnak, és egy nap utódokat hozhatnak majmokban, akkor ésszerűen arra következtethetünk, hogy az egyenértékű emberi embriómodellek is képesek lennének. Ban ben egy kommentár azon a munkán, Insoo Hyun, a Harvard Medical School Bioetikai Központjának kutatásetikai igazgatója a következőket írta: „Ebben a pillanatban az emberi embriómodellek olyan pontosnak tekinthetők, hogy funkcionálisan az igazinak számítanak.”
Egy ilyen eredmény, még ha csak majmoknál is, arra vezetheti a szabályozó hatóságokat, hogy az emberi embriómodellek megérdemlik, hogy embrióként kezeljék őket, az ezzel járó korlátozásokkal együtt. Egyes kutatók úgy érzik, hogy sürgősen szükségünk van az embrió új meghatározására, hogy egyértelművé tegyük, és lépést tartsunk a tudományos fejlődéssel. Ha alapos okunk van feltételezni, hogy egy embriómodell képes életképes utódokat generálni, akkor vagy el kell fogadnunk a szabályozási következményeket, vagy meg kell találnunk a módját ennek a lehetőségnek a semmissé tételére.
Ezek egy olyan technika dilemmái, amelyek összemoshatják régi elképzeléseinket arról, hogy mi minősül embernek, és hogyan jönnek létre az emberek. Bartha Maria Knoppers, a kanadai McGill Egyetem professzora és kutatószéke, valamint a kutatásetikai szaktekintély egy kommentár mert Tudomány Greely-vel, amelyben az olyan fejlesztéseket, mint az embriómodellek, úgy írták le, mint „az ember jogi meghatározását”. Minél többet fedezünk fel arról, hogyan készültünk és hogyan lehetnénk, annál kevésbé világos, hogy a tudomány tisztázza ezt a kérdést.
Javítás: 13. június 2020
Zernicka-Goetz 2016-os, az IVF egérembriók gélmátrixban történő termesztéséről szóló tanulmányát Brivanlou hasonló munkájának idézőjelével egészítettük ki.
- SEO által támogatott tartalom és PR terjesztés. Erősödjön még ma.
- EVM Finance. Egységes felület a decentralizált pénzügyekhez. Hozzáférés itt.
- Quantum Media Group. IR/PR erősített. Hozzáférés itt.
- PlatoAiStream. Web3 adatintelligencia. Felerősített tudás. Hozzáférés itt.
- Forrás: https://www.quantamagazine.org/embryo-models-challenge-legal-ethical-and-biological-concepts-20230613/
- :van
- :is
- :nem
- ][p
- $ UP
- 12
- 13
- 14
- 2006
- 2016
- 2018
- 2020
- 2021
- 2022
- 2023
- 24
- 50
- 60
- 8
- a
- képesség
- Képes
- Rólunk
- AC
- Elfogad!
- pontos
- pontosan
- elért
- elismerte
- szerez
- aktív
- tényleges
- hozzáadott
- előre
- fejlett
- előlegek
- Előny
- Után
- előre
- célok
- Minden termék
- lehetővé
- kizárólag
- mentén
- mellett
- már
- Is
- alternatív
- összeg
- an
- és a
- állat
- Másik
- számít
- bármilyen
- Már
- bármi
- alkalmazások
- április
- VANNAK
- körül
- mesterséges
- AS
- szempontok
- At
- Légkör
- hatóság
- Tengely
- Baba
- labda
- barcelona
- alapján
- alapvető
- alap
- BE
- mert
- válik
- óta
- előtt
- kezdődik
- Kezdet
- hogy
- Hisz
- úgy gondolja,
- Jobb
- között
- Túl
- Nagy
- orvosbiológiai
- biotechnológia
- vér
- elhomályosít
- testületek
- test
- mindkét
- határait
- Agy
- hoz
- de
- by
- hívás
- hívott
- Cambridge
- TUD
- Kaphat
- Kanada
- nem tud
- képes
- Kapacitás
- szén
- szén-dioxid
- eset
- Okoz
- Cellák
- Központ
- központi
- Szék
- kihívás
- kihívást
- Kína
- kínai
- keringő
- világosság
- világos
- Klinikai
- munkatársai
- Oszlop
- jön
- kényelmes
- bizottság
- vállalat
- hasonló
- teljes
- alkatrészek
- veszélyeztetése
- fogalmak
- aggodalmak
- magabiztos
- magabiztosan
- kapcsolat
- megegyezés
- Következmények
- figyelembe vett
- következetes
- áll
- kapcsolat
- tovább
- vezérelt
- vita
- megtérít
- korrigált
- tudott
- országok
- ország
- készítette
- létrehozása
- teremtés
- kritikus
- nyers
- kultúra
- Jelenlegi
- Jelenleg
- Dallas
- nap
- Nap
- Halál
- évtizedek
- dönt
- határozott
- tekinteni
- meghatározó
- osztály
- Származtatott
- leírni
- leírt
- megérdemel
- részletek
- Határozzuk meg
- Fejleszt
- fejlett
- fejlesztése
- Fejlesztés
- fejlődési
- fejlesztések
- fejleszt
- eszköz
- DID
- különbségek
- különböző
- Igazgató
- felfedez
- felfedezés
- vita
- különbséget tesz
- do
- Ennek
- csinált
- ne
- Által
- le-
- gyógyszer
- Korábban
- Korai
- korai fázis
- Oktatás
- bármelyik
- ösztönözni
- elég
- Egész
- teljesen
- Szervezetek
- Jogosult
- egység
- Egyenértékű
- alapvető
- etikai
- etika
- értékelés
- Még
- végül is
- Minden
- Kivéve
- izgatott
- létező
- várható
- kísérletek
- szakértő
- Magyarázza
- terjed
- kiterjedő
- tény
- tények
- FAIL
- Kudarc
- család
- messze
- érez
- női
- kevés
- kevesebb
- mező
- megtöltött
- Találjon
- megtalálása
- vezetéknév
- első
- hibás
- Összpontosít
- követ
- következő
- A
- Kényszer
- forma
- képződés
- alakult
- talált
- Alapított
- Keretrendszer
- ból ből
- eleget tesz
- Tele
- teljesen
- funkcionális
- funkcionálisan
- további
- további fejlődés
- Gen
- általában
- generál
- generált
- generáló
- valódi
- kap
- szerzés
- Giving
- üveg
- Globális
- Globális egészség
- Go
- cél
- jó
- fokozatosan
- megadott
- Csoport
- Csoportok
- Nő
- Növekvő
- felnőtt
- Növekedés
- garancia
- irányelvek
- kellett
- fél
- Kemény
- Harvard
- Legyen
- he
- fej
- Egészség
- egészséges
- Szív
- neki
- Magas
- őt
- tanácsok
- övé
- tart
- NYITVATARTÁS
- Hogyan
- azonban
- HTML
- http
- HTTPS
- emberi
- Az emberek
- i
- ötletek
- azonosítani
- if
- nagyon
- végre
- következményei
- fontos
- javuló
- in
- képtelenség
- Beleértve
- inkubátor
- független
- egyének
- nem hatékony
- információ
- kezdetben
- kezdeményez
- belső
- Intézet
- Felület
- belső
- Nemzetközi
- bele
- részt
- bevonásával
- Izrael
- kérdések
- IT
- ITS
- maga
- japán
- június
- éppen
- Tart
- Kulcs
- rúg
- vese
- Kedves
- Ismer
- laboratórium
- Labs
- hiány
- nagymértékben
- keresztnév
- Tavaly
- Késő
- legutolsó
- Törvény
- törvények
- vezet
- vezető
- tanulás
- legkevésbé
- Led
- Jogi
- jogilag
- kevesebb
- hadd
- szintek
- élet
- mint
- LIMIT
- Korlátozott
- határértékek
- bélés
- kis
- él
- élő
- Hosszú
- néz
- hasonló
- le
- készült
- magazin
- Fő
- csinál
- Gyártás
- sok
- jel
- anyagok
- Mátrix
- érett
- Lehet..
- orvosi
- orvostudomány
- találkozott
- esetleg
- mérföldkő
- Mobil
- modell
- modellek
- módosított
- molekuláris
- több
- a legtöbb
- többnyire
- anya
- sok
- kell
- születő
- Természetes
- Szükség
- szükséges
- Neuroscience
- Új
- következő
- nem
- normális
- rendszerint
- semmi
- regény
- Most
- szerez
- előforduló
- of
- ajánlat
- gyakran
- Régi
- on
- ONE
- csak
- nyit
- or
- Más
- Egyéb
- mi
- ki
- kívül
- felett
- Oxigén
- Béke
- Papír
- különösen
- alkatrészek
- Elmúlt
- múlt
- ösvény
- Emberek (People)
- talán
- időszak
- tervezés
- Plató
- Platón adatintelligencia
- PlatoData
- bőséges
- pont
- pozíció
- lehetőség
- lehetséges
- potenciális
- potenciálisan
- pontosan
- prekurzor
- Terhesség
- be
- szép
- korábban
- primitív
- alapelv
- Előzetes
- valószínűleg
- Probléma
- problémák
- folyamat
- Folyamatok
- gyárt
- Készült
- Egyetemi tanár
- mélységes
- program
- ígéret
- biztató
- kilátás
- ad
- feltéve,
- amely
- közzétett
- tisztán
- célokra
- tesz
- helyezi
- Quantamagazine
- kérdés
- Kérdések
- emel
- emelés
- Arány
- Inkább
- el
- elérte
- igazi
- valószerű
- tényleg
- ok
- miatt
- új
- nemrég
- ajánlja
- visszanyerésére
- régiók
- szabályos
- előírások
- Szabályozók
- szabályozók
- marad
- maradványok
- figyelemre méltó
- eszébe jut
- Számolt
- Jelentések
- reprodukció
- szükség
- megköveteli,
- kutatás
- kutatók
- azok
- korlátozás
- korlátozások
- eredményez
- Eredmények
- felfedve
- jobb
- Emelkedik
- Szerep
- nagyjából
- Szabály
- futás
- s
- biztonságos
- Biztonság
- Mondott
- azonos
- azt mondja,
- Tudomány
- tudományos
- tudósok
- kaparni
- Képernyő
- Második
- lát
- látás
- látszik
- Úgy tűnt
- Úgy tűnik,
- látott
- szegmensek
- számos
- Sanghajban
- Alak
- alakú
- Megosztás
- ő
- Héj
- rövid
- hiányosságokat
- Hamarosan
- kellene
- kimutatta,
- mutatott
- Műsorok
- jelek
- jelentős
- Jelek
- hasonló
- hasonlóságok
- óta
- SIX
- méretek
- Bőr
- So
- eddig
- társadalmilag
- Társadalom
- Puha
- Kizárólag
- megoldások
- SOLVE
- néhány
- majd egyszer
- Források
- szakosít
- specializált
- Színpad
- állapota
- Stanford
- Stanford Egyetem
- Kezdve
- kezdődik
- Állami
- Állapot
- Származik
- Őssejtek
- Még mindig
- megáll
- megállt
- csík
- struktúra
- tanult
- tanulmányok
- Tanulmány
- Tanul
- Később
- siker
- sikeresen
- ilyen
- javasolja,
- nyár
- támogatás
- sebészeti
- meglepődött
- szintetikus
- rendszer
- Systems
- Vesz
- meghozott
- célok
- csapat
- csapat
- Műszaki
- Technológia
- teszt
- Texas
- mint
- hogy
- A
- törvény
- Az állam
- azok
- Őket
- akkor
- elmélet
- gyógykezelés
- Ott.
- Ezek
- ők
- dolog
- Szerintem
- Gondolkodás
- Azt hiszi
- ezt
- azok
- fenyegetés
- három
- Keresztül
- idő
- típus
- nak nek
- együtt
- is
- szerszámok
- felé
- átment
- baj
- igaz
- valóban
- fordul
- kettő
- típus
- típusok
- jellemzően
- UK
- nekünk
- Végül
- Bizonytalanság
- alatt
- folyamatban lévő
- megért
- megértés
- megértett
- egyetemi
- cambridge-i egyetem
- példátlan
- -ig
- sürgős
- us
- használ
- használt
- segítségével
- változat
- nagyon
- életképes
- Fal
- volt
- Út..
- módon
- we
- webp
- Hetek
- Jólét
- JÓL
- voltak
- Mit
- Mi
- amikor
- vajon
- ami
- WHO
- egész
- teljesen
- miért
- széles körben
- lesz
- val vel
- nélkül
- Nyerte
- Munka
- dolgozó
- művek
- világszerte
- lenne
- wu
- XEN
- év
- év
- még
- Hozam
- te
- A te
- zephyrnet