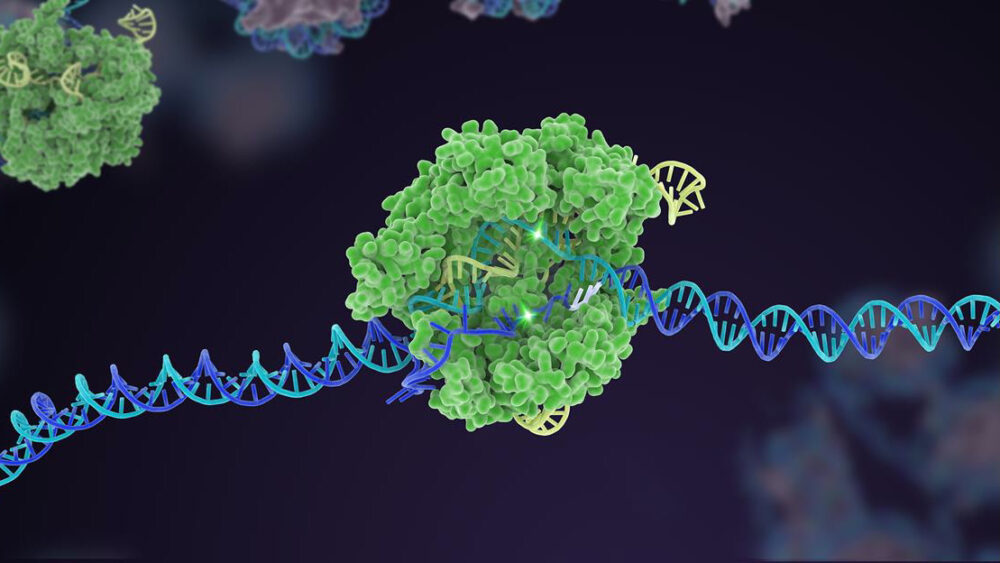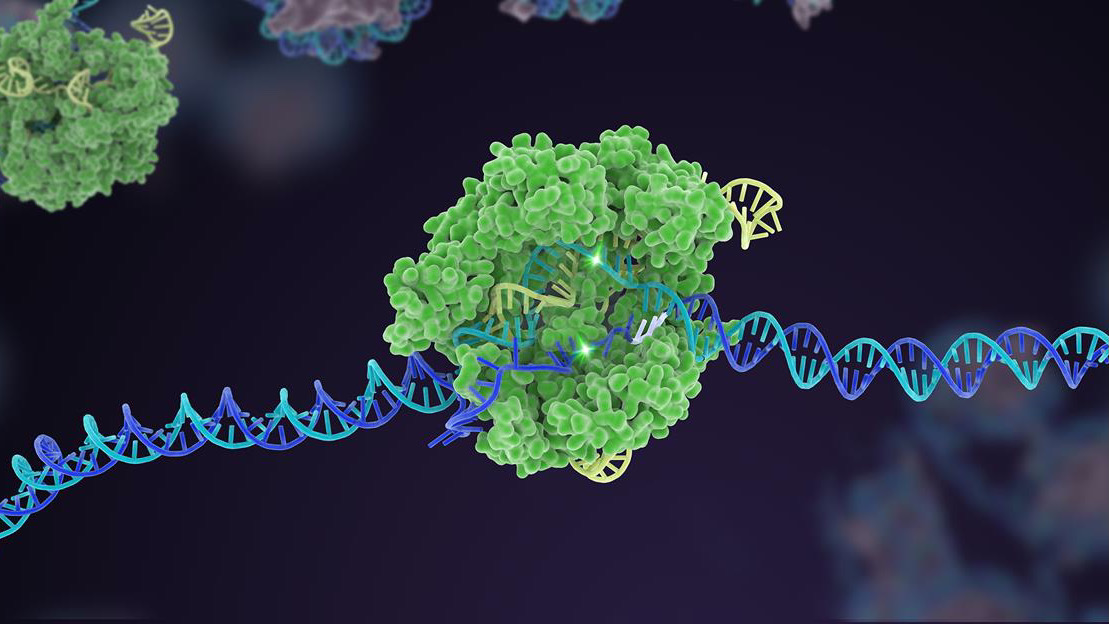
Sepuluh tahun yang lalu, mekanisme pertahanan bakteri yang kurang dikenal meroket menjadi terkenal sebagai editor genom yang kuat. Dalam dekade sejak itu, CRISPR-Cas9 telah menghasilkan banyak varian, berkembang menjadi kotak alat komprehensif yang dapat mengedit kode genetik kehidupan.
Jauh dari pengejaran menara gading, penggunaan praktisnya dalam penelitian, perawatan kesehatan, dan pertanian datang dengan cepat dan dahsyat.
Anda telah melihat berita utama. FDA menyetujui penggunaannya di mengatasi mutasi genetik yang mendasari penyakit sel sabit. Beberapa peneliti sel kekebalan yang diedit untuk melawan kanker darah yang tidak dapat diobati pada anak-anak. Yang lain mengambil transplantasi organ babi ke manusia dari mimpi menjadi kenyataan dalam upaya untuk meringankan kekurangan organ donor. Pekerjaan terbaru bertujuan untuk membantu jutaan orang dengan kolesterol tinggi — dan berpotensi membawa terapi gen berbasis CRISPR ke massa — oleh menurunkan kemungkinan mereka terkena penyakit jantung dengan sekali injeksi.
Tetapi bagi Dr. Jennifer Doudna, yang memenangkan Hadiah Nobel pada tahun 2020 untuk perannya dalam mengembangkan CRISPR, kami baru mengetahui potensinya. Bersama dengan mahasiswa pascasarjana Joy Wang, Doudna membuat peta jalan untuk teknologi dekade berikutnya dalam sebuah artikel in Ilmu.
Jika tahun 2010-an difokuskan untuk membangun kotak alat CRISPR dan membuktikan keefektifannya, dekade ini adalah saat teknologi mencapai potensi penuhnya. Dari terapi berbasis CRISPR dan layar skala besar untuk diagnosis penyakit hingga merekayasa tanaman hasil tinggi dan makanan bergizi, teknologi “dan dampak potensialnya masih dalam tahap awal,” tulis para penulis.
Satu Dekade Sorotan
Kami telah menumpahkan banyak tinta pada kemajuan CRISPR, tetapi ada baiknya meninjau kembali masa lalu untuk memprediksi masa depan — dan berpotensi mencari masalah di sepanjang jalan.
Salah satu sorotan awal adalah kemampuan luar biasa CRISPR untuk merekayasa model penyakit hewan dengan cepat. Bentuk aslinya dengan mudah memotong gen yang ditargetkan dalam embrio yang sangat awal, yang ketika ditransplantasikan ke dalam rahim dapat menghasilkan tikus yang dimodifikasi secara genetik hanya dalam sebulan, dibandingkan dengan satu tahun menggunakan metode sebelumnya. Versi CRISPR tambahan, seperti pengeditan dasar—menukar satu huruf genetik dengan yang lain—dan pengeditan utama—yang memotong DNA tanpa memotong kedua untai—semakin meningkatkan fleksibilitas perangkat dalam merekayasa organoid yang diubah secara genetik (berpikir mini-otak) dan binatang. CRISPR dengan cepat membuat lusinan model untuk beberapa penyakit kita yang paling mematikan dan membingungkan, termasuk berbagai jenis kanker, Alzheimer, dan distrofi otot Duchenne—gangguan degeneratif di mana otot perlahan menghilang. Lusinan uji coba berbasis CRISPR sekarang dalam karya.
CRISPR juga mempercepat penyaringan genetik ke era big data. Daripada menargetkan satu gen pada satu waktu, sekarang dimungkinkan untuk membungkam, atau mengaktifkan, ribuan gen secara paralel, membentuk semacam batu Rosetta untuk menerjemahkan gangguan genetik menjadi perubahan biologis. Ini sangat penting untuk memahami interaksi genetik, seperti pada kanker atau penuaan yang sebelumnya tidak kita ketahui, dan mendapatkan amunisi baru untuk pengembangan obat.
Tetapi pencapaian puncak CRISPR adalah pengeditan multipleks. Seperti mengetuk beberapa tuts piano secara bersamaan, jenis rekayasa genetika ini menargetkan beberapa area DNA spesifik, dengan cepat mengubah susunan genetik genom sekaligus.
Teknologi ini bekerja pada tumbuhan dan hewan. Selama ribuan tahun, orang dengan susah payah membiakkan tanaman dengan ciri-ciri yang diinginkan—baik itu warna, ukuran, rasa, nutrisi, atau ketahanan terhadap penyakit. CRISPR dapat membantu memilih beberapa sifat atau bahkan membudidayakan tanaman baru hanya dalam satu generasi. Sapi jantan tanpa tanduk yang dihasilkan CRISPR, tomat kaya nutrisi, dan hewan ternak hiper-otot dan ikan sudah menjadi kenyataan. Dengan populasi dunia mencapai 8 miliar pada tahun 2022 dan jutaan menderita kelaparan, CRISPRed-crops dapat memberikan garis hidup — yaitu, jika orang bersedia menerima teknologi tersebut.
Jalan ke Depan
Di mana kita pergi dari sini?
Kepada para penulis, kami perlu lebih meningkatkan efektivitas CRISPR dan membangun kepercayaan. Ini berarti kembali ke dasar untuk meningkatkan akurasi dan presisi pengeditan alat. Di sini, platform untuk mengembangkan enzim Cas, komponen "gunting" dari mesin CRISPR, sangat penting.
Sudah ada yang sukses: satu versi Cas, misalnya, bertindak sebagai pagar pembatas untuk komponen penargetan— “anjing pelacak” sgRNA. Dalam CRISPR klasik, sgRNA bekerja sendiri, tetapi dalam versi yang diperbarui ini, sgRNA kesulitan mengikat tanpa bantuan Cas. Trik ini membantu menyesuaikan pengeditan ke situs DNA tertentu dan meningkatkan akurasi sehingga pemotongan berfungsi seperti yang diperkirakan.
Strategi serupa juga dapat meningkatkan presisi dengan efek samping yang lebih sedikit atau menyisipkan gen baru ke dalam sel seperti neuron dan lainnya yang tidak lagi membelah. Meskipun sudah dimungkinkan dengan pengeditan utama, efisiensinya bisa 30 kali lebih rendah daripada mekanisme CRISPR klasik.
“Tujuan utama pengeditan utama dalam dekade berikutnya adalah meningkatkan efisiensi tanpa mengorbankan kemurnian produk pengeditan—hasil yang berpotensi mengubah pengeditan utama menjadi salah satu alat paling serbaguna untuk pengeditan presisi,” kata penulis.
Tapi mungkin yang lebih penting adalah pengiriman, yang tetap menjadi hambatan terutama untuk terapi. Saat ini, CRISPR umumnya digunakan pada sel di luar tubuh yang diinfuskan kembali—seperti dalam kasus CAR-T—atau dalam beberapa kasus, ditambatkan ke pembawa virus atau dikemas dalam gelembung lemak dan disuntikkan ke dalam tubuh. Ada keberhasilan: di 2021, FDA menyetujui bidikan berbasis CRISPR pertama untuk mengatasi penyakit darah genetik, transthyretin amyloidosis.
Namun kedua strategi tersebut bermasalah: tidak banyak jenis sel yang dapat bertahan hidup dengan pengobatan CAR-T—mati saat dimasukkan kembali ke dalam tubuh—dan menargetkan jaringan dan organ tertentu sebagian besar tetap berada di luar jangkauan terapi injeksi.
Kemajuan utama untuk dekade berikutnya, kata para penulis, adalah untuk memindahkan kargo CRISPR ke jaringan yang ditargetkan tanpa membahayakan dan melepaskan editor gen di tempat yang dituju. Setiap langkah ini, meskipun tampak sederhana di atas kertas, menyajikan serangkaian tantangannya sendiri yang membutuhkan bioteknologi dan inovasi untuk mengatasinya.
Terakhir, CRISPR dapat bersinergi dengan kemajuan teknologi lainnya, kata penulis. Misalnya, dengan memanfaatkan pencitraan sel dan pembelajaran mesin, kami dapat segera merekayasa editor genom yang lebih efisien. Terimakasih untuk pengurutan DNA lebih cepat dan lebih murah, kita kemudian dapat dengan mudah memantau konsekuensi penyuntingan gen. Data ini kemudian dapat memberikan semacam mekanisme umpan balik yang dapat digunakan untuk merekayasa editor genom yang lebih kuat dalam lingkaran yang baik.
Dampak Dunia Nyata
Meskipun memperluas kotak alat CRISPR dalam agenda, teknologinya cukup matang untuk memengaruhi dunia nyata dalam dekade kedua, kata penulis.
Dalam waktu dekat, kita akan melihat “peningkatan jumlah perawatan berbasis CRISPR yang beralih ke tahap uji klinis selanjutnya.” Melihat lebih jauh ke depan, teknologi, atau variannya, dapat membuat xenotransplantasi organ babi ke manusia menjadi rutin, bukan eksperimental. Skrining skala besar untuk gen yang menyebabkan penuaan atau penyakit degeneratif otak atau jantung—pembunuh utama kita saat ini—dapat menghasilkan perawatan profilaksis berbasis CRISPR. Ini bukan tugas yang mudah: kita membutuhkan pengetahuan tentang genetika yang mendasari penyakit genetik multifaset—yaitu, ketika banyak gen berperan—dan cara untuk mengirimkan alat pengeditan ke targetnya. “Tetapi manfaat potensial dapat mendorong inovasi di bidang ini jauh melampaui apa yang mungkin dilakukan saat ini,” kata para penulis.
Namun dengan kekuatan yang lebih besar datanglah tanggung jawab yang lebih besar. CRISPR telah maju dengan sangat cepat, dan badan pengatur serta masyarakat masih berjuang untuk mengejar ketinggalan. Mungkin contoh yang paling terkenal adalah dari bayi CRISPR, di mana eksperimen dilakukan terhadap pedoman etika global didorong sebuah konsorsium internasional untuk meletakkan garis merah untuk pengeditan sel germinal manusia.
Demikian pula, organisme hasil rekayasa genetika (GMO) tetap menjadi topik kontroversial. Meskipun CRISPR jauh lebih tepat daripada alat genetik sebelumnya, terserah konsumen untuk memutuskan apakah akan menerimanya generasi baru makanan hasil evolusi manusia—baik tumbuhan maupun hewan.
Ini adalah percakapan penting yang membutuhkan wacana global saat CRISPR memasuki dekade kedua. Namun bagi penulis, masa depan terlihat cerah.
“Sama seperti saat munculnya pengeditan genom CRISPR, kombinasi keingintahuan ilmiah dan keinginan untuk memberi manfaat bagi masyarakat akan mendorong inovasi teknologi CRISPR pada dekade berikutnya,” kata mereka. “Dengan terus menjelajahi alam, kita akan menemukan apa yang tidak dapat dibayangkan dan memanfaatkannya di dunia nyata untuk kepentingan planet ini.”
Gambar Kredit: NIH
- Konten Bertenaga SEO & Distribusi PR. Dapatkan Amplifikasi Hari Ini.
- Platoblockchain. Intelijen Metaverse Web3. Pengetahuan Diperkuat. Akses Di Sini.
- Sumber: https://singularityhub.com/2023/01/25/crisprs-wild-first-decade-only-scratches-the-surface-of-its-potential/
- 2020
- a
- kemampuan
- dipercepat
- Setuju
- ketepatan
- prestasi
- tindakan
- Tambahan
- memajukan
- maju
- uang muka
- kedatangan
- terhadap
- lembaga
- agenda
- Penuaan
- pertanian
- di depan
- bertujuan
- meringankan
- sendirian
- sudah
- Meskipun
- Alzheimer
- amunisi
- dan
- hewan
- hewan
- disetujui
- daerah
- Bantuan
- penulis
- kembali
- mendasarkan
- Dasar-dasar
- manfaat
- Manfaat
- Berkeley
- Luar
- Besar
- Big data
- Milyar
- mengikat
- darah
- Bloomberg
- tubuh
- mendorong
- Didorong
- Otak
- membawa
- membangun
- membangun kepercayaan
- Kanker
- tidak bisa
- kasus
- kasus
- gulat
- Sel
- tantangan
- kesempatan
- Perubahan
- mengubah
- murah
- klasik
- Klinis
- uji klinis
- kode
- warna
- kombinasi
- bagaimana
- dibandingkan
- komponen
- luas
- kompromi
- Konsekuensi
- konsorsium
- Konsumen
- terus-menerus
- kontroversial
- percakapan
- bisa
- kredit
- CRISPR
- kritis
- tanaman
- rasa ingin tahu
- Sekarang
- Memotong
- pemotongan
- data
- dasawarsa
- Pertahanan
- menyampaikan
- pengiriman
- berkembang
- Pengembangan
- menemukan
- Penyakit
- penyakit
- dna
- turun
- puluhan
- mimpi
- mendorong
- obat
- selama
- setiap
- Awal
- mudah
- editor
- efektivitas
- efek
- efisiensi
- efisien
- dienkapsulasi
- insinyur
- Teknik
- Masuk
- terutama
- mapan
- membangun
- etis
- Bahkan
- berkembang
- contoh
- memperluas
- menyelidiki
- FAME
- kebun
- FAST
- FDA
- umpan balik
- pertarungan
- Pertama
- keluwesan
- terfokus
- makanan
- bentuk
- dari
- penuh
- lebih lanjut
- masa depan
- mendapatkan
- umumnya
- menghasilkan
- generasi
- rekayasa genetik
- Genetika
- Aksi
- Go
- tujuan
- akan
- lulus
- lebih besar
- pedoman
- Headlines
- kesehatan
- Hati
- membantu
- membantu
- di sini
- High
- Menyoroti
- HTTPS
- manusia
- Pencitraan
- Dampak
- penting
- meningkatkan
- in
- Termasuk
- Meningkatkan
- Pada meningkat
- Meningkatkan
- luar biasa
- Innovation
- interaksi
- Internasional
- IT
- Jennifer
- hanya satu
- kunci
- kunci-kunci
- pembunuh
- Jenis
- pengetahuan
- besar-besaran
- memimpin
- pengetahuan
- meminjamkan
- surat
- Hidup
- baris
- lagi
- mencari
- TERLIHAT
- mesin
- Mesin belajar
- mesin-mesin
- Utama
- membuat
- rias
- banyak
- dewasa
- cara
- mekanisme
- metode
- jutaan
- model
- dimodifikasi
- Memantau
- Bulan
- lebih
- lebih efisien
- paling
- bergerak
- multifaset
- beberapa
- Alam
- Alam
- Dekat
- Perlu
- Neuron
- New
- berikutnya
- NHS
- NIH
- Penghargaan Nobel
- terkenal jahat
- jumlah
- ONE
- asli
- Lainnya
- Lainnya
- di luar
- Mengatasi
- sendiri
- kertas
- Paralel
- lalu
- path
- negara
- Konsultan Ahli
- mungkin
- planet
- tanaman
- Platform
- plato
- Kecerdasan Data Plato
- Data Plato
- Cukup
- populasi
- mungkin
- potensi
- berpotensi
- kekuasaan
- kuat
- Praktis
- Ketelitian
- meramalkan
- diprediksi
- hadiah
- sebelumnya
- sebelumnya
- Perdana
- hadiah
- masalah
- Produk
- memberikan
- publik
- menempatkan
- cepat
- mencapai
- Mencapai
- nyata
- dunia nyata
- Kenyataan
- baru
- Merah
- regulator
- melepaskan
- tinggal
- sisa
- membutuhkan
- penelitian
- peneliti
- ketahanan
- tanggung jawab
- Kaya
- peta jalan
- Peran
- Tersebut
- Ilmu
- Pramuka
- penyaringan
- layar
- Kedua
- set
- kekurangan
- harus
- sisi
- Diam
- Sederhana
- serentak
- sejak
- tunggal
- situs web
- Ukuran
- Perlahan
- So
- Masyarakat
- beberapa
- tertentu
- kecepatan
- Spot
- pintal
- magang
- Tangga
- Masih
- BATU
- strategi
- Perjuangan
- Berjuang
- mahasiswa
- seperti itu
- penderitaan
- Permukaan
- bertahan
- target
- ditargetkan
- penargetan
- target
- tugas
- teknologi
- Teknologi
- Grafik
- Dasar-dasar
- Dunia
- mereka
- terapi
- ribuan
- waktu
- kali
- untuk
- hari ini
- bersama
- Toolbox
- alat
- puncak
- tema
- Menara
- uji
- Kepercayaan
- MENGHIDUPKAN
- jenis
- UN
- pokok
- pemahaman
- diperbarui
- menggunakan
- berbagai
- serba guna
- versi
- selamat datang
- Apa
- Apa itu
- apakah
- yang
- sementara
- SIAPA
- Liar
- akan
- rela
- tanpa
- Won
- Kerja
- bekerja
- dunia
- tahun
- tahun
- Menghasilkan
- zephyrnet.dll