טיפול בקרינה בסרטן יכול לעורר את התגובה החיסונית של הגוף ולעכב את צמיחת הגידול, אך הוא גם יכול להפחית את רמת הלימפוציטים, תאי הדם הלבנים הקשורים לתגובה החיסונית, וכתוצאה מכך לפגיעה בשליטה על הגידול ופרוגנוזה לקויה. חומרת הלימפופניה הנגרמת על ידי קרינה תואמת את המינון הנמסר לתאי הדם והלימפוציטים במחזור הדם. ככזה, מזעור המינון ללב, לדם היקפי ולאיברי הלימפה יכולה לעזור להפחית את ההשפעה המזיקה הזו.
כדי לחקור את התיאוריה הזו עוד יותר, Antje Galts ו עבדלחאלק חממי מאוניברסיטת דורטמונד בדק האם טיפולי רדיו FLASH - קרינה המועברת בשיעורי מינון גבוהים במיוחד - יכולה להפחית את רמת דלדול תאי מערכת החיסון במהלך טיפול פרוטונים של חולי סרטן המוח.
"המנגנון הביולוגי שמאחורי ההשפעה החוסכת של FLASH שנצפה בשיעורי מינון גבוהים עדיין לא מובן במלואו. עם זאת, אחת התיאוריות המוצעות היא ההשערה החיסונית, אשר מציעה כי מתן המינון המיידי של הקרנת FLASH מפחית באופן משמעותי את דלדול הלימפוציטים במחזור על ידי מזעור זמן החשיפה", מסביר חממי. "במחקר שלנו, הראינו שטיפול מופחת ומתן מינון מהיר חסכו תאי מערכת החיסון עד פי 27 בהשוואה לתוכנית טיפול קונבנציונלית של סריקת עיפרון-קרן פרוטונים".
Galts וחמי השתמשו בא מודל זרימת דם דוסימטרית לדמות את המינון ללימפוציטים במחזור הדם במהלך טיפול פרוטונים קונבנציונלי ומבוסס FLASH (IMPT) של גידול במוח. מודל העברת הקרן הדינמית מדמה תוכנית טיפול מפוצלת IMPT תוך התחשבות בשינוי המרחב-טמפורלי של קצב המינון של כל קרן עיפרון פרוטון בודד. חממי מציין כי המודל משלב פרמטרי אספקה מציאותיים מציקלוטונים זמינים מסחרית.
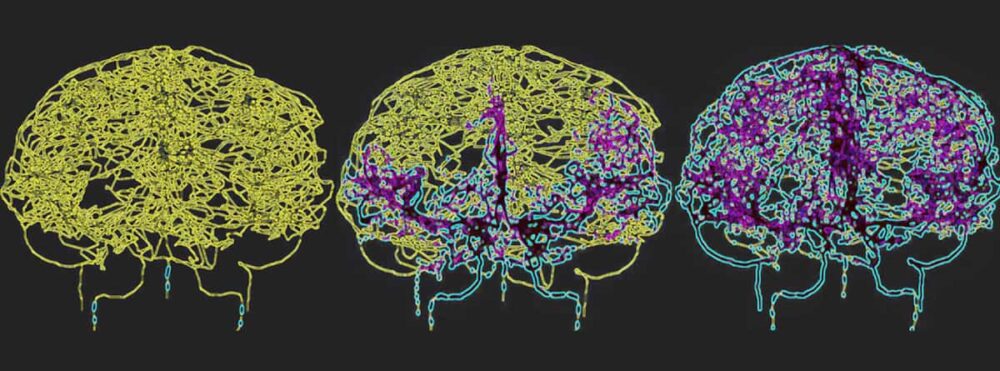
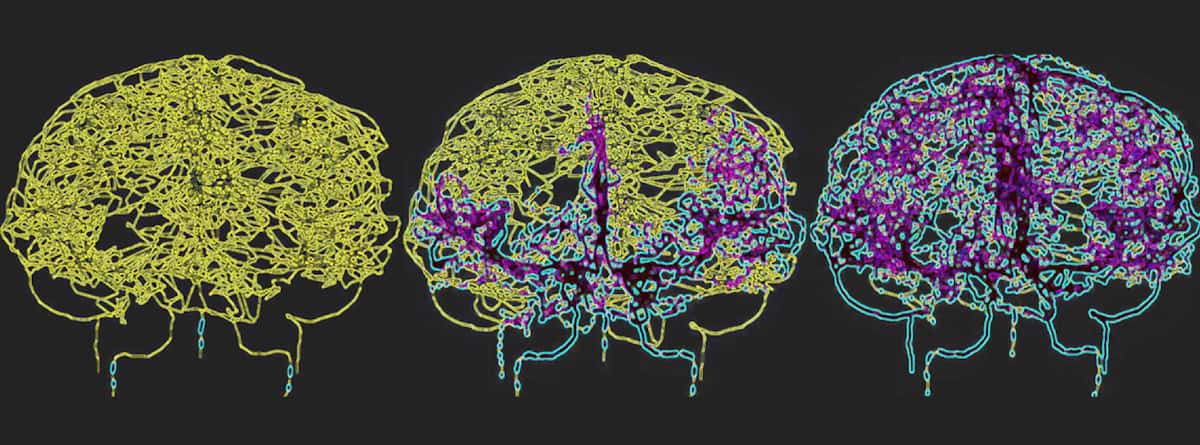
כדי לשקף במדויק את זרימת הדם במוח האנושי, Galts והאמי מיפו כלי דם ישירות מתמונות אנגיוגרפיה של MR במוח. הם השתמשו במודל המוח-וסקולרי שהתקבל, שכלל 465 כלי דם ו-8841 ענפי כלי דם בודדים, כדי לדמות את מחזור הדם של תאי מערכת החיסון בתוך זרם הדם.
החוקרים יצרו תכניות טיפול ריאליסטיות של IMPT לגידול גליובלסטומה, תוך שימוש בארבע קרני פרוטונים תקריות ופרמטרי מסירה רלוונטיים מבחינה קלינית. לאחר מכן הם חישבו את שדות הקרינה המשתנים בזמן שהדם במחזור הדם נחשף אליהם במהלך מתן תוכניות הטיפול בפרוטונים ואת המינון המצטבר לאחר הטיפול, ודיווחו על ממצאיהם ב פיזיקה ברפואה וביולוגיה.
גליובלסטומה היא הצורה הקטלנית ביותר של סרטן המוח וטיפול בה באמצעות הקרנות עלול לגרום ללימפוניה ממושכת הנגרמת בקרינה. "על ידי מודל של מערכת כלי דם במוח במהלך אספקת קרינה, אנו מקווים לקבל תובנות עמוקות יותר לגבי האופן שבו רדיותרפיה משפיעה על התגובה החיסונית בקבוצות אלו של חולים, מה שעלול להוביל לאסטרטגיות טיפוליות משופרות", אומר חממי.
השוואות תכניות
Galts וחמי בחנו ארבעה תרחישי טיפול: IMPT FLASH עם שבר בודד של 22.3 Gy; היפופרקציונלי FLASH באמצעות שני שברים של 14.6 Gy וחמישה שברים של 8 Gy; ו-IMPT קונבנציונלי באמצעות שלושים ושניים שברי 2 Gy. עבור כל תוכנית טיפול, הם העריכו את ההשפעה הדוסימטרית על הלימפוציטים במחזור הדם והעריכו את הרדיוטוקסיות שנוצרה.
היסטוגרמות של מינון-נפח גילו שטיפול בקרינה ב-FLASH הפחית משמעותית את שיעור התאים המוקרנים בהשוואה לשיעור המינון המקובל של IMPT. במהלך חלק הטיפול הראשון, כל שלוש תוכניות ה-FLASH הקרינו בסביבות 1.52% מנפח הדם במחזור, בעוד שה-IMPT הקונבנציונלי הקרינה 2.18%. תוכניות FLASH מופרדות, שנמסרו על פני שניים או חמישה חלקים, הגדילו את הנפח המוקרן הזה ל-3.01% ו-7.35%, בהתאמה, בעוד ש-IMPT קונבנציונלי חשף 42.41% מהדם ההיקפי לקרינה.
לאחר מכן, החוקרים בדקו את רמת הלימפוציטים במחזור שקיבלו מינון של לפחות 7 cGy - סף שגורם לדלדול של 2% באוכלוסיית הלימפוציטים - במהלך כל הטיפול. לאחר השלמת IMPT קונבנציונלי, 25.65% מהלימפוציטים במחזור קיבלו מינון של לפחות 7 cGy. עבור טיפולי FLASH בודדים, שניים וחמישה חלקים, הנפחים שקיבלו יותר מסף מינון זה היו 1.21%, 2.30% ו-5.14%, בהתאמה.
הנפחים של לימפוציטים במחזור המקבלים מינונים של יותר מ-100 cGy, מה שגורם לדלדול של 30%, היו 0.77%, 1.28% ו-2.09% עבור FLASH יחיד, שני וחמישה חלקים, בהתאמה, ו-0.10% במהלך IMPT קונבנציונלי.
Galts וחמי חקרו גם את התגובה של לימפוציטים CD4+ ו-CD8+, בעלי התפלגות שונות בדם היקפי, לתרחישי ההקרנה השונים. עבור שני סוגי הלימפוציטים, הרג תאים לאחר החלק הראשון היה 0.66%, 0.62%, 0.32% ו-0.08% עבור FLASH יחיד, שני וחמישה חלקים, ו-IMPT קונבנציונלי, בהתאמה.
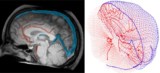
מודל חישובי קובע מינון לדם במהלך טיפולי הקרנות
לאחר הטיפול המלא, הדלדול בלימפוציטים היה 1.02% ו-1.56% עבור חלקים של שני וחמישה טיפולים, בהתאמה, ו-2.14% עבור IMPT קונבנציונלי. ממצאים אלו מוכיחים שטיפול פרוטונים ב-FLASH חוסך תאי חיסון במחזור במהלך טיפול תוך גולגולתי, כאשר חלק בודד של FLASH מפחית את שיעור הדלדול בכמעט 70% בהשוואה ל-IMPT קונבנציונלי.
חממי מספר עולם הפיזיקה שכעת הם מרחיבים את המודל כך שיכלול סרטן ראש וצוואר. "יתר על כן, אנו בוחנים שיטות שונות לאספקת FLASH והשפעתן על דלדול המערכת החיסונית, תוך התמקדות מיוחדת בטיפול FLASH קונפורמי המבוסס על אפנון אנרגיה פסיבי וספציפי למטופל", הוא מסביר. "למודל האספקה הזה יש פוטנציאל לחסוך לימפוציטים במחזור יותר בהשוואה לאספקת FLASH".
- הפצת תוכן ויחסי ציבור מופעל על ידי SEO. קבל הגברה היום.
- PlatoData.Network Vertical Generative Ai. העצים את עצמך. גישה כאן.
- PlatoAiStream. Web3 Intelligence. הידע מוגבר. גישה כאן.
- PlatoESG. פחמן, קלינטק, אנרגיה, סביבה, שמש, ניהול פסולת. גישה כאן.
- PlatoHealth. מודיעין ביוטכנולוגיה וניסויים קליניים. גישה כאן.
- מקור: https://physicsworld.com/a/flash-irradiation-spares-immune-cells-during-proton-therapy/
- :יש ל
- :הוא
- :לֹא
- $ למעלה
- 1
- 10
- 100
- 14
- 160
- 2%
- 22
- 25
- 27
- 35%
- 7
- 8
- a
- מצטבר
- במדויק
- לאחר
- תעשיות
- כמעט
- גם
- an
- ו
- ARE
- סביב
- AS
- מוֹעֳרָך
- המשויך
- At
- זמין
- מבוסס
- קרן
- מאחור
- דם
- שניהם
- מוֹחַ
- סרטן המוח
- ענפים
- אבל
- by
- מחושב
- CAN
- מחלת הסרטן
- לגרום
- גורמים
- תא
- תאים
- מַחזוֹרִי
- מחזור
- קליק
- מסחרית
- לעומת
- מַשׁלִים
- בהתחשב
- לִשְׁלוֹט
- מקובל
- יכול
- נוצר
- עמוק יותר
- נתן
- מסירה
- להפגין
- קובע
- אחר
- ישירות
- הפצה
- הפצות
- מנה
- מינונים
- בְּמַהֲלָך
- דינמי
- כל אחד
- השפעה
- אנרגיה
- שלם
- שווה
- שווי משקל
- מוערך
- הרחבת
- מסביר
- חקר
- היכרות
- חשוף
- חשיפה
- מהר
- שדות
- ממצאים
- ראשון
- חמש
- פלאש
- תזרים
- להתמקד
- הבא
- בעד
- טופס
- ארבע
- שבריר
- החל מ-
- מלא
- לגמרי
- נוסף
- לְהַשִׂיג
- קבוצה
- צמיחה
- יש
- he
- לֵב
- לעזור
- גָבוֹהַ
- לקוות
- איך
- אולם
- HTTPS
- בן אנוש
- תמונה
- תמונות
- מערכת חיסונית
- פְּגִיעָה
- משופר
- מַס
- in
- תקרית
- לכלול
- כלול
- משלבת
- גדל
- בנפרד
- מידע
- תובנות
- אל תוך
- לחקור
- סוגיה
- IT
- jpg
- הרג
- מוביל
- הכי פחות
- עזבו
- רמה
- לינקדין
- עוד
- max-width
- מנגנון
- רפואה
- שיטות
- מזעור
- מודל
- דוגמנות
- דוּגמָנוּת
- יותר
- רוב
- mr
- הערות
- עַכשָׁיו
- of
- on
- ONE
- לפתוח
- or
- שלנו
- הַחוּצָה
- יותר
- פרמטרים
- מסוים
- פסיבי
- חולים
- פיסיקה
- עולם הפיזיקה
- תכנית
- תוכניות
- אפלטון
- מודיעין אפלטון
- אפלטון נתונים
- עני
- אוכלוסייה
- פוטנציאל
- פוטנציאל
- פרופורציה
- מוּצָע
- רדיותרפיה
- ציון
- תעריפים
- מציאותי
- קיבלו
- קבלה
- להפחית
- מופחת
- מפחית
- הפחתה
- לשקף
- רלוונטי
- דווח
- חוקרים
- בהתאמה
- תגובה
- וכתוצאה מכך
- גילה
- תקין
- s
- אומר
- סריקה
- תרחישים
- תוכניות
- הראה
- באופן משמעותי
- יחיד
- התחלה
- לעורר
- אסטרטגיות
- זרם
- מְחוֹשָׁב
- לימוד
- כזה
- מציע
- מערכת
- אומר
- מֵאֲשֶׁר
- זֶה
- השמיים
- שֶׁלָהֶם
- אז
- התאוריה
- תרפיה
- אלה
- הֵם
- זֶה
- שְׁלוֹשָׁה
- סף
- דרך
- תמונה ממוזערת
- זמן
- פִּי
- ל
- בטיפול
- טיפול
- טיפולים
- נָכוֹן
- שתיים
- סוגים
- הבין
- אוניברסיטה
- מְשׁוּמָשׁ
- באמצעות
- שונים
- כלי שיט
- כֶּרֶך
- כרכים
- היה
- we
- היו
- מתי
- אם
- אשר
- בזמן
- לבן
- עם
- בתוך
- עוֹלָם
- עוד
- זפירנט