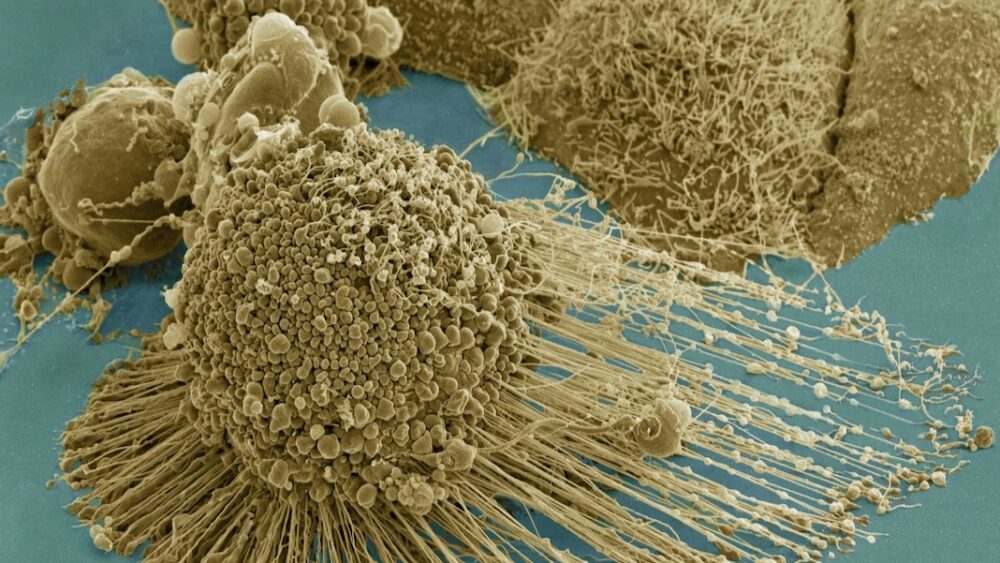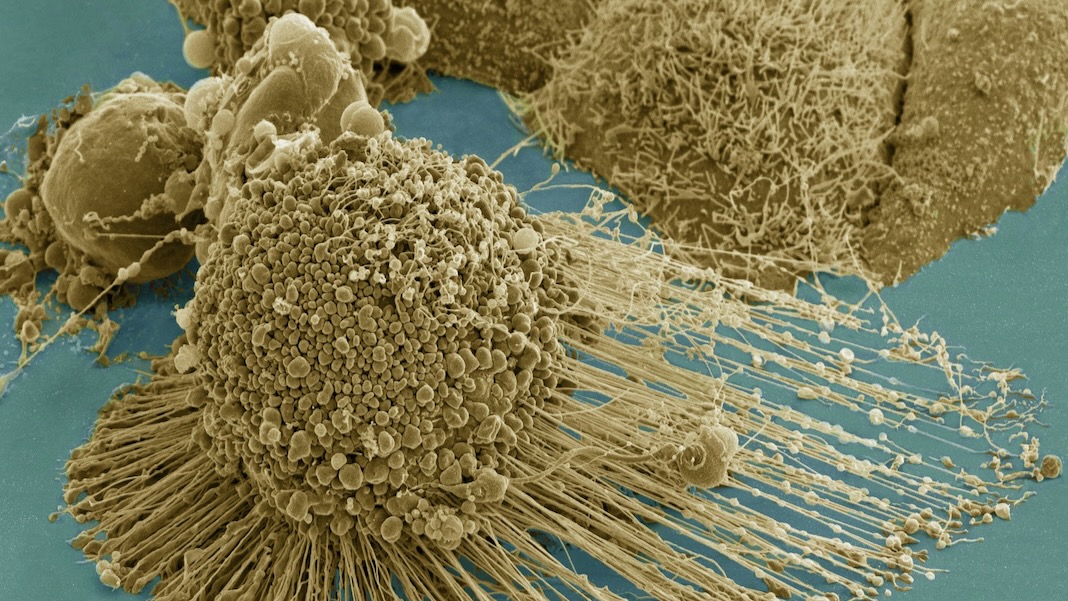
老化細胞は生化学廃棄物工場です。
新しい研究 それらを一掃する方法は、目の問題に対してすでに承認されている薬であることを示唆しています。
「ゾンビ細胞」と呼ばれる老化細胞は、加齢やがん治療によってゆっくりと蓄積します。 細胞は通常の機能を実行する能力を失います。 代わりに、有毒な化学物質のスープを局所環境に漏らし、炎症を悪化させ、健康な細胞に損傷を与えます。
XNUMX年以上の研究により、これらの細胞を遺伝子工学や薬物で除去することで、 老化を遅らせる マウスの症状。 投資家がそう思うのも不思議ではない 数十億ドルを注いだ これらに 「老化細胞破壊」薬.
初期の成功の兆しはすでにあります。 ある初期の臨床試験では、加齢に伴う肺の問題を抱えた人間を対象に、複数の薬剤を組み合わせてゾンビ細胞を一掃すると、次の効果が得られることが判明した。 安全な。 別の研究は中高年を助けた 血圧を維持する 階段を駆け上がっているとき。 しかし、老化細胞と戦うことは、運動能力を向上させることだけではありません。 多くの 他には? 骨の完全性を強化し、骨の健全性を強化することを含む臨床試験が進行中です。 アルツハイマー.
しかしカルロス・アネリラス氏、ミリアム・ゴロスペ氏、そしてボルチモアの国立衛生研究所(NIH)のチームにとって、治療法はまだ本当に痛みを伴うゾンビ細胞を攻撃していない。
In 調査 in ネイチャーエイジング研究チームは、これらの細胞の弱点を正確に特定しました。細胞は、風邪の時の鼻漏れのように、有毒な化学物質を絶えず放出しています。 老化に関連した分泌表現型から SASP と呼ばれるこの炎症分子の煮込みは、老化に寄与します。
幸運なことに、この化学物質の絶え間ない放出には代償が伴います。 ゾンビ細胞は、細胞内の「工場」を使用して、有毒物質を梱包し、隣接する細胞や近くの組織に輸送します。 すべてのセルにはこれらのファクトリーがあります。 しかし、ゾンビ細胞内の細胞は過剰反応を起こします。
新しい研究は、ゾンビ細胞の有毒物質の噴出に不可欠なタンパク質のペアを特定し、その過程を阻害するFDA承認の薬剤を発見した。 人間の年齢にほぼ相当する生後22か月のマウスに投与したところ、治療後わずか70か月以内に腎臓、肝臓、肺の機能が改善した。
作品が「目立つ」 と ヤヒヤ・アマン、編集者 ネイチャーエイジング。 これは「新しい老化細胞破壊治療薬開発の興味深い標的」であると、この研究には関与していないUConn HealthのMing Xu氏は付け加えた。
分子メトロポリタン
各セルは、複数の地区を含む賑やかな都市です。
一部には私たちの遺伝子アーカイブが保管されています。 それらの DNA コードをタンパク質に翻訳する人もいます。 もあります 酸が詰まったゴミ箱 と分子 ごみ箱 各セルに老廃物が入らないようにします。
それからERです。 いえ、救急室ではなく、ふわふわしたクロワッサンのような構造です。 小胞体と呼ばれるそれは、新しいタンパク質にとってのグランドセントラルです。 ER はタンパク質をパッケージングし、内部構造、細胞表面、または細胞外の目的地にタンパク質を送達します。
これらの「分泌」パッケージは、局所の細胞機能を制御する強力な調節因子です。 通常、ER は細胞が隣接する組織と反応を調整するのを助けます。たとえば、擦り傷の後に血液を凝固させたり、損傷を治癒するために免疫反応を刺激したりします。
老化細胞はこのプロセスを乗っ取ります。 生産的なシグナル伝達の代わりに、彼らは有毒な化学物質のスープを放出します。 これらの細胞は生まれながらにして有害ではありません。 むしろ、彼らは生涯にわたる怪我、たとえば DNA への損傷によって変化します。 非常に多くの損傷に直面すると、正常な細胞は枯れてしまい、皮膚などの一部の組織では健康な新しい細胞がそれらを置き換えることができます。
対照的に、ゾンビ細胞は死ぬことを拒否します。 害が致死レベルを下回っている限り、細胞は生き続け、致命的な醸造物を排出し、近くにいる他の細胞に害を与えます。
これらの特徴により、ゾンビ細胞はアンチエイジング治療の貴重な標的となります。 そして、有望な治療法も登場しました。 ほとんどは、ゾンビ細胞がどのように機能するかについての既存の知識やアイデアに依存していました。 次に研究者は、大規模な薬物ライブラリーからその機能を破壊する可能性のある化学物質を探します。 この戦略は有用ではありますが、治療の選択肢を見逃す可能性があります。
新しい研究は不正なものでした。 彼らは仮説から始めるのではなく、ヒトゲノム全体をスクリーニングして新たな脆弱性を見つけました。
ワイルドウェスト
調査の中で、チームは CRISPR に目を向けました。 遺伝子エディターとして有名な CRISPR は、現在、細胞機能に寄与する遺伝子やタンパク質を正確に特定するためによく使用されています。 ここで、チームはヒトゲノム内のすべての遺伝子を破壊して、ゾンビ細胞を排除する遺伝子を特定しました。
彼らの働きは報われました。 このスクリーニングにより、老化細胞の生存に重要なタンパク質ペアが見つかりました。 研究チームは次に、このペアを破壊するためにFDAが承認した薬を探した。 彼らは、目の血管疾患の治療に承認されている薬であるベルテポルフィンに探していたものを見つけました。
このタンパク質ペアを用いたいくつかのゾンビ細胞培養では、この薬剤が老化細胞をアポトーシスに導きました。つまり、一種の細胞死である「穏やかな落葉」が周囲の細胞に害を及ぼすことはありません。
さらに詳しく調べると、この薬はゾンビ細胞の小胞体、つまり輸送センターを直接標的にしているようだ。 この薬剤で処理された細胞は繊細な多層構造を維持できず、その後、濡れて丸めたペーパータオルのような形状に縮んでしまいました。
「縮小したERがゾンビ細胞の代謝危機を引き起こした」とアネリラス氏とゴロスペ氏は説明した。 それは「彼らの死で最高潮に達した」。
エイジレスマウス
概念実証として、研究チームは人間の70歳とほぼ同じ年齢の高齢マウスにベルテポルフィンを月にXNUMX回、XNUMXか月間注射した。
わずか XNUMX 週間で、ベルテポルフィンを投与したマウスでは、腎臓、肝臓、肺における老化の分子的兆候が減少しました。 彼らの毛皮は、薬物を投与していない対照マウスと比較してより豪華でした。
年齢を重ねると、免疫細胞が肺に入り込み、損傷を引き起こすことがよくあります。 ベルテポルフィンはこの浸潤を修復し、マウスの肺の瘢痕化を軽減しました。これは、多くの場合、呼吸能力の低下に関連しています。 同様に、血液検査によると、この薬はマウスの腎臓と肝臓の機能を回復するのにも役立ちました。
老化細胞の数が減少すると炎症シグナルが弱まり、これが若返り効果を説明できる可能性があると研究チームは説明した。 ベルテポルフィンはまた、老化細胞を死から守る「ガーディアン」タンパク質を停止させ、老化細胞の死滅をさらに引き起こしました。
ゾンビ細胞の固有の脆弱性を利用することは、老化細胞破壊研究の開発における新しい戦略です。 探索すべきことはまだたくさんあります。 生物廃棄物工場の細胞構成要素は小胞体だけではありません。 老化細胞毒を生成する他の細胞成分もブロックされ、細胞自体の除去に役立つ可能性があります。
これは、老化細胞を一掃するための既存の方法に代わる有望な代替手段です。 この戦略は「老化細胞破壊治療のカタログを大幅に拡大する」可能性があると研究チームは書いている。
画像クレジット: アポトーシスを起こしている HeLA 細胞。 トム・ディアリンク/NIH/FLICKR
- SEO を活用したコンテンツと PR 配信。 今日増幅されます。
- PlatoData.Network 垂直生成 Ai。 自分自身に力を与えましょう。 こちらからアクセスしてください。
- プラトアイストリーム。 Web3 インテリジェンス。 知識増幅。 こちらからアクセスしてください。
- プラトンESG。 カーボン、 クリーンテック、 エネルギー、 環境、 太陽、 廃棄物管理。 こちらからアクセスしてください。
- プラトンヘルス。 バイオテクノロジーと臨床試験のインテリジェンス。 こちらからアクセスしてください。
- 情報源: https://singularityhub.com/2023/11/07/zombie-cells-have-a-weakness-a-new-anti-aging-therapy-exploits-it/
- :持っている
- :は
- :not
- :どこ
- $UP
- 70
- a
- 能力
- 能力
- 私たちについて
- 従った
- 累積する
- 追加されました
- 後
- 年齢
- 高齢化
- すべて
- 許可
- 既に
- また
- 代替案
- 男
- an
- および
- 別の
- 承認された
- アーカイブ
- です
- AS
- At
- 離れて
- ボルティモア
- 戦闘
- BE
- き
- 以下
- より良いです
- 億
- ブロックされた
- 血
- 骨
- 生まれる
- 呼吸
- にぎやか
- 焙煎が極度に未発達や過発達のコーヒーにて、クロロゲン酸の味わいへの影響は強くなり、金属を思わせる味わいと乾いたマウスフィールを感じさせます。
- by
- 呼ばれます
- 缶
- 癌
- 容量
- カルロス
- カタログ
- 原因となる
- 細胞
- センター
- 中央の
- 化学物質
- 市町村
- クリーニング
- クリア
- 臨床
- 臨床試験
- コード
- 冷たい
- 闘う
- 組み合わせ
- comes
- 比べ
- コンポーネント
- コンポーネント
- コンセプト
- 定数
- 絶えず
- コントラスト
- 貢献する
- 貢献する
- コントロール
- 調整する
- 可能性
- クレジット
- CRISPR
- 重大な
- 損傷
- 損傷
- 死
- 十年
- 減少した
- より深い
- 提供します
- 目的地
- 開発
- 死
- 直接に
- 病気
- 混乱する
- 混乱した
- DNA
- ありません
- ダウン
- 薬
- 薬物
- 間に
- 各
- 早い
- エディタ
- 効果
- お年寄り
- 除去された
- 排除
- 緊急事態
- エンジニアリング
- 入力します
- 環境
- 同等の
- 本質的な
- あらゆる
- 例
- 既存の
- 詳細
- 実験的
- 説明する
- 説明
- エクスプロイト
- 探る
- 目
- 直面して
- 工場
- 工場
- 落下
- 有名
- 遠く
- より少ない
- もう完成させ、ワークスペースに掲示しましたか?
- 発見
- から
- function
- 機能
- さらに
- 生成する
- 遺伝子の
- 遺伝子工学
- 与えられた
- Go
- 壮大な
- 持っていました
- 害
- 有害な
- 害する
- 持ってる
- 健康
- 健康
- 助けます
- 助けました
- ことができます
- こちら
- ハイジャック
- ヒント
- ヒット
- お家の掃除
- 認定条件
- HTTPS
- 人間
- 人間
- 狩り
- 痛いです
- 考え
- 改善
- in
- 含めて
- の増加
- 内部
- を取得する必要がある者
- 整合性
- 内部
- に
- 主要株主
- 関係する
- IT
- ただ
- キープ
- 腎臓
- 腎臓
- 知識
- 既知の
- 漏れ
- レベル
- ライブラリ
- 一生
- ような
- リンク
- ライブ
- 肝臓
- ローカル
- 長い
- 見
- 探して
- 失う
- 豪華な
- make
- 多くの
- 大規模な
- 薬
- メソッド
- かもしれない
- ミス
- 分子の
- 月
- ヶ月
- 他には?
- 最も
- ずっと
- 多層
- の試合に
- 国民
- 国立衛生研究所
- 自然
- 近所の
- 新作
- 次の
- NIHの
- いいえ
- 通常の
- 通常は
- 鼻
- 今
- 番号
- of
- オフ
- 頻繁に
- 古い
- on
- かつて
- ONE
- もの
- の
- オプション
- or
- その他
- その他
- 私たちの
- でる
- 外側
- パッケージ
- パッケージ
- 支払われた
- ペア
- 紙素材
- のワークプ
- 実行する
- プラトン
- プラトンデータインテリジェンス
- プラトデータ
- 強力な
- ブランド
- 問題
- プロセス
- 生産性の高い
- 有望
- 証明
- 概念実証
- タンパク質
- タンパク質
- むしろ
- 本当に
- 電話代などの費用を削減
- レギュレータ
- リリース
- 削除します
- replace
- 研究
- 研究者
- 回答
- リストア
- ルーム
- ランニング
- 画面
- Seek
- 見えた
- いくつかの
- 形状
- 船
- 発送
- 示されました
- 示す
- 信号
- サイン
- 同様に
- 肌
- ゆっくり
- So
- 一部
- 起動
- 停止
- 戦略
- 強化
- 構造
- 構造
- 勉強
- 続いて
- 提案する
- 表面
- 周囲の
- 生存
- 症状
- ターゲット
- チーム
- テスト
- より
- それ
- アプリ環境に合わせて
- それら
- 自分自身
- その後
- そこ。
- ボーマン
- 彼ら
- この
- それらの
- 〜へ
- 変換
- 翻訳する
- 治療する
- 治療
- トリートメント
- トライアル
- 試験
- トリガ
- トリガー
- オン
- 2
- 受ける
- ユニーク
- us
- つかいます
- 中古
- 貴重な
- 容器
- 脆弱性
- ました
- 無駄
- 仕方..
- we
- 弱点
- 週間
- went
- した
- ぬれました
- この試験は
- いつ
- which
- while
- 誰
- 全体
- Wikipedia
- ワイルド
- ワイプ
- ワイピング
- 以内
- 無し
- 不思議
- 仕事
- 作品
- でしょう
- 書いた
- 年
- まだ
- ゼファーネット
- ゾンビ