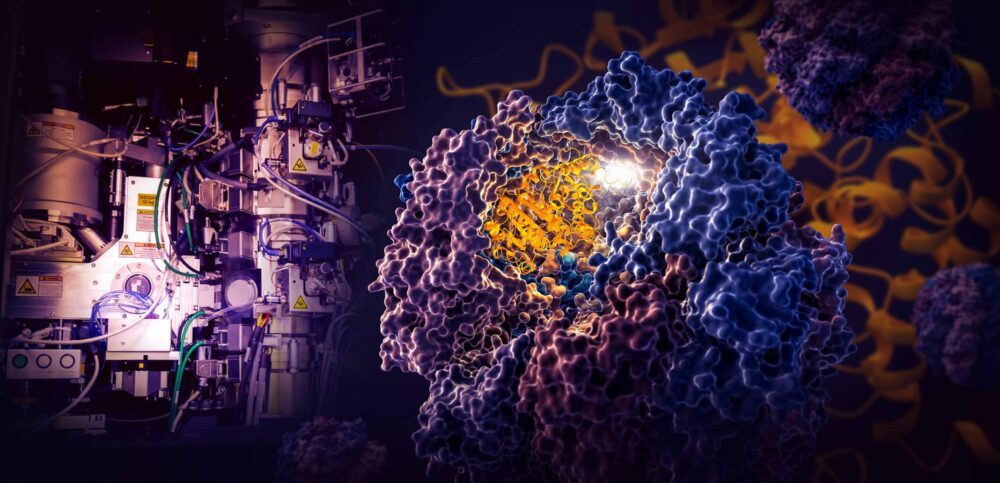
Een baanbrekende studie door onderzoekers van het SLAC National Accelerator Laboratory van het Department of Energy en Stanford University onthult hoe een kleine cellulaire machine genaamd TRiC de vouwing van tubuline stuurt, een menselijk eiwit dat de bouwsteen is van microtubuli die dienen als de steiger en het transportsysteem van de cel .
Tot nu toe dachten wetenschappers dat TRiC en soortgelijke machines, bekend als chaperonins, passief een omgeving bieden die bevorderlijk is voor vouwen, maar er niet direct aan deelnemen.
Tot 10% van de eiwitten in onze cellen, evenals die in planten en dieren, krijgen praktische hulp van deze kleine kamers bij het vouwen tot hun definitieve, actieve vormen, schatten de onderzoekers.
Veel van de eiwitten die zich vouwen met behulp van TRiC zijn nauw verbonden met ziekten bij de mens, waaronder bepaalde vormen van kanker en neurodegeneratieve aandoeningen zoals de ziekte van Parkinson, Huntington en Alzheimer, zei Stanford Professor Judith Frydman, een van de hoofdauteurs van de studie.
In feite, zei ze, zijn veel medicijnen tegen kanker ontworpen om tubuline en de microtubuli die het vormt, die erg belangrijk zijn voor celdeling, te verstoren. Dus het richten op het TRiC-geassisteerde tubuline-vouwproces zou een aantrekkelijke antikankerstrategie kunnen zijn.
Het team rapporteerde de resultaten van hun tien jaar durende studie in een paper gepubliceerd in Cel <p></p>
"Dit is de meest opwindende eiwitstructuur waaraan ik in mijn 40-jarige carrière heb gewerkt," zei SLAC / Stanford Professor Wah Chiu, een pionier in het ontwikkelen en gebruiken van cryogene elektronenmicroscopie (cryo-EM) en directeur van SLAC's cryo-EM en bioimaging divisie.
“Toen ik Judith 20 jaar geleden ontmoette,” hij zei, “We spraken erover of we eiwitten konden zien vouwen. Dat is iets wat mensen al jaren proberen te doen, en nu hebben we het gedaan.”
De onderzoekers legden vier verschillende stappen vast in het TRiC-gerichte vouwproces met bijna atomaire resolutie met cryo-EM, en bevestigden wat ze zagen met biochemische en biofysische analyses.
Op het meest basale niveau, zei Frydman, lost deze studie het al lang bestaande raadsel op waarom tubuline niet kan vouwen zonder de hulp van TRiC: "Het is echt een game-wisselaar om eindelijk een nieuwe manier te bieden om te begrijpen hoe eiwitten zich in de menselijke cel vouwen."
Spaghetti in bloemen vouwen
Eiwitten spelen een essentiële rol in vrijwel alles wat een cel doet, en ontdekken hoe ze zich vouwen tot hun uiteindelijke 3D-toestanden is een van de belangrijkste zoektochten in de chemie en biologie.
Zoals Chiu het zegt, "Een eiwit begint als een reeks aminozuren die eruitziet als spaghetti, maar het kan pas functioneren als het is gevouwen tot een bloem met precies de juiste vorm."
Sinds het midden van de jaren vijftig is ons beeld van hoe eiwitten zich vouwen gevormd door experimenten met kleine eiwitten door onderzoeker Christian Anfinsen van de National Institutes of Health. Hij ontdekte dat als hij een klein eiwit uitvouwde, het spontaan terug zou springen in dezelfde vorm, en concludeerde dat de aanwijzingen om dat te doen waren gecodeerd in de aminozuursequentie van het eiwit. Anfinsen deelde in 1950 de Nobelprijs chemie voor deze ontdekking.
Dertig jaar later ontdekten onderzoekers dat gespecialiseerde cellulaire machines eiwitten helpen vouwen. Maar de heersende opvatting was dat hun functie beperkt was tot het helpen van eiwitten om hun spontane vouwing uit te voeren door ze te beschermen tegen vast komen te zitten of samen te klonteren.
Eén type helpermachine, een chaperonine genaamd, bevat een tonachtige kamer die eiwitten binnenin houdt terwijl ze vouwen. TRiC past in deze categorie.
De TRiC-kamer is uniek omdat deze bestaat uit acht verschillende subeenheden die twee gestapelde ringen vormen. Een lange, dunne streng tubuline-eiwit wordt in de opening van de kamer gebracht door een hulpmolecuul in de vorm van een kwal. Dan sluit het deksel van de kamer en begint het vouwen. Als het klaar is, gaat het deksel open en gaat de afgewerkte, gevouwen tubuline weg.
Aangezien tubuline niet kan vouwen zonder TRiC, leek het erop dat TRiC meer kan doen dan passief tubuline helpen spontaan te vouwen. Maar hoe werkt dat precies? Deze nieuwe studie beantwoordt die vraag en toont aan dat, althans voor eiwitten zoals tubuline, het concept van "spontane vouwing" niet van toepassing is. In plaats daarvan orkestreert TRiC direct de vouwroute die leidt naar het correct gevormde eiwit.
Hoewel recente ontwikkelingen in kunstmatige intelligentie, of AI, de voltooide, gevouwen structuur van de meeste eiwitten kunnen voorspellen, zei Frydman, laat AI niet zien hoe een eiwit zijn juiste vorm bereikt. Deze kennis is fundamenteel voor het beheersen van vouwing in de cel en het ontwikkelen van therapieën voor vouwziekten. Om dit doel te bereiken, moeten onderzoekers de gedetailleerde stappen van het vouwproces uitzoeken zoals het in de cel plaatsvindt.
Een cellulaire kamer neemt de leiding
Tien jaar geleden besloten Frydman, Chiu en hun onderzoeksteams om dieper in te gaan op wat er in de TRIC-kamer gebeurt.
"Vergeleken met de eenvoudigere vouwkamers van chaperonines in bacteriën, is de TRiC in menselijke cellen een zeer interessante en gecompliceerde machine," zei Frydman. "Elk van de acht subeenheden heeft verschillende eigenschappen en presenteert een apart oppervlak in de kamer, en dit blijkt erg belangrijk te zijn."
De wetenschappers ontdekten dat de binnenkant van deze unieke kamer het vouwproces op twee manieren stuurt.

(Yanyan Zhao/Stanford Universiteit)
Als het deksel van de kamer over een eiwit sluit, verschijnen er gebieden met elektrostatische lading op de binnenwanden. Ze trekken tegengesteld geladen delen van de tubuline-eiwitstreng aan en kleven ze in wezen aan de wand om de juiste vorm en configuratie te creëren voor de volgende stap in het vouwen. Ondertussen grijpen de "staarten" van de TRiC-subeenheid die aan de kamerwand bungelen, op specifieke tijden en plaatsen het tubuline-eiwit vast om het te verankeren en te stabiliseren.
Om te beginnen haakt het ene uiteinde van de tubulinestreng in een klein zakje in de muur en vouwt het. Dan wordt het andere uiteinde op een andere plek bevestigd, waardoor een grote lus ontstaat. De lus vouwt op een manier die hem direct naast het eerste gevouwen gebied brengt.
In stap drie vouwt een deel van het middelste gedeelte zich om de kern van het eiwit te vormen, samen met holtes waar GTP, een molecuul dat energie opslaat en vrijgeeft om het werk van de cel aan te drijven, kan worden aangesloten.
Ten slotte vouwt het resterende eiwitgedeelte. Het tubulinemolecuul is nu klaar voor actie.
"Deze structurele snapshots van tussenstadia in de vouwvolgorde zijn nog nooit eerder gezien door cryo-elektronenmicroscopie," zei Frydman.
Een krachtige mix van technieken
Haar team bevestigde de vouwvolgorde met een uitdagende reeks biochemische en biofysische tests die jaren werk vergden.
Door die resultaten te interpreteren, konden de onderzoekers een beeld vormen van de veranderende vorm van de tubuline terwijl deze zich in de TRiC-kamer vouwt, wat overeenkwam met de beelden die door cryo-EM werden gegenereerd.
"Het is heel krachtig om tussen deze technieken heen en weer te kunnen gaan, omdat je dan echt kunt weten dat wat je ziet een weerspiegeling is van wat er in de cel gebeurt," zei Frydman.
"De wetenschap heeft ons verrast met een heel interessante oplossing die ik niet had voorspeld."
De studie biedt ook aanwijzingen om te begrijpen hoe dit vouwsysteem is geëvolueerd in eukaryote cellen, die deel uitmaken van planten, dieren en mensen, maar niet in eenvoudigere cellen zoals die van bacteriën en archaea. Naarmate eiwitten steeds complexer werden om aan de behoeften van eukaryote cellen te voldoen, suggereren de onderzoekers, konden ze op een gegeven moment niet meer vouwen tot de vormen die ze nodig hadden om meer gecompliceerde taken uit te voeren zonder een beetje hulp. Eukaryote eiwitten en hun chaperoninekamer zijn waarschijnlijk samen geëvolueerd, mogelijk beginnend met de laatste gemeenschappelijke voorouder van alle eukaryote organismen zo'n 2.7 miljard jaar geleden.
Vanwege de complexiteit van de analyses en het pandemische intermezzo duurde het onderzoek zo lang dat veel van de mensen die eraan werkten, zijn doorgestroomd naar andere banen. Ze omvatten postdoctorale onderzoekers Daniel Gestaut en Miranda Collier van de groep van Frydman, die het biochemische deel van het project uitvoerden en vooruit duwden, en Yanyan Zhao, Soung-Hun Roh, Boxue Ma en Greg Pintilie van de groep van Chiu, die de cryo uitvoerden. -EM-analyses. Andere bijdragers waren onder meer Junsun Park, een student in Roh's groep, en Alexander Leitner van ETH in Zürich, Zwitserland.
Het werk werd ondersteund door subsidies aan Wah Chiu en Judith Frydman van de NIH en subsidies aan Soung-Hun Roh, die nu assistent-professor is aan de Seoul National University, van de Korean National Research Foundation en de Suh Kyungbae Foundation (SUHF).
Journal Reference
- Daniel Gestaut et al., Structurele visualisatie van de tubuline-vouwroute aangestuurd door menselijk chaperonine TRiC/CCT. Cel, 8 december 2022 DOI: 10.1016 / j.cell.2022.11.014