Rick Young er professor i biologi ved MIT som studerer RNA som er transkribert fra den delen av genomet som ikke koder for proteiner, kjent som ikke-kodende DNA. Denne delen av genomet ble en gang referert til som "søppel-DNA", noe som gir deg en følelse av hva mange mente om verdien. Forskere ble overrasket over å oppdage at det utgjør 98 % av det menneskelige genomet, noe som utløste en søken etter å finne funksjonene.
I denne samtalen chatter Rick Young med Hanne Winarsky fra Bio Eats World og a16z general partner Jorge Conde, som leder investeringer i skjæringspunktet mellom biologi, informatikk og ingeniørfag. Før han begynte i a16z, var Conde Chief Strategy Officer i Syros Pharmaceuticals og var med på å grunnlegge genomikktolkningsselskapet Knome.
Samtalen dekker det vi har lært om at 98 % av genomet vi trodde var søppel. Det viser seg at den har forskjellige jobber, alt fra å skjule bevisene på eldgamle virusinfeksjoner til å få hvert ansikt til å se unikt ut. De diskuterer også dens massive, men fortsatt dårlig forståtte rolle i sykdom, og hvordan studering av søppel-DNA førte til oppdagelsen av en genav/på-bryter som ingen forventet.
Merk: denne samtalen ble opprinnelig publisert som en episode av Bio Eats World. Du kan høre på den episoden her..
HANNE WINARSKY: Vi er her for å snakke i dag om det som kalles søppel-DNA. Kan vi starte med en enkel definisjon?
RICK YOUNG: Det er omtrent et halvt århundre gammelt begrep. Forskere visste om deler av genomet som ikke koder for proteiner, og de teoretisert at dette var useriøst. Vi visste at noe av det bare var restene av gamle virale invasjoner av genomet. Men den setningen, søppel-DNA, har hjemsøkt oss.
HANNE: Så hva er begrepet du prøver å bruke i stedet? Det mørke DNA-stoffet som vi forstår mer om hver dag?
RICK: Ikke-kodende DNA.
HANNE: Hvorfor tenkte de på det som detritus? Du har nevnt at noe av det var rester av gamle virusbiter. Men hvorfor var det ikke bare et mysterium fra begynnelsen?
RICK: Fordi gjennom den biologiske historien var det denne debatten om hva som var arvestoffet, og i utgangspunktet ble det antatt å være protein. Men når det ble klart at protein var maskineriet og DNA var planen for maskineriet, ble folk opptatt med maskineriet fordi feil i maskineriet forårsaker sykdom. Men så viste det seg at bare 2 % av genomet koder for aminosyrene for proteiner. De aller fleste, 98 %, gjør det ikke. Og i 2000, da forskere fra Human Genome Project presentert den menneskelige genomsekvensen, at data bekreftet at 98 % av våre 3.2 milliarder baser ikke koder for proteiner.
Hvert gen har den bemerkelsesverdige evnen til å ta biter og biter av segmenter av proteinet som det vil kode og ordne det slik at produktet du får i en celle kan virke litt raskere, eller i en annen celle kan faktisk gå inn i en annen celle. avdeling for å gjøre en annen jobb.
JORGE CONDE: Hva var de første estimatene for hvor mange gener som ville bli kodet i disse 3.2 milliarder baseparene?
RICK: Vi slo oss på rundt 100,000 XNUMX. Vi antok bare at jo mer komplekse vi er, desto større er genomet, og jo større antall gener. Det ble litt av et sjokk da vi skjønte at vi og insekter har omtrent like mange gener.
JORGE: Færre gener enn vi forventet koder for det vi anser for å være en utrolig kompleks organisme, ikke sant?
HANNE: Det er litt av et sjokk.
Samme kildekode, forskjellige programmer
JORGE: En ting vi alle lærte på videregående er at DNA-koder for RNA, RNA-koder for aminosyrer, og aminosyrer gir oss proteiner, ikke sant? Det er det sentrale dogmet i moderne biologi.
RICK: Jepp. En av de store grunnene til at folk var raske til å tilskrive tittelen "søppel-DNA" til at 98 % av genomet som ikke koder for proteiner, er fordi man i stor grad trodde at forretningsenden av genomet var å lage proteiner.
JORGE: Så når begynte genetikere å få en anelse om at søppel-DNA kan være mer enn søppel?
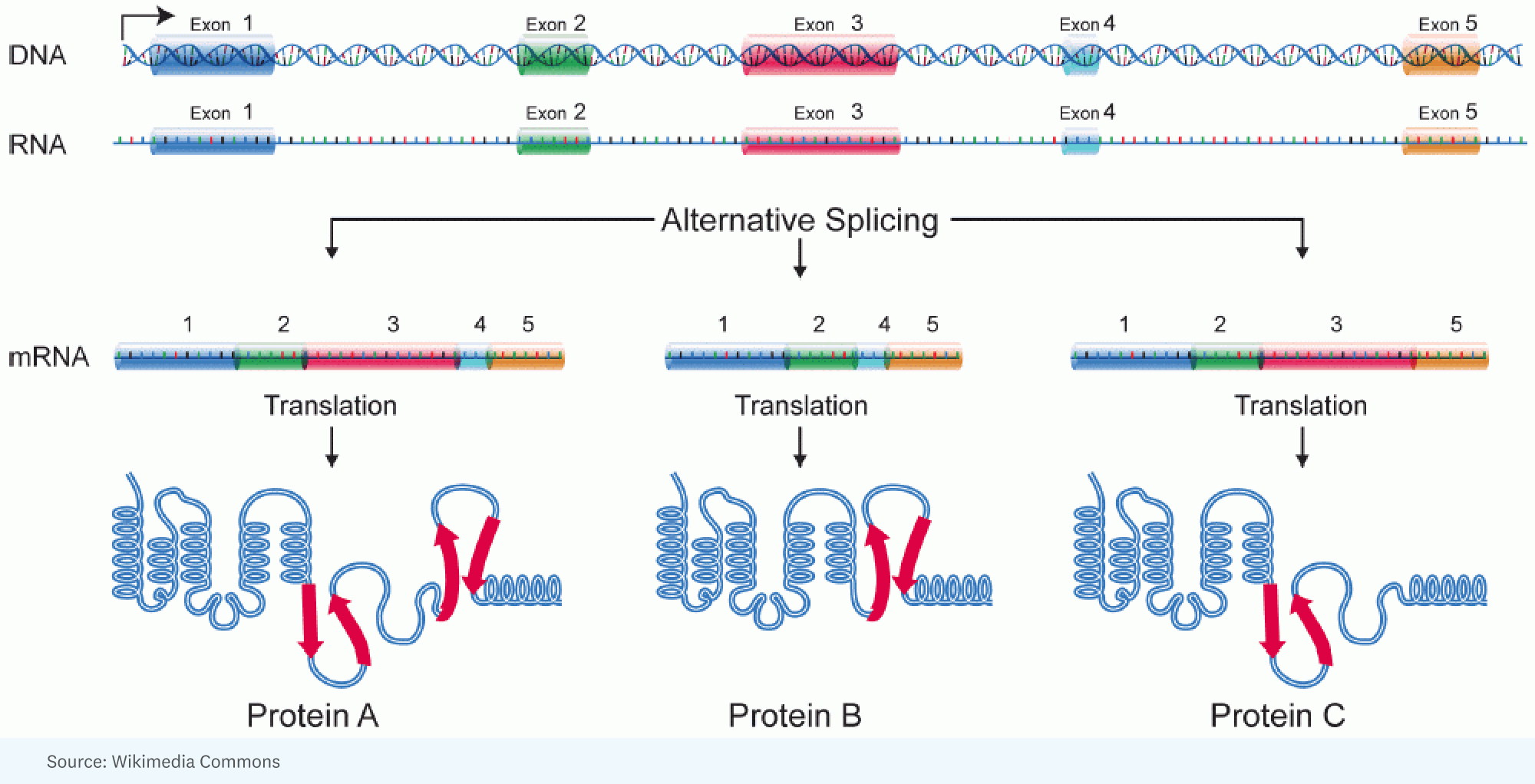
RICK: [Det startet med] erkjennelsen av at du kunne forklare den ekstra kompleksiteten hos mennesker kontra insekter ved en enorm mengde alternativ spleising. Det er der du har, for et enkelt gen, et stort RNA som er laget, men det blir spleiset annerledes i en celle kontra en annen celle. Med andre ord, forskjellige deler av genet havner i RNA-molekylet som skal spesifisere proteinet. Så proteinet er litt annerledes.
HANNE: Det høres ut som et kaleidoskop litt med lys som treffer det annerledes, du får forskjellige farger, forskjellige vinkler.
RICK: Vel, og det er en interessant analogi. Jeg tror en bedre analogi er når du har disse legoene, og du kan lage en maskin, men du kan lage den på så mange forskjellige måter, så mange forskjellige strukturer, farger. Hvert gen har den bemerkelsesverdige evnen til å ta biter og biter av segmenter av proteinet som det vil kode og ordne det slik at produktet du får i en celle kan virke litt raskere, eller i en annen celle kan faktisk gå inn i en annen celle. avdeling for å gjøre en annen jobb.
JORGE: Hver enkelt celle i et gitt menneske har omtrent det samme genomet. Likevel gir det samme genomet opphav til et utrolig mangfoldig utvalg av forskjellige celletyper. Og så i den grad vi skal lage en analogi, kjører hver celletype et annet program fra den samme kildekoden.
RICK: Det stemmer.
Funksjonene til 98%
JORGE: Du trenger ikke å være ekspert for å se på forskjellige celletyper og se hvor varierte de kan være, ikke sant? Et nevron ser veldig, veldig, veldig annerledes ut og fungerer veldig, veldig annerledes enn for eksempel en muskelcelle. Hva bestemmer programmet, det genetiske programmet som en celle velger å kjøre? Hva gjør en muskelcelle til en muskelcelle, og hva gjør en nevron til en nevron?
RICK: Så vi startet med at DNA lager RNA og [RNA] lager protein. Det er det sentrale dogmet. Men for omtrent et halvt århundre siden begynte forskere å argumentere for at RNA faktisk begynte å lage ulike typer funksjoner helt på egen hånd. Og det viser seg at RNA faktisk har noe av aktiviteten på de tidligste utviklingsstadiene.
Når sædcellene møter egget, er det morens RNA hun legger i egget. Det er RNA-molekyler som gjør dette. Det viser seg at antibiotika som vi bruker rutinemessig binder seg til RNA. Så RNA har noen ganske viktige roller der. Det endret måten folk tenker på. Da vi begynte å tenke på søppel-DNA, er det den delen av DNA som ikke koder for protein. Vel, hva om verden er basert på RNA og ikke protein, i det minste på begynnelse? Og nå forstår vi at en stor brøkdel av det vi kaller søppel-DNA, eller det vi pleide å kalle søppel-DNA, ikke er søppel. Den er svært funksjonell. Og det meste av det lager RNA.
Så målet ditt med å programmere en celle er å bruke akkurat det spesifikke settet med sekvenser som vil stille inn hvert av det vanlige settet med gener til det nivået du ønsker. . . .Problemet vårt er at vi faktisk ikke kjenner programmet.
HANNE: Wow. Kan du gjøre litt av landet hvor vi er når det gjelder å forstå den ikke-kodende delen av DNA? Du vet, hva er vår nåværende forståelse av alle de forskjellige mulighetene der?
RICK: Bare 2 % av genomet vårt koder for disse aminosyresekvensene som går inn i proteiner. Så hva står på regnskapsboken vår for hva resten gjør?
Omtrent halvparten av genomet vårt er det vi kaller heterokromatin. Det er der du får produktene fra eldgamle virale invasjoner. Gamle retrovirus invaderte, og ble deretter omgjort til DNA, og de ble satt inn i genomet. Så det er faktisk et middel vi har hatt gjennom hele vår evolusjonshistorie for å gjemme bort sekvenser som vi ikke ønsker å forholde oss til. Og det forblir stille i genomet vårt med et viktig unntak.
Den andre halvparten er der alle de aktive proteinkodende genene er, og hvor alle de aktive ikke-kodende genene er. Så, hva gjør det? Den har en lang liste med regulatoriske funksjoner, men jeg skal forenkle den til tre.
En av funksjonene er kromosomvedlikehold. Så det er stedene der DNA-replikasjon skjer. De er stedene i genomet vårt som er ansvarlige for å brette det sammen fordi det er en 2 meter lang polymer. Den må brettes sammen til en kjerne med en diameter på et par mikrometer.
Den andre regulatoriske regionen er alle disse tingene som er ansvarlige for genregulering. Sannsynligvis spesifiserer mye mer av genomet regulatoriske trekk for genuttrykk enn spesifiserer genene selv. Og det er fordi hver celle bruker en annen regulatorisk region for hvert gen.
HANNE: Det er så interessant, det høres for meg litt nesten ut som om det er skapet med hyllene på av ting vi må ha i skapet en liten stund, og så er det infrastrukturskapet.
Hvorfor er det viktig å fokusere så mye på dette? For det er der over 75 % av all sykdomsassosiert genetisk variasjon oppstår.
RICK: Ja. I utgangspunktet er det du har et felles sett med gener i hver celle, både kodende og ikke-kodende. Og du har elementer, du har faktiske sekvenser som bare fungerer i bestemte celletyper. Så målet ditt med å programmere en celle er å bruke akkurat det spesifikke settet med sekvenser som vil stille inn hvert av det vanlige settet med gener til det nivået du ønsker. Så du spiller et fantastisk musikkinstrument med 20,000 XNUMX proteinkodende gener, og omtrent samme antall ikke-kodende gener. Du gjør det gjennom spesifikke sekvenser. Problemet vårt er at vi faktisk ikke kjenner programmet.
Erter ut reguleringsprogrammet
HANNE: Så hvordan begynner du å finne ut av det? Hva er hintene du følger når du begynner å prøve å forstå dette programmet?
RICK: Hintene er at de regulatoriske områdene for hvert gen i en celle viser seg selv. De forteller deg. Og du kan bruke ulike teknologiers som veldig raskt forteller deg på tvers av hele genomet, i en bestemt celletype, la oss si i en motorneuron, hva er alle de regulatoriske områdene som er på i den cellen. Du kan til og med se hvor reostaten er satt for hvert av disse genene. Det er der rask sekvensering har gitt oss disse evnene til samtidig å utlede alle de aktive elementene for gener, både koder og ikke-koder i genomet til en bestemt celletype.
Problemet vårt for øyeblikket er at du må gjøre dette stort sett én celletype om gangen, og vi har mange, mange hundre celletyper. Noen ganger er det vanskelig å faktisk se en bestemt celle uten å forurense med andre celler, fordi alt vårt vev egentlig er kombinasjoner av flere celletyper.
JORGE: Er det verdt å argumentere analogt hvis vi sa at gitt at hver celle har hele genomet, hver celle har hele sangboken, bestemte celletyper velger å spille spesifikke symfonier, og maskineriet som hjelper til med å regulere genomet er i hovedsak lederen av orkesteret? Det maskineriet er dirigenten som bestemmer hvilke sanger som skal spilles, hvilke toner som skal treffes, med hvilket volum de skal treffes, i hvilket tempo osv. Er det en rimelig analogi til å forstå genomets regulatoriske funksjon?
RICK: Det er i den forstand at det er lett å se hva resultatet blir. Men det som er mer utfordrende er, hvem skriver alle notatene? Hvem er komponisten som la alle notene der, og fikk det til? Komponisten viser seg å være, for de fleste av cellene våre og de fleste av genene våre, disse proteinmolekylene som kalles transkripsjonsfaktorer, hvis jobb det er å binde seg til de regulerende elementene i gener, og gi dem en reostatisk setting.
Nå er det en interessant rynke i dette fordi på de stedene der disse transkripsjonsfaktorene binder seg, kaller vi dem en forsterker. På disse forsterkerstedene er det også alltid et RNA som lages fra det stedet hvor de er bundet. Vi har først nylig forstått at RNA spiller viktige roller i regulering. Bare for å forsterke det: Måten din iPhone gjenkjenner ansiktet ditt er fordi forsterkerne som kontrollerer gener for kranialansiktsstruktur varierer i hvert enkelt menneske.
Det du har nå her er dette triumviratet. Du har DNA-sekvensen. Det gjenkjennes spesifikt av det komponerende molekylet, transkripsjonsfaktoren, men det trenger dette tredje stykket, dette RNA-molekylet. Så DNA, RNA og protein fungerer faktisk sammen i de regulatoriske områdene. Og hvorfor er det viktig å fokusere så mye på dette? For det er der over 75 % av all sykdomsassosiert genetisk variasjon oppstår.
HANNE: Ikke for å bli for musikalsk nerdete, men det høres nesten ut som en akkord, ikke sant? Strukturen med tre toner spiller sammen for å skape noe større.
RICK: Det stemmer.
Programmererne
JORGE: Et av de mest avanserte områdene innen biologi er vår økende evne til å prøve å forstå noen av de styrende lovene for hvordan celleprogrammer bestemmes, hvordan celleskjebne bestemmes. For meg kom et av de fascinerende sprangene fremover i vår forståelse fra arbeidet som Yamanaka gjorde, som han ble tildelt prisen for Nobelprisen, som demonstrerer at du kan omprogrammere celletyper ved bare å eksponere celler for en svært liten håndfull spesifikke transkripsjonsfaktorer.
HANNE: Kan du beskrive hvorfor akkurat det var et slikt gjennombrudd for feltet?
RICK: Jeg hadde en liten rolle i den filmen. Det viser seg at selv om det er et veldig stort antall, kan et lite antall transkripsjonsfaktorer identifisere alle de regulatoriske elementene som er avgjørende for den cellens identitet. Og Yamanaka beviste dette for oss ved å vise at bare fire av disse faktorene kunne brukes til å programmere enhver menneskelig celle, eller en mannlig celle til ekvivalent med en embryonal stamcelle.
En måte å tenke på dette er, hvis sangen er for dårlig, lever ikke organismen. Men hvis det bare er litt av, vokser du opp, du blir voksen, og så får du alle disse forskjellige sykdommene når vi blir eldre.
JORGE: Og det er utrolig, ikke sant? Fordi det antyder at systemet på en eller annen måte er designet hvor utrolig kompleksitet er hentet fra det som høres ut som enkelhet. Fire transkripsjonsfaktorer som bestemmer all den komplekse kaskaden av hendelser som styrer forskjellige celletyper.
Noe av arbeidet du har gjort har vist at disse mastertranskripsjonsfaktorene i hovedsak setter opp ekvivalenten til kretser som kontrollerer genene som er nødvendige for at en celle skal etablere og opprettholde sin tilstand. Kan du beskrive hva du mener med genkontrollkretser?
RICK: Det er to kule elementer i genkontrollkretsene. Den ene er at når en masterregulator finner disse forsterkerne og forårsaker ekspresjonen av målgenene, er det en del av kretsen, det er utgangen. Det andre elementet som er så kult er at master transkripsjonsfaktorene også regulerer sitt eget uttrykk. Så det er en tilbakemeldingssløyfe. Som, du ville ha et elektrisk diagram der du har mesterne som kontrollerer sitt eget uttrykk fra sine egne gener, og deretter binder seg til og kontrollerer uttrykket av et målsett med gener.
JORGE: Det er ganske vilt. Det er nesten som en sirkulær referanse, der transkripsjonsfaktorer er protein, at protein er laget av DNA, kodet i et gen. Transkripsjonsfaktorer er en del av maskineriet som hjelper uttrykket ved transkripsjon av gener. Og derfor sier du at transkripsjonsfaktorer – proteinet – hjelper til med å regulere uttrykket av genene som lager transkripsjonsfaktorene.
HANNE: Ja. Det er et mentalt bilde av hele denne symfonien av alle disse små cellene, du vet, som synger ut alle disse forskjellige teksturene.
Det regulatoriske genomet og sykdom
HANNE: Hva endrer det seg når vi begynner å forstå hvordan alt dette fungerer? Hva kan vi gjøre med denne kunnskapen?
RICK: Disse stedene hvor disse hovedtranskripsjonsfaktorene driver hver celles identitet er der mesteparten av menneskelig variasjon forårsaker sykdom. Over 75 % av sykdomsassosiert variasjon forekommer i disse forsterkerelementene som driver nøkkelgenene.
JORGE: Ok. Så det er vilt, ikke sant? Når vi tenker på mutasjoner som forårsaker eller bidrar til sykdom, tenker vi vanligvis på en mutasjon som oppstår i et gen som påvirker proteinet, bryter proteinet på en eller annen måte, og som gir opphav til sykdom.
HANNE: Rett.
JORGE: Men du sier at i 75 % av tilfellene skjer den mutasjonen faktisk utenfor genene, den skjer i denne ikke-kodende regionen av genomet. Hvis genet er sangen, er det ikke det at sangen blir spilt feil, det er at den kanskje spilles for høyt, eller for mykt, eller for sakte eller for raskt, men det er det som driver mye sykdom.
RICK: Faktisk er en måte å tenke på dette på at hvis sangen er for dårlig, lever ikke organismen. Men hvis det bare er litt av, vokser du opp, du blir voksen, og så får du alle disse forskjellige sykdommene når vi blir eldre.
For første gang har vi alle disse modellene for hvordan du setter opp apparatet og får det til å fungere.
JORGE: Ikke lager feil versjon av genet, men får feil dosering av genet. For mye eller for lite.
RICK: Det er riktig. Hvordan finner du terapier som håndterer dette? Hvordan justerer du selektivt opp eller nedjusterer genet? I prinsippet kan vi gjøre det på mange måter, og det kan vi gjøre med genterapi. Vi kan gjøre det med CRISPR-genredigering. Men det viktigste jeg tror vi har oppdaget de siste årene er at hvert av disse genregulerende elementene har et RNA. RNA er funksjonelt. Det er en reostat som hjelper til med å justere utgangen til det genet. Det er nå mange måter du kan medikament-RNA. Vi har fått ASOer (antisense-oligonukleotider), slik som Spinraza for spinal muskelatrofi. Vi har RNA-interferens. Vi har noen nye småmolekylære medisiner i horisonten. Hvis du kunne tenke på måter å nå programmere et medikament, et syntetisk RNA, for å regulere regulator-RNA, det regulatoriske RNA, har du den viktigste måten å tune inn et hvilket som helst gen i en hvilken som helst celle der den cellen kan få tilgang til det stoffet.
HANNE: Så det er ikke bare en helt annen forståelse av hvordan sykdom oppstår. Men det er en helt annen forståelse av hvordan vi potensielt kan behandle sykdom.
RICK: Akkurat. I prinsippet har vi nå en programmerbar måte å utvikle et medikament som justerer et hvilket som helst gen av interesse. På dette tidspunktet programmerer folk ganske enkelt syntetiske RNA-molekyler for å produsere en vaksine for denne pandemien. En som er et så godt resultat som du noen gang kan forvente for en vaksine.
JORGE: Når vi tenker på søknadene til teknologi i biologi, vi prøver vanligvis å gjøre en av to ting. Enten prøver vi å undersøke biologi veldig dypt, og forstå den, øke nivåene av dens kompleksitet, eller så prøver vi å gripe inn. Vi er i økende grad i stand til å spørre biologi på et veldig, veldig dypt nivå, slik at vi forstår de styrende lovene eller reglene av hvordan celler reguleres. Og det har vi, vi har stadig mer sofistikerte verktøy, som disse programmerbare modaliteter for medisin, hvor vi kan målrette RNA, veldig, veldig spesifikt. Dette vil liksom være denne dydige syklusen mellom vår evne til å spørre biologi og deretter gripe inn på stadig mer sofistikerte måter. Og jeg tror det er en av de mest spennende aspektene ved hvor vi befinner oss i dag på dette feltet.
RICK: Jeg er enig med deg. Vi utvikler nå en så dyp forståelse av de mange lagene av kompleksitet, at vi kan komme opp med terapeutiske hypoteser som vi ikke har sett før. Vi kan gjøre dem med en hastighet som vi aldri ante for bare noen få år siden. Den tidsmessige avstanden mellom en grunnleggende oppdagelse og terapien som gikk inn i mennesker for 10 år siden var 14 år i gjennomsnitt. Nå kan det tenkes å utvikle en terapeutisk hypotese basert på grunnleggende vitenskap, og en terapi som når en pasient i løpet av ni måneder. Det er vi ser det med denne nye vaksinen.
HANNE: Så, endre ikke bare hvordan vi forstår sykdom som oppstår, hvordan vi behandler den, men også hvordan vi gjør vitenskapen selv, og deretter hvor raskt vitenskapen kan skje og bli til klinisk virkelighet for pasienter.
RNA som kompartmentalizer
RICK: Akkurat. Men nå er det prikken over i-en fordi vi klassisk har tenkt på farmakologi på to måter. Den ene var effekten av stoffet på individet. Den andre var effekten av individet på stoffet. Og i dette siste segmentet er du bekymret for distribusjon av stoffet, hvilket vev det går til, hvilket vev det ikke er tilgjengelig for. Fordi vi bare antar at når et stoff kommer inn i en celle, diffunderer det gjennom cellen og finner målet sitt. Vi har membranbundne rom, som vi har visst om i et århundre.
JORGE: Som alltid var spørsmålet om cellepermeabiliteten, ikke sant? Kan det krysse membranen?
RICK: Ja. Kan den krysse en membran, og kommer den inn i kjernen eller ikke? Men vi har først forstått det siste tiåret at det også er mange ikke-membranlegemer i celler som kalles biomolekylære kondensater fordi det antas at en grunn til at disse kroppene dannes er at de kondenserer omtrent som vann kondenserer til en duggdråpe. Men det som har vært så dyptgående med denne forståelsen er at disse kondensatene deler opp proteiner, DNA, RNA for spesifikke funksjoner. Og så nå har vi forstått at du kan separere de 5 til 10 milliarder protein- og RNA-molekylene i en celle i forskjellige rom hvor de fungerer sammen med vennene sine.
HANNE: Hehe.
JORGE: Forlater vi biologiens rike og går inn i fysikkens rike?
RICK: Vi har gjort akkurat det fordi faseseparasjon antas å være drivkraften. Det er et fysisk fenomen beskrevet av matematikk.
HANNE: Wow.
RICK: Nå har vi lært de mest effektive kjemoterapeutika er konsentrere inne i avdelingene der målene deres bor. De konsentrerer seg 600 ganger over resten av cellen, så de har aktivitet på onkogener som er 600 ganger hva vi forventet. Dette forteller oss ikke bare at det er helt ny innsikt som er viktig i legemiddeloppdagelse og utvikling for fremtiden, men det får oss til å ønske å bedre forstå hva disse kondensatene gjør.
Her er hva jeg mener med prikken over i-en. Det vi har innsett er at disse kondensatrommene som funksjonaliserer cellen på så viktige måter er regulert av RNA. Dannelsen deres kan stimuleres av RNA. Produserer du for mye RNA bringer du reostaten opp til 11, den vil løse opp et kondensat. Så plutselig innser vi at RNA-utgangen på et hvilket som helst sted inne i en celle kan justere funksjonen til hva som helst ved å forbedre eller oppløse de kondensatene der denne funksjonen oppstår. Og det er, tror jeg, dyptgripende fordi det er en annen måte som et programmerbart RNA, et syntetisk RNA-molekyl, kan brukes til å justere funksjonen til en celle som har blitt dysfunksjonell. For første gang har vi alle disse modellene for hvordan du setter opp apparatet og får det til å fungere.
HANNE: En annen knott å slå på.
RICK: Men hvordan slår du den av? Det viser seg at når du lager det lange RNA, så er det bare en stor streng av negative ladninger, og det løser opp kondensatet og stenger genet. Det er hvordan gener blir regulert. Du justerer kondensatet med et RNA, så slår du det ned med RNA-produktet som er laget når genet blir fullstendig transkribert.
HANNE: Superkul. Så en av og på bryter, egentlig.
RICK: Det er en av/på-bryter ingen forutså. Og det betyr nok en gang, hvis du har et programmerbart medikament, har du en ny måte å målrette cellulære funksjoner på som er dysfunksjonelle, en ny løsning for et terapeutisk problem.
JORGE: En manns søppel-DNA er en annen manns sofistikerte genomreguleringsmaskineri.
HANNE: Eller hver manns.
Lagt ut 15. juli 2022
Teknologi, innovasjon og fremtiden, som fortalt av de som bygger den.
- Andreessen Horowitz
- Bio og vitenskap
- Bitcoin
- blockchain
- blockchain-overholdelse
- blockchain konferanse
- coinbase
- coingenius
- Konsensus
- kryptokonferanse
- krypto gruvedrift
- cryptocurrency
- desentralisert
- Defi
- Digitale eiendeler
- ethereum
- maskinlæring
- ikke soppbart token
- plato
- plato ai
- Platon Data Intelligence
- Platoblokkjede
- PlatonData
- platogaming
- polygon
- bevis på innsatsen
- W3
- zephyrnet