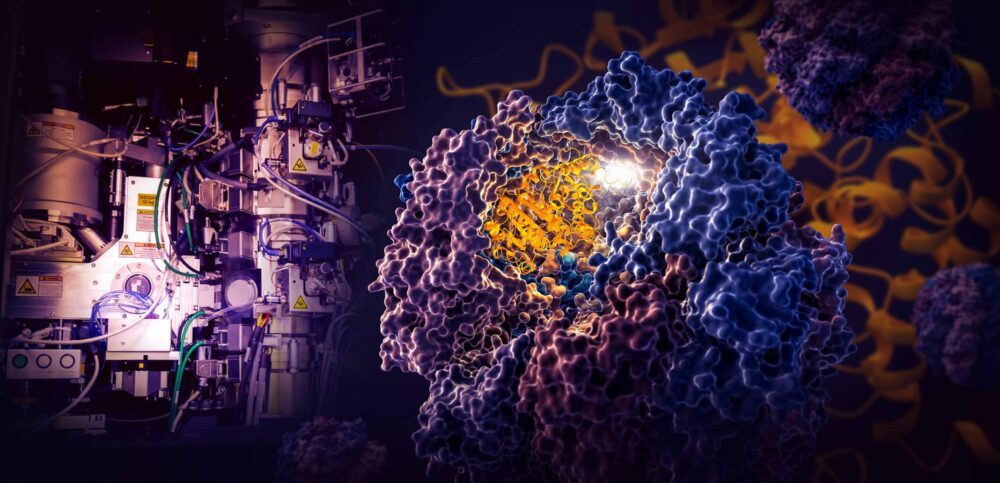
Przełomowe badanie przeprowadzone przez naukowców z SLAC National Accelerator Laboratory i Uniwersytetu Stanforda w Departamencie Energii ujawnia, w jaki sposób maleńka komórkowa maszyna o nazwie TRiC kieruje składaniem tubuliny, ludzkiego białka, które jest budulcem mikrotubul, które służą jako rusztowanie i system transportowy komórki .
Do tej pory naukowcy uważali, że TRiC i podobne maszyny, zwane białkami opiekuńczymi, pasywnie zapewniają środowisko sprzyjające fałdowaniu, ale nie biorą w nim bezpośredniego udziału.
Naukowcy oszacowali, że do 10% białek w naszych komórkach, a także w roślinach i zwierzętach, otrzymuje praktyczną pomoc z tych małych komór w składaniu się w ich ostateczne, aktywne kształty.
Wiele białek, które fałdują się za pomocą TRiC, jest ściśle powiązanych z chorobami człowieka, w tym niektórymi nowotworami i zaburzeniami neurodegeneracyjnymi, takimi jak choroba Parkinsona, choroba Huntingtona i choroba Alzheimera, powiedziała profesor Stanford Judith Frydman, jedna z głównych autorek badania.
Powiedziała, że w rzeczywistości wiele leków przeciwnowotworowych ma na celu zakłócenie tubuliny i tworzonych przez nią mikrotubul, które są naprawdę ważne dla podziału komórek. Zatem skupienie się na procesie fałdowania tubuliny wspomaganym przez TRiC może zapewnić atrakcyjną strategię przeciwnowotworową.
Zespół przedstawił wyniki swoich dziesięcioletnich badań w artykule opublikowanym w Komórka dzisiaj.
„To najbardziej ekscytująca struktura białkowa, nad którą pracowałem w mojej 40-letniej karierze” powiedział profesor SLAC/Stanford Wah Chiu, pionier w opracowywaniu i stosowaniu kriogenicznej mikroskopii elektronowej (cryo-EM) oraz dyrektor działu krio-EM i bioobrazowania SLAC.
„Kiedy 20 lat temu poznałem Judith” powiedział, „Rozmawialiśmy o tym, czy możemy zobaczyć fałdowanie białek. To jest coś, co ludzie próbowali zrobić od lat, a teraz to zrobiliśmy”.
Naukowcy uchwycili cztery odrębne etapy procesu fałdowania kierowanego przez TRiC w rozdzielczości bliskiej atomowi za pomocą krio-EM i potwierdzili to, co zobaczyli, analizami biochemicznymi i biofizycznymi.
Na najbardziej podstawowym poziomie, powiedział Frydman, badanie to rozwiązuje długotrwałą zagadkę, dlaczego tubulina nie może spasować się bez pomocy TRiC: „To naprawdę zmienia reguły gry, w końcu wprowadzając nowy sposób zrozumienia, w jaki sposób białka fałdują się w ludzkiej komórce”.
Składanie spaghetti w kwiaty
Białka odgrywają zasadniczą rolę praktycznie we wszystkim, co robi komórka, a odkrycie, w jaki sposób składają się w swoje końcowe stany 3D, jest jednym z najważniejszych zadań w chemii i biologia.
Jak to ujął Chiu, „Białko zaczyna się jako ciąg aminokwasów, który wygląda jak spaghetti, ale nie może funkcjonować, dopóki nie zostanie złożony w kwiat o odpowiednim kształcie”.
Od połowy lat pięćdziesiątych nasz obraz fałdowania białek był kształtowany przez eksperymenty przeprowadzane z użyciem małych białek przez badacza National Institutes of Health, Christiana Anfinsena. Odkrył, że gdyby rozwinął małe białko, samoistnie odskoczyłoby ono z powrotem do tego samego kształtu i doszedł do wniosku, że wskazówki, jak to zrobić, są zakodowane w sekwencji aminokwasowej białka. Anfinsen podzielił się Nagrodą Nobla z 1950 r chemia za to odkrycie.
Trzydzieści lat później naukowcy odkryli, że wyspecjalizowane maszyny komórkowe pomagają w fałdowaniu białek. Jednak panował pogląd, że ich funkcja ograniczała się do wspomagania białek w ich spontanicznym fałdowaniu, chroniąc je przed uwięzieniem lub zlepianiem się.
Jeden rodzaj maszyny pomocniczej, zwany chaperoniną, zawiera komorę przypominającą beczkę, w której przechowywane są białka podczas ich składania. TRiC pasuje do tej kategorii.
Komora TRiC jest wyjątkowa, ponieważ składa się z ośmiu różnych podjednostek, które tworzą dwa ułożone w stos pierścienie. Długie, cienkie pasmo białka tubuliny jest dostarczane do otworu komory przez cząsteczkę pomocniczą w kształcie meduzy. Następnie pokrywa komory zamyka się i rozpoczyna się składanie. Po zakończeniu wieczko otwiera się i gotowa, złożona tubulina wychodzi.
Ponieważ tubulina nie może zwijać się bez TRiC, wydawało się, że TRiC może zrobić więcej niż bierne wspomaganie spontanicznego fałdowania tubuliny. Ale jak to dokładnie działa? To nowe badanie odpowiada na to pytanie i pokazuje, że przynajmniej w przypadku białek takich jak tubulina koncepcja „spontanicznego fałdowania” nie ma zastosowania. Zamiast tego TRiC bezpośrednio koordynuje ścieżkę fałdowania prowadzącą do prawidłowo ukształtowanego białka.
Chociaż ostatnie postępy w sztucznej inteligencji lub sztucznej inteligencji mogą przewidzieć gotową, złożoną strukturę większości białek, powiedział Frydman, sztuczna inteligencja nie pokazuje, w jaki sposób białko osiąga swój prawidłowy kształt. Ta wiedza ma fundamentalne znaczenie dla kontrolowania fałdowania w komórce i opracowywania terapii chorób fałdowych. Aby osiągnąć ten cel, naukowcy muszą poznać szczegółowe etapy procesu fałdowania zachodzącego w komórce.
Komora komórkowa przejmuje kontrolę
Dziesięć lat temu Frydman, Chiu i ich zespoły badawcze postanowili zagłębić się w to, co dzieje się w komorze TRIC.
„W porównaniu z prostszymi składanymi komorami białek opiekuńczych u bakterii, TRiC w ludzkich komórkach jest bardzo interesującą i skomplikowaną maszyną” — powiedział Frydmann. „Każda z jego ośmiu podjednostek ma inne właściwości i prezentuje odrębną powierzchnię wewnątrz komory, a to okazuje się być naprawdę ważne”.
Naukowcy odkryli, że wnętrze tej wyjątkowej komory kieruje procesem składania na dwa sposoby.

(Yanyan Zhao/Uniwersytet Stanforda)
Gdy pokrywa komory zamyka się nad białkiem, na jej wewnętrznych ścianach pojawiają się obszary ładunku elektrostatycznego. Przyciągają one przeciwnie naładowane części nici białkowej tubuliny i zasadniczo przyczepiają je do ściany, tworząc odpowiedni kształt i konfigurację do następnego etapu składania. Tymczasem „ogony” podjednostki TRiC, które zwisają ze ściany komory, chwytają białko tubuliny w określonych momentach i miejscach, aby je zakotwiczyć i ustabilizować.
Na początek jeden koniec nitki tubuliny zaczepia się o małą kieszonkę w ścianie i składa. Następnie drugi koniec przyczepia się w innym miejscu, tworząc dużą pętlę. Pętla składa się w sposób, który przenosi ją tuż obok pierwszego złożonego obszaru.
W kroku trzecim część środkowej części składa się, tworząc rdzeń białka, wraz z kieszeniami, w których może się podłączyć GTP, cząsteczka przechowująca i uwalniająca energię potrzebną do zasilania pracy komórki.
Na koniec pozostała część białka składa się. Cząsteczka tubuliny jest teraz gotowa do działania.
„Te strukturalne migawki pośrednich etapów sekwencji fałdowania nigdy wcześniej nie były widziane przez mikroskopię krioelektronową” — powiedział Frydmann.
Potężna mieszanka technik
Jej zespół potwierdził sekwencję fałdowania za pomocą trudnej serii testów biochemicznych i biofizycznych, które wymagały lat pracy.
Interpretacja tych wyników pozwoliła naukowcom zbudować obraz zmieniającego się kształtu tubuliny podczas jej składania w komorze TRiC, który pasował do obrazów generowanych przez krio-EM.
„Możliwość przełączania się między tymi technikami jest bardzo potężna, ponieważ wtedy naprawdę możesz wiedzieć, że to, co widzisz, odzwierciedla to, co dzieje się w komórce” — powiedział Frydmann.
„Nauka zaskoczyła nas naprawdę interesującym rozwiązaniem, którego bym nie przewidział”.
Badanie dostarcza również wskazówek do zrozumienia, w jaki sposób ten system fałdowania ewoluował w komórkach eukariotycznych, z których składają się rośliny, zwierzęta i ludzie, ale nie w prostszych komórkach, takich jak komórki bakterii i archeonów. Naukowcy sugerują, że w miarę jak białka stawały się coraz bardziej złożone, aby zaspokajać potrzeby komórek eukariotycznych, w pewnym momencie nie mogły one złożyć się w kształty potrzebne do wykonywania bardziej skomplikowanych zadań bez niewielkiej pomocy. Białka eukariotyczne i ich komora opiekuńcza prawdopodobnie ewoluowały razem, prawdopodobnie zaczynając od ostatniego wspólnego przodka wszystkich organizmów eukariotycznych około 2.7 miliarda lat temu.
Ze względu na złożoność analiz i przerwę związaną z pandemią badanie trwało tak długo, że wiele osób, które nad nim pracowały, przeszło do innych zawodów. Należą do nich habilitowani badacze Daniel Gestaut i Miranda Collier z grupy Frydmana, którzy przeprowadzili biochemiczną część projektu i popchnęli go do przodu, oraz Yanyan Zhao, Soung-Hun Roh, Boxue Ma i Greg Pintilie z grupy Chiu, którzy wykonali krio -analizy EM. Dodatkowymi współpracownikami byli Junsun Park, student z grupy Roh, oraz Alexander Leitner z ETH w Zurychu w Szwajcarii.
Praca została wsparta grantami dla Wah Chiu i Judith Frydman z NIH oraz grantami dla Soung-Hun Roh, który jest obecnie adiunktem na Uniwersytecie Narodowym w Seulu, z Korean National Research Foundation i Suh Kyungbae Foundation (SUHF).
Referencje czasopisma
- Daniel Gestaut i wsp., Wizualizacja strukturalna szlaku fałdowania tubuliny kierowanego przez ludzką chaperoninę TRiC/CCT. Komórka, 8 grudnia 2022 DOI: 10.1016 / j.cell.2022.11.014