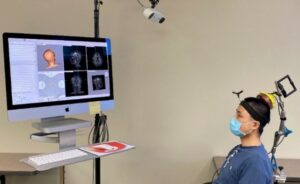
Um novo tipo de modelo computacional que pode revelar danos causados pela radiação no nível celular poderia melhorar os resultados da radioterapia para pacientes com câncer de pulmão.
Roman Bauer, neurocientista computacional da Universidade de Surrey no Reino Unido, em colaboração com Marcar durante e Nicolò Cogno da GSI Helmholtzzentrum para Schwerionenforschung na Alemanha, criou o modelo, que simula como a radiação interage com os pulmões célula por célula.
Mais da metade de todos os pacientes com câncer de pulmão são tratados com radioterapia. Embora esta abordagem seja eficaz, deixa até 30% dos receptores com lesões induzidas pela radiação. Estes podem desencadear doenças graves que afectam a respiração, tais como fibrose – na qual o revestimento dos alvéolos (sacos de ar) nos pulmões fica mais espesso e rígido – e pneumonite – quando as paredes dos alvéolos ficam inflamadas.
A fim de limitar os danos da radiação aos tecidos saudáveis e, ao mesmo tempo, matar as células cancerígenas, a radioterapia é administrada em várias “frações” separadas. Isto permite que uma dose mais elevada – e, portanto, mais eficaz – seja administrada em geral, porque algumas das células saudáveis danificadas podem reparar-se entre cada fração.
Atualmente, os esquemas de fracionamento de radioterapia são escolhidos com base na experiência passada e em modelos estatísticos generalizados, portanto não são otimizados para pacientes individuais. Em contrapartida, a medicina personalizada poderia ser alcançada graças a este novo modelo que, como Durante, diretor do Departamento de Biofísica da GSI explica, analisa “a toxicidade nos tecidos a partir das reações celulares básicas e, portanto, é capaz de prever o que acontece com qualquer paciente” quando diferentes esquemas de fracionamento são escolhidos.
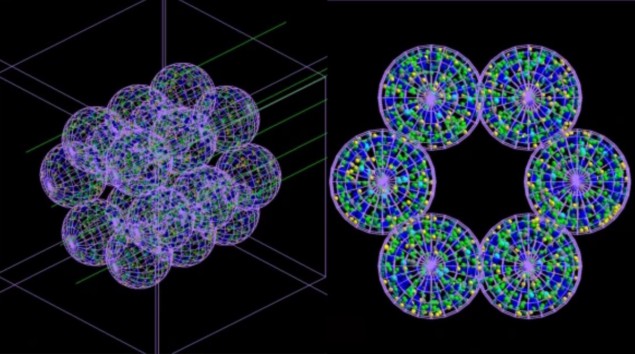
A equipe desenvolveu um modelo “baseado em agente” (ABM) que consiste em unidades ou agentes de interação separados – que neste caso imitam células pulmonares – acoplados a um simulador de Monte Carlo. O ABM, descrito em Medicina da Comunicação, constrói uma representação de um segmento alveolar composto por 18 alvéolos, cada um com 260 µm de diâmetro. Em seguida, simulações de Monte Carlo de irradiação desses alvéolos são realizadas em escala microscópica e nanoscópica, e informações sobre a dose de radiação entregue a cada célula e sua distribuição são realimentadas no ABM.
O ABM usa essas informações para descobrir se cada célula viveria ou morreria e produzia os resultados finais na forma de uma imagem 3D. Crucialmente, o modelo acoplado pode simular a passagem do tempo e, assim, mostrar a gravidade dos danos causados pela radiação – e a progressão das condições médicas que podem causar – horas, dias, meses ou mesmo anos após o tratamento.
“O que achei muito interessante é que essas simulações computacionais realmente forneceram resultados que correspondiam a várias observações experimentais de diferentes grupos, laboratórios e hospitais. Portanto, a nossa abordagem computacional poderia, em princípio, ser usada num ambiente clínico”, afirma Bauer, porta-voz do International Research Institute. Colaboração BioDynaMo, que visa trazer novos métodos computacionais para a área da saúde por meio do conjunto de software utilizado para construir este modelo.
Bauer começou a trabalhar em modelos computacionais de câncer depois que um amigo próximo morreu da doença com apenas 34 anos. “Cada câncer é diferente e cada pessoa é diferente, com órgãos, predisposições genéticas e estilos de vida diferentes”, explica ele. Sua esperança é que as informações de exames, biópsias e outros testes possam ser inseridas no novo modelo para fornecer uma imagem de cada indivíduo. Um protocolo de terapia assistido por IA poderia então ser criado que produziria um plano de tratamento bem adaptado que melhorasse as chances de sobrevivência do paciente.
O planejamento específico do paciente pode melhorar os resultados da radioterapia
Bauer está atualmente procurando colaboradores de outras disciplinas, incluindo física, para ajudar a avançar em direção a um ensaio clínico acompanhando pacientes com câncer de pulmão ao longo de vários anos. Enquanto isso, a equipe pretende expandir o uso do modelo para outras áreas da medicina.
Durante, por exemplo, espera estudar a infecção viral com este modelo pulmonar, pois “pode prever a pneumonite induzida pela infecção por COVID-19”. Entretanto, Bauer começou a simular o desenvolvimento de circuitos no cérebro de bebés prematuros, com o objetivo de compreender melhor “em que momento intervir e como”.
- Conteúdo com tecnologia de SEO e distribuição de relações públicas. Seja amplificado hoje.
- PlatoData.Network Gerativa Vertical Ai. Capacite-se. Acesse aqui.
- PlatoAiStream. Inteligência Web3. Conhecimento Amplificado. Acesse aqui.
- PlatãoESG. Carbono Tecnologia Limpa, Energia, Ambiente, Solar, Gestão de resíduos. Acesse aqui.
- PlatoHealth. Inteligência em Biotecnologia e Ensaios Clínicos. Acesse aqui.
- Fonte: https://physicsworld.com/a/modelling-lung-cells-could-help-personalize-radiotherapy/
- :tem
- :é
- :não
- $UP
- 135
- 3d
- a
- Capaz
- Sobre
- AC
- alcançado
- administrado
- afetar
- Depois de
- idade
- agentes
- visa
- AR
- Todos os Produtos
- permite
- Apesar
- an
- e
- qualquer
- abordagem
- SOMOS
- áreas
- AS
- At
- em caminho duplo
- baseado
- basic
- base
- BE
- Porque
- tornam-se
- começou
- começou
- Melhor
- entre
- respiração
- trazer
- construir
- Constrói
- by
- CAN
- Câncer
- Células cancerosas
- transportado
- casas
- Causar
- célula
- Células
- chances
- escolhido
- Clínico
- Fechar
- de perto
- colaboração
- colaboradores
- computacional
- computador
- condições
- Consistindo
- contraste
- poderia
- acoplado
- Covid-19
- criado
- crucialmente
- Atualmente
- dano
- dias
- entregue
- Departamento
- descrito
- desenvolvido
- Desenvolvimento
- morrem
- morreu
- diferente
- Diretor
- disciplinas
- Doença
- distribuição
- dosar
- cada
- Eficaz
- Mesmo
- Cada
- emocionante
- Expandir
- vasta experiência
- experimental
- Explica
- Alimentado
- final
- seguinte
- Escolha
- formulário
- encontrado
- fração
- amigos
- da
- Generalizado
- genético
- Alemanha
- meta
- Do grupo
- Metade
- acontece
- he
- saúde
- saudável
- ajudar
- superior
- sua
- esperança
- esperando
- hospitais
- HORÁRIO
- Como funciona o dobrador de carta de canal
- HTTPS
- i
- melhorar
- melhora
- in
- Incluindo
- Individual
- INFORMAÇÕES
- lesões
- instância
- pretende
- interagindo
- interage
- Internacionais
- intervir
- para dentro
- emitem
- IT
- ESTÁ
- jpg
- apenas por
- matança
- Laboratório
- Nível
- estilos de vida
- LIMITE
- forro
- viver
- OLHARES
- correspondido
- max-width
- Posso..
- Entretanto
- médico
- medicina
- métodos
- microscópico
- modelo
- modelagem
- modelos
- mês
- mais
- mover
- Natureza
- Novo
- Próximo
- of
- on
- otimizado
- or
- ordem
- Outros
- A Nossa
- Fora
- resultados
- saída
- outputs
- Acima de
- global
- passagem
- passado
- paciente
- pacientes
- pessoa
- Personalizar
- Personalizado
- Física
- Mundo da física
- fotografia
- plano
- planejamento
- platão
- Inteligência de Dados Platão
- PlatãoData
- ponto
- predizer
- Prematuro
- princípio
- progressão
- protocolo
- fornecer
- Radioterapia
- reações
- destinatários
- reparar
- representação
- Resultados
- revelar
- diz
- Escala
- digitaliza
- esquemas
- busca
- segmento
- separado
- grave
- contexto
- vários
- em forma de
- mostrar
- simular
- simulações
- simulador
- So
- Software
- alguns
- porta-voz
- Comece
- estatístico
- Ainda
- Estudo
- tal
- suíte
- Surrey
- sobrevivência
- adaptados
- Profissionais
- testes
- obrigado
- que
- A
- do Reino Unido
- si mesmos
- então
- terapia
- assim sendo
- Este
- isto
- miniaturas
- Assim
- tempo
- para
- para
- tratado
- tratamento
- julgamento
- desencadear
- verdadeiro
- tipo
- Uk
- compreensão
- unidades
- usar
- usava
- usos
- utilização
- vário
- muito
- via
- viral
- O Quê
- quando
- se
- qual
- enquanto
- de
- dentro
- Atividades:
- exercite-se
- trabalhar
- mundo
- seria
- anos
- zefirnet