A termorradioterapia é um tratamento contra o câncer no qual a hipertermia – aquecimento do tumor acima da temperatura corporal – é usada para aumentar a eficácia da radioterapia. A quantidade desse aprimoramento é expressa como EQDRT, a dose de radiação equivalente necessária para atingir o mesmo efeito terapêutico sem aquecimento.
Ensaios clínicos demonstraram que esta abordagem pode melhorar substancialmente os resultados do tratamento em vários tipos de tumor, sem aumentar a toxicidade do tecido normal. Estudos anteriores também demonstraram que tanto a temperatura alcançada quanto o intervalo de tempo entre a radioterapia e a hipertermia impactam o desfecho clínico.
Para entender esse processo com mais detalhes e ajudar a otimizar os tratamentos, os pesquisadores da Amsterdã UMC usaram modelagem biológica para investigar o impacto da temperatura máxima e intervalo de tempo em EQDRT. Descrevendo suas descobertas no Diário Internacional de Oncologia de Radiação, Biologia e Física, eles relatam que altas temperaturas e curtos intervalos de tempo são essenciais para maximizar o aprimoramento terapêutico.
Modelo biológico
Para realizar a termorradioterapia, os médicos usam um dispositivo de radiofrequência ou micro-ondas para aplicar calor ao tumor uma ou duas vezes por semana, antes ou depois de uma sessão de radioterapia. A temperatura do tumor é mantida abaixo de 45°C para evitar o aquecimento do tecido normal, mas às vezes podem ocorrer pontos quentes indesejados (e dolorosos), que limitam o nível máximo de potência tolerável que pode ser usado durante um tratamento de hipertermia.
Primeiro autor Petra Kok e colegas desenvolveram um software para modelar os efeitos biológicos da radioterapia mais hipertermia em termos de distribuições de dose equivalentes. O modelo, que considera a inibição do reparo do DNA por hipertermia, bem como a citotoxicidade induzida pelo calor direto, permite a avaliação da qualidade dos planos de tratamento combinados usando histogramas padrão de dose-volume.
Para obter informações básicas sobre o impacto dos parâmetros de hipertermia, a equipe primeiro calculou o aumento de uma distribuição de dose padrão de 23 × 2 Gy por temperaturas homogêneas entre 37 e 43 °C, para intervalos de tempo entre 0 e 4 h.
O modelo mostrou que EQDRT aumentou significativamente com o aumento da temperatura e com a diminuição do intervalo de tempo. Para um intervalo de tempo de 1 h, por exemplo, previu um EQDRT aumento de 2–15 Gy para temperaturas de 39 a 43°C. Esses achados enfatizam a importância de atingir a temperatura tumoral tolerável mais alta para otimizar o resultado clínico.
O impacto do intervalo de tempo foi mais pronunciado em temperaturas mais altas (acima de 41°C). Em uma temperatura hipertérmica típica de 41.5°C, um EQDRT aumento de cerca de 10 Gy foi alcançado com um intervalo de tempo de 0 h. Isso diminuiu para cerca de 4 Gy de aumento com um intervalo de 4 h, indicando que, à medida que o intervalo de tempo aumenta, uma temperatura mais alta é necessária para obter o mesmo efeito.
Casos Clínicos
Em seguida, os pesquisadores avaliaram cenários de tratamento realistas com base em distribuições de temperatura não homogêneas e planos de radioterapia clínica. Eles calcularam o EQDRT para 10 pacientes com câncer cervical localmente avançado. Todos os pacientes receberam 23 × 2 Gy terapia de arco modulado volumétrico (VMAT), com hipertermia aplicada semanalmente durante o curso de tratamento.
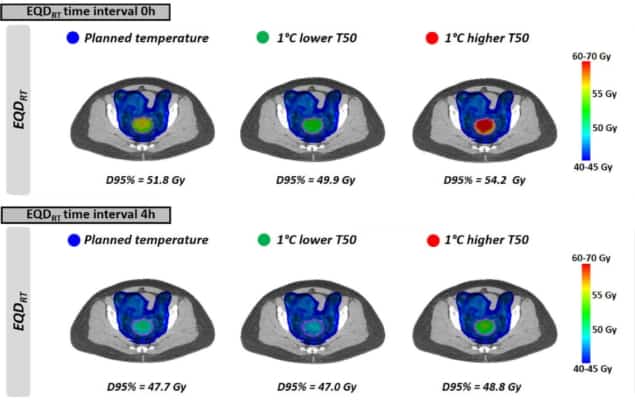
Como visto com as temperaturas uniformes, EQDRT foi maior para o menor intervalo de tempo. Quando a hipertermia foi aplicada imediatamente antes ou após a radioterapia (intervalo de 0 h), o EQD médioRT para 95% do volume (D95%) foi de 51.7 Gy – um ganho de 6.3 Gy sobre a radiação isolada. Aumentar o intervalo de tempo para 4 h reduziu esse ganho para 2.2 Gy.
O modelo previu que a maior parte do aumento da dose é perdida na primeira hora. Para uso clínico, portanto, o tempo entre a radioterapia e a administração de hipertermia deve ser o mais curto possível – idealmente por pacientes recebendo os dois tratamentos no mesmo hospital. A equipe observa que, embora a ordem dos dois tratamentos não seja clinicamente relevante, pois leva tempo para aquecer o tumor, a aplicação de hipertermia primeiro pode permitir intervalos de tempo significativamente mais curtos, mesmo próximos de 0 h.
Por fim, os pesquisadores modelaram o impacto de atingir temperaturas tumorais ligeiramente mais baixas do que o planejado, devido à ocorrência de pontos quentes que limitam o tratamento. O efeito no EQDRT foi mais pronunciado para um curto intervalo de tempo entre a radioterapia e a hipertermia. Para uma temperatura 1°C mais baixa e um intervalo de tempo de 0 h, por exemplo, o EQD médio previstoRT(D95%) diminuiu 1.8 Gy (de 51.7 para 49.9 Gy); para um intervalo de 4 h, a diminuição foi de cerca de 0.7 Gy.
A radioterapia é mais eficaz em tumores aquecidos
Nos casos em que não aparecem pontos quentes, pode ser possível aumentar a potência de saída e atingir uma temperatura mais alta do que o planejado. Mais uma vez, o benefício de atingir uma temperatura mais alta foi maior para intervalos de tempo mais curtos, com o ganho exato dependente das temperaturas reais atingidas.
“A modelagem biológica fornece informações relevantes sobre a relação entre os parâmetros de tratamento e o EQD esperadoRT”, concluem Kok e seus colegas. “Tanto as altas temperaturas quanto os curtos intervalos de tempo são essenciais para maximizar o EQDRT.