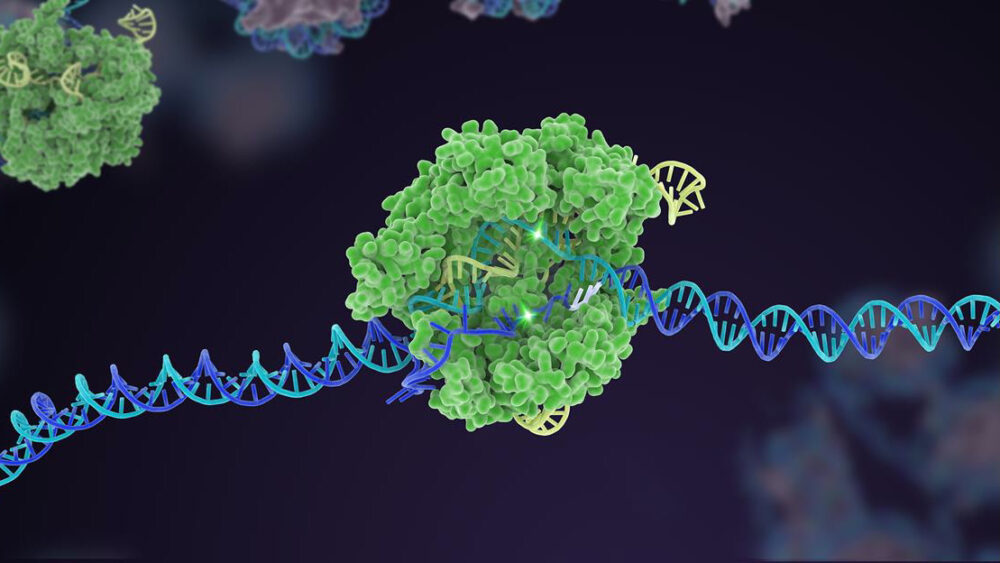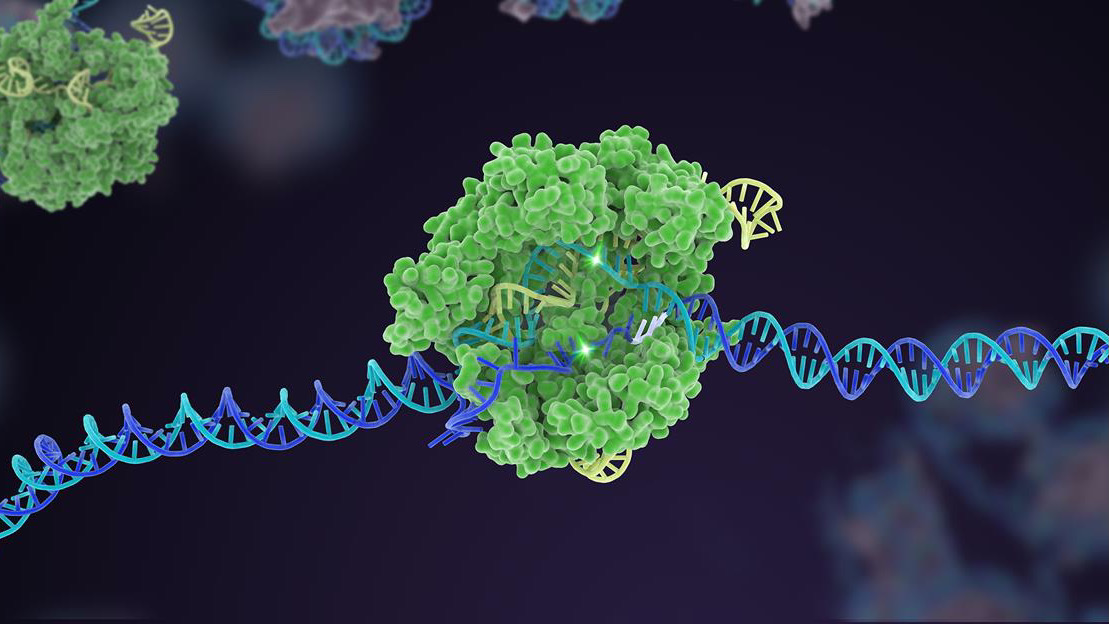
Десять лет назад малоизвестный бактериальный защитный механизм прославился как мощный редактор генома. За прошедшее с тех пор десятилетие CRISPR-Cas9 породил несколько вариантов, превратившись в всеобъемлющий набор инструментов, с помощью которых можно редактировать генетический код жизни.
Далеко от погони за башней из слоновой кости, его практическое использование в исследованиях, здравоохранении и сельском хозяйстве появилось быстро и яростно.
Вы видели заголовки. FDA одобрило его использование в борьба с генетической мутацией, лежащей в основе серповидно-клеточной анемии. Некоторые исследователи отредактированные иммунные клетки для борьбы с неизлечимым раком крови у детей. Другие взяли трансплантация органов от свиньи к человеку от мечты к реальности в попытке облегчить нехватку донорских органов. Недавняя работа направлена на то, чтобы помочь миллионам людей с высоким уровнем холестерина и, возможно, сделать генную терапию на основе CRISPR доступной для всех. снижая их шансы на сердечные заболевания с одной инъекции.
Но для доктора Дженнифер Дудна, получившей Нобелевскую премию в 2020 году за свою роль в разработке CRISPR, мы лишь поверхностно раскрываем его потенциал. Вместе с аспирантом Джой Ван Дудна разработал план развития технологии на следующее десятилетие. в статье in Наука.
Если 2010-е годы были сосредоточены на создании набора инструментов CRISPR и доказательстве его эффективности, то в этом десятилетии технология полностью раскроет свой потенциал. Авторы пишут, что от терапии на основе CRISPR и крупномасштабных скринингов для диагностики заболеваний до создания высокоурожайных культур и питательных продуктов технология «и ее потенциальное влияние все еще находятся на ранней стадии».
Десятилетие ярких событий
Мы пролили много чернил на достижения CRISPR, но стоит вернуться к прошлому, чтобы предсказать будущее и, возможно, выявить проблемы на этом пути.
Одним из первых достижений стала невероятная способность CRISPR быстро создавать модели болезней животных. Его первоначальная форма легко вырезает целевой ген в очень раннем эмбрионе, который при пересадке в матку может произвести генетически модифицированных мышей всего за месяц, по сравнению с годом при использовании предыдущих методов. Дополнительные версии CRISPR, такие как базовое редактирование (замена одной генетической буквы на другую) и первичное редактирование, при котором ДНК разрезается без разрезания обеих цепочек, еще больше повысили гибкость набора инструментов при разработке генетически измененных органоидов (думать мини-мозги) и животных. CRISPR быстро создал десятки моделей некоторых из наших самых разрушительных и загадочных заболеваний, включая различные виды рака, болезнь Альцгеймера и мышечную дистрофию Дюшенна — дегенеративное заболевание, при котором мышцы медленно истощаются. В настоящее время проводятся десятки испытаний на основе CRISPR. в работах.
CRISPR также ускорил генетический скрининг в эпоху больших данных. Вместо того, чтобы нацеливаться на один ген за раз, теперь можно заглушить или активировать тысячи генов параллельно, образуя своего рода Розеттский камень для преобразования генетических нарушений в биологические изменения. Это особенно важно для понимания генетических взаимодействий, например, при раке или старении, в которые мы ранее не были вовлечены, и для получения новых боеприпасов для разработки лекарств.
Но главным достижением CRISPR стало мультиплексное редактирование. Как и одновременное нажатие на несколько клавиш пианино, этот тип генной инженерии нацелен на несколько конкретных областей ДНК, быстро изменяя геномный состав генома за один раз.
Технология работает на растениях и животных. Веками люди кропотливо выращивали культуры с желаемыми характеристиками — будь то цвет, размер, вкус, питательность или устойчивость к болезням. CRISPR может помочь в отборе по нескольким признакам или даже одомашнить новые культуры всего за одно поколение. CRISPR-генерированные безрогие быки, богатые питательными веществами помидорыи гипермускулистых сельскохозяйственных животных и рыба уже являются реальностью. С населением мира достигнет 8 миллиардов в 2022 году и миллионы голодающих, CRISPRed-культуры могут стать спасательным кругом, если люди захотят принять эту технологию.
Путь вперед
Куда мы идем отсюда?
По мнению авторов, нам необходимо еще больше повысить эффективность CRISPR и завоевать доверие. Это означает возвращение к основам, чтобы повысить точность и точность редактирования инструмента. Здесь решающее значение имеют платформы для быстрой эволюции ферментов Cas, «ножничного» компонента механизма CRISPR.
Уже есть успехи: одна версия Cas, например, действует как ограждение для нацеливающего компонента — «ищейки» sgRNA. В классическом CRISPR sgRNA работает одна, но в этой обновленной версии она с трудом связывается без помощи Cas. Этот трюк помогает адаптировать редактирование к конкретному участку ДНК и повышает точность, чтобы разрез работал так, как предполагалось.
Подобные стратегии также могут повысить точность с меньшим количеством побочных эффектов или вставить новые гены в клетки, такие как нейроны и другие, которые больше не делятся. Хотя это уже возможно при первичном редактировании, его эффективность может быть В 30 раза ниже чем классические механизмы CRISPR.
«Главная цель основного редактирования в следующем десятилетии — повысить эффективность без ущерба для чистоты продукта редактирования — результат, который потенциально может превратить основное редактирование в один из самых универсальных инструментов для точного редактирования», — говорят авторы.
Но, возможно, более важным является доставка, которая остается узким местом, особенно для терапевтических средств. В настоящее время CRISPR обычно используется на клетках вне организма, которые вводятся обратно, как в случае с CAR-T, или, в некоторых случаях, привязываются к вирусному носителю или инкапсулируются в жировые пузырьки и вводятся в организм. Были успехи: в 2021 году, FDA одобрило первый снимок на основе CRISPR для борьбы с генетическим заболеванием крови, транстиретиновым амилоидозом.
Тем не менее, обе стратегии проблематичны: не многие типы клеток могут пережить лечение CAR-T, погибая при повторном введении в организм, а нацеливание на определенные ткани и органы остается в основном недоступным для инъекционной терапии.
По словам авторов, ключевым достижением следующего десятилетия является доставка груза CRISPR в целевую ткань без вреда и высвобождение редактора генов в намеченном месте. Каждый из этих шагов, хотя и кажущийся простым на бумаге, представляет собой собственный набор проблем, для преодоления которых потребуются как биоинженерия, так и инновации.
Наконец, по словам авторов, CRISPR может сочетаться с другими технологическими достижениями. Например, используя клеточную визуализацию и машинное обучение, мы вскоре сможем разработать еще более эффективные редакторы генома. Благодаря более быстрое и дешевое секвенирование ДНК, мы можем легко отслеживать последствия редактирования генов. Затем эти данные могут обеспечить своего рода механизм обратной связи, с помощью которого можно создавать еще более мощные редакторы генома в «эффективной петле».
Воздействие на реальный мир
По словам авторов, хотя на повестке дня стоит дальнейшее расширение набора инструментов CRISPR, технология достаточно зрелая, чтобы влиять на реальный мир уже второе десятилетие.
В ближайшем будущем мы должны увидеть «увеличение числа методов лечения на основе CRISPR, которые переходят на более поздние стадии клинических испытаний». Забегая вперед, можно сказать, что эта технология или ее варианты могут сделать ксенотрансплантацию органов свиньи человеку рутинной, а не экспериментальной. Крупномасштабные скрининги генов, которые приводят к старению или дегенеративным заболеваниям мозга или сердца — нашим главным убийцам сегодня — могут привести к профилактическому лечению на основе CRISPR. Это непростая задача: нам нужны как знания о генетике, лежащей в основе многогранных генетических заболеваний, то есть когда в игру вступают несколько генов, так и способ доставки инструментов редактирования к их цели. «Но потенциальные выгоды могут стимулировать инновации в этих областях далеко за пределы того, что возможно сегодня», — говорят авторы.
Однако с большей силой приходит и большая ответственность. CRISPR развивается с головокружительной скоростью, и регулирующие органы и общественность все еще пытаются наверстать упущенное. Пожалуй, самым известным примером является CRISPR младенцы, где проводились эксперименты против глобальных этических норм приводимый в движение международный консорциум, чтобы установить красную черту для редактирования человеческих зародышевых клеток.
Точно так же генетически модифицированные организмы (ГМО) остаются спорной темой. Хотя CRISPR гораздо более точен, чем предыдущие генетические инструменты, потребители сами должны решить, приветствовать ли их использование. новое поколение продуктов, созданных человеком— как растительное, так и животное.
Эти важные разговоры, требующие глобального обсуждения поскольку CRISPR вступает в свое второе десятилетие. Но авторам будущее кажется светлым.
«Как и во время появления технологии редактирования генома CRISPR, сочетание научного любопытства и желания принести пользу обществу будет способствовать инновациям в технологии CRISPR в следующем десятилетии», — заявили они. «Продолжая исследовать мир природы, мы обнаружим то, что невозможно представить, и применим это в реальном мире на благо планеты».
Изображение Фото: NIH
- SEO-контент и PR-распределение. Получите усиление сегодня.
- Платоблокчейн. Интеллект метавселенной Web3. Расширение знаний. Доступ здесь.
- Источник: https://singularityhub.com/2023/01/25/crisprs-wild-first-decade-only-scratches-the-surface-of-its-potential/
- 2020
- a
- способность
- ускоренный
- Принять
- точность
- достижение
- акты
- дополнительный
- продвижение
- продвинутый
- авансы
- приход
- против
- агентствах
- повестка дня
- старение
- сельское хозяйство
- впереди
- Цель
- облегчать
- в одиночестве
- уже
- Несмотря на то, что
- Альцгеймера
- боеприпасов
- и
- животное
- животные
- утвержденный
- области
- Помощь
- Авторы
- назад
- Использование темпера с изогнутым основанием
- Основы
- польза
- Преимущества
- Беркли
- Beyond
- большой
- Big Data
- миллиард
- связывать
- кровь
- Bloomberg
- тело
- повышение
- Повышенный
- Мозг
- приносить
- строить
- строить доверие
- рак
- не могу
- случаев
- случаев
- Привлекайте
- Клетки
- проблемы
- шансы
- изменения
- изменения
- более дешевый
- классический
- Клинический
- клинические испытания
- код
- цвет
- сочетание
- как
- сравненный
- компонент
- комплексный
- компромат
- Последствия
- консорциум
- Потребители
- продолжающийся
- спорный
- Беседы
- может
- кредит
- CRISPR
- критической
- культур
- любопытство
- В настоящее время
- Порез
- резки
- данным
- десятилетие
- Защита
- доставить
- поставка
- развивающийся
- Разработка
- обнаружить
- Болезнь
- заболеваний
- Г-жа
- вниз
- множество
- мечта
- управлять
- наркотик
- в течение
- каждый
- Рано
- легко
- редактор
- эффективность
- эффекты
- затрат
- эффективный
- инкапсулированный
- инженер
- Проект и
- Вводит
- особенно
- установленный
- налаживание
- этический
- Даже
- развивается
- пример
- расширяющийся
- Больше
- FAME
- ферма
- БЫСТРО
- FDA
- Обратная связь
- бороться
- First
- Трансформируемость
- внимание
- продукты
- форма
- от
- полный
- далее
- будущее
- получение
- в общем
- порождать
- поколение
- генная инженерия
- Генетика
- Глобальный
- Go
- цель
- будет
- выпускник
- большой
- методические рекомендации
- Последние новости
- здравоохранение
- Сердце
- помощь
- помогает
- здесь
- High
- Выделите
- HTTPS
- человек
- Изображениями
- Влияние
- важную
- улучшение
- in
- В том числе
- Увеличение
- расширились
- Увеличивает
- невероятный
- Инновации
- взаимодействие
- Мультиязычность
- IT
- Дженнифер
- только один
- Основные
- ключи
- убийцы
- Вид
- знания
- крупномасштабный
- вести
- изучение
- давать в долг
- письмо
- ЖИЗНЬЮ
- линия
- дольше
- искать
- ВЗГЛЯДЫ
- машина
- обучение с помощью машины
- машины
- Главная
- сделать
- макияж
- многих
- зрелый
- означает
- механизм
- методы
- миллионы
- Модели
- модифицировало
- монитор
- Месяц
- БОЛЕЕ
- более эффективным
- самых
- перемещение
- многогранный
- с разными
- натуральный
- природа
- Возле
- Необходимость
- Нейроны
- Новые
- следующий
- Государственная служба здравоохранения
- NIH
- нобелевская торговая точка
- печально известный
- номер
- ONE
- оригинал
- Другие контрактные услуги
- Другое
- внешнюю
- Преодолеть
- собственный
- бумага & картон
- Параллельные
- мимо
- путь
- страна
- Люди
- возможно
- планета
- растения
- Платформы
- Платон
- Платон Интеллектуальные данные
- ПлатонДанные
- Много
- население
- возможное
- потенциал
- потенциально
- мощностью
- мощный
- практическое
- Точность
- предсказывать
- предсказанный
- разрабатывает
- предыдущий
- предварительно
- Простое число
- приз
- проблемам
- Продукт
- обеспечивать
- что такое варган?
- положил
- быстро
- достигать
- доходит до
- реальные
- реальный мир
- Реальность
- последний
- Red
- регуляторы
- освободить
- оставаться
- остатки
- требовать
- исследованиям
- исследователи
- упругость
- ответственность
- Богатые
- Дорожная карта
- Роли
- Сказал
- Наука
- Разведчик
- скрининг
- Экраны
- Во-вторых
- набор
- нехватка
- должен
- сторона
- Молчание
- просто
- одновременно
- с
- одинарной
- сайте
- Размер
- Медленно
- So
- Общество
- некоторые
- конкретный
- скорость
- Спотовая торговля
- вращаться
- этапы
- Шаги
- По-прежнему
- КАМЕНЬ
- стратегий
- Схватки
- Борющийся
- "Студент"
- такие
- страдание
- Поверхность
- выживать
- цель
- целевое
- направлены
- направлена против
- Сложность задачи
- технологический
- Технологии
- Ассоциация
- Основы
- мир
- их
- терапевтика
- тысячи
- время
- раз
- в
- сегодня
- вместе
- Ящик для инструментов
- инструменты
- топ
- тема
- Башня
- испытания
- Доверие
- ОЧЕРЕДЬ
- Типы
- UN
- лежащий в основе
- понимание
- обновление
- использование
- различный
- разносторонний
- версия
- добро пожаловать
- Что
- Что такое
- будь то
- который
- в то время как
- КТО
- Дикий
- будете
- готовый
- без
- Выиграл
- Работа
- работает
- Мир
- год
- лет
- Уступать
- зефирнет