Rick Young on biologian professori MIT:ssä, joka tutkii RNA:ta, joka on transkriptoitu siitä genomin osasta, joka ei koodaa proteiineja, eli ei-koodaavaa DNA:ta. Tätä genomin osaa kutsuttiin kerran "roska-DNA:ksi", mikä antaa sinulle käsityksen siitä, mitä monet ajattelivat sen arvosta. Tiedemiehet hämmästyivät havaitessaan, että se muodostaa 98 prosenttia ihmisen genomista, mikä laukaisi etsinnän löytääkseen sen toimintoja.
Tässä keskustelussa Rick Young keskustelee Hanne Winarsky Bio Eats Worldiltä ja a16z:ltä Jorge Conde, joka johtaa sijoituksia biologian, tietojenkäsittelytieteen ja tekniikan risteyksessä. Ennen liittymistään a16z:hen Conde toimi Syros Pharmaceuticalsin strategiajohtajana ja oli yksi genomiikan tulkintayrityksen Knomen perustajista.
Keskustelu kattaa sen, mitä olemme oppineet siitä 98 prosentista genomista, jonka luulimme olevan roskaa. Osoittautuu, että sillä on monenlaisia tehtäviä aina muinaisten virusinfektioiden todisteiden piilottamisesta jokaisen kasvojen saamiseen näyttämään ainutlaatuisilta. He keskustelevat myös sen massiivisesta, mutta silti huonosti ymmärrettävästä roolista taudeissa ja kuinka roska-DNA:n tutkiminen johti geenin päälle/pois-kytkimen löytämiseen, jota kukaan ei odottanut.
Huomautus: tämä keskustelu julkaistiin alun perin jaksona Bio syö maailmaa. Voit kuunnella sen jakson tätä.
HANNE WINARSKY: Olemme täällä puhumassa tänään niin sanotusta roska-DNA:sta. Voimmeko aloittaa yksinkertaisella määritelmällä?
RICK YOUNG: Se on noin puoli vuosisataa vanha termi. Tiedemiehet tiesivät genomin osista, jotka eivät koodaa proteiineja, ja he theorized että tämä oli roskaa. Tiesimme, että osa siitä oli vain jäänteitä muinaisista virusinvaasioista genomiin. Mutta se lause, roska-DNA, on kummitellut meitä.
HANNE: Mitä termiä yrität käyttää sen sijaan? DNA:n pimeä aine, josta ymmärrämme enemmän joka päivä?
RICK: Koodaamaton DNA.
HANNE: Miksi he pitivät sitä roskana? Mainitsit, että osa niistä oli vanhoja viruspaloja. Mutta miksi se ei ollut vain mysteeri alusta alkaen?
RICK: Koska läpi biologisen historian käytiin tätä keskustelua siitä, mikä oli geneettistä materiaalia, ja alun perin sen ajateltiin olevan proteiinia. Mutta kun kävi selväksi, että proteiini oli koneisto ja DNA oli koneiston suunnitelma, ihmiset olivat kiireisiä koneilla, koska koneiston viat aiheuttavat sairauksia. Mutta sitten kävi ilmi, että vain 2 % genomista koodaa proteiinien aminohappoja. Suurin osa, 98 %, ei. Ja vuonna 2000, kun tutkijat Human Genome Project esitetty Ihmisen genomisekvenssissä, tiedot vahvistivat, että 98 % 3.2 miljardista emäksestämme ei koodaa proteiineja.
Jokaisella geenillä on se merkittävä kyky ottaa palasia ja paloja proteiinisegmenteistä, joita se koodaa, ja järjestää ne niin, että yhdessä solussa saamasi tuote saattaa toimia hieman nopeammin tai toisessa solussa voi todella siirtyä toiseen soluun. osastoon erilaisten töiden tekemiseen.
JORGE CONDE: Mitkä olivat alkuperäiset arviot siitä, kuinka monta geeniä noissa 3.2 miljardissa emäsparissa koodattaisiin?
RICK: Päädyimme noin 100,000 XNUMX:een. Oletimme vain, että mitä monimutkaisempia olemme, sitä suurempi genomi ja sitä suurempi määrä geenejä. Oli pieni järkytys, kun tajusimme, että meillä ja hyönteisillä on suunnilleen sama määrä geenejä.
JORGE: Vähemmän geenejä kuin odotimme koodaamassa sitä, mitä pidämme uskomattoman monimutkaisena organismina, eikö niin?
HANNE: Se on vähän järkytys.
Sama lähdekoodi, eri ohjelmat
JORGE: Asia, jonka me kaikki opimme lukiossa, on, että DNA koodaa RNA:ta, RNA koodaa aminohappoja ja aminohapot antavat meille proteiineja, eikö niin? Se on modernin biologian keskeinen dogmi.
RICK: Joo. Yksi suurimmista syistä, miksi ihmiset antoivat nopeasti otsikon "roska-DNA" sille 98 %:lle genomista, joka ei koodaa proteiineja, on se, että suurelta osin uskottiin, että genomin liiketoiminnan tarkoitus oli tehdä proteiinit.
JORGE: Joten milloin geneetikot alkoivat saada aavistus, että roska-DNA voi olla enemmän kuin roskaa?
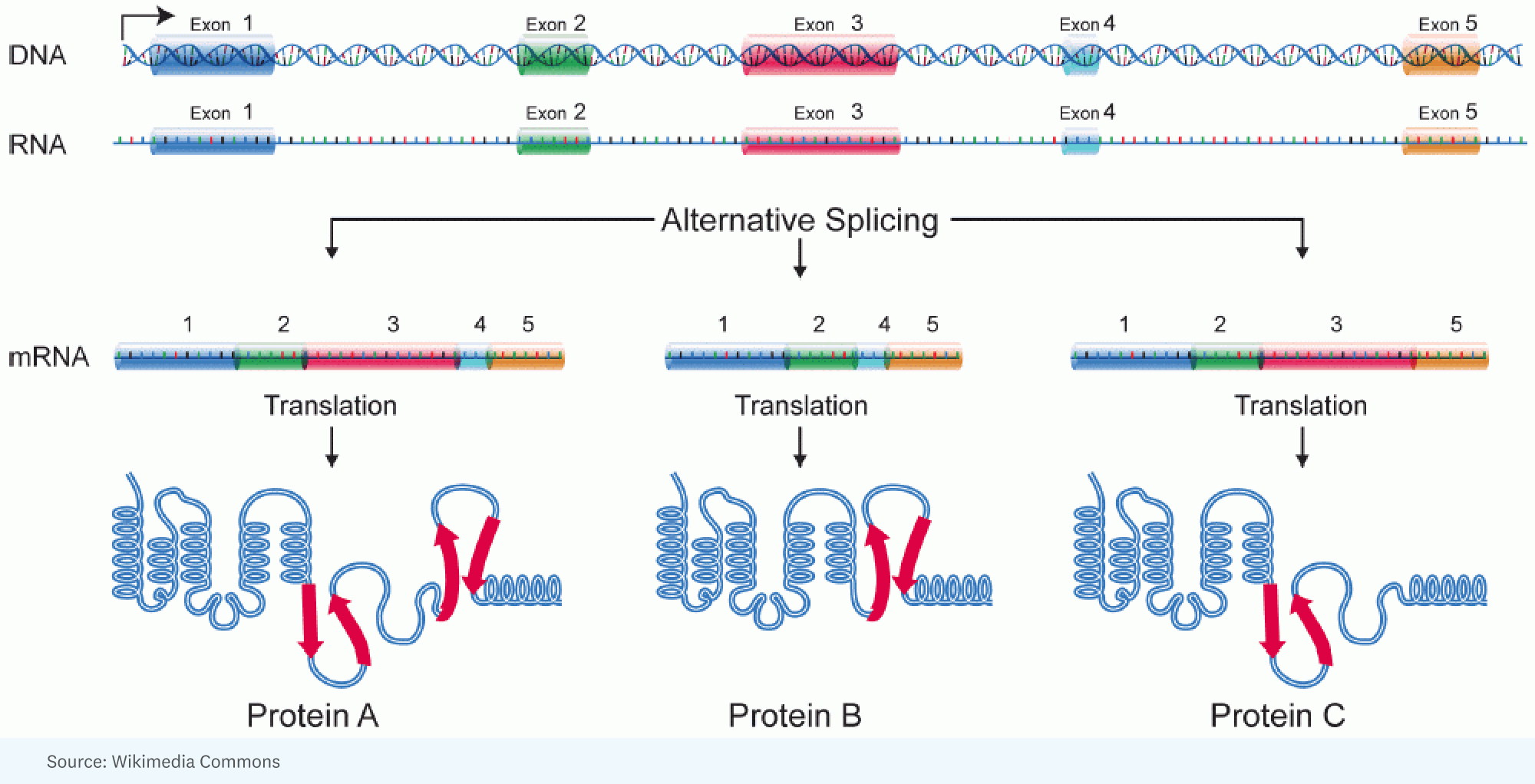
RICK: [Se alkoi] oivalluksesta, että voit selittää ihmisten ja hyönteisten monimutkaisuuden valtavalla määrällä vaihtoehtoisia liitoksia. Siellä sinulla on yhdelle geenille suuri RNA, joka on valmistettu, mutta se silmukoituu eri tavalla yhdessä solussa verrattuna toiseen soluun. Toisin sanoen geenin eri osat päätyvät RNA-molekyyliin, joka määrittää proteiinin. Joten proteiini on hieman erilainen.
HANNE: Se kuulostaa vähän kaleidoskoopilta, jossa valo osuu siihen eri tavalla, saat eri värejä, eri kulmia.
RICK: No, ja se on mielenkiintoinen analogia. Mielestäni parempi analogia on, kun sinulla on nämä legot, ja voit tehdä koneen, mutta voit tehdä sen niin monella eri tavalla, niin monilla eri rakenteilla, väreillä. Jokaisella geenillä on se merkittävä kyky ottaa palasia ja paloja proteiinisegmenteistä, joita se koodaa, ja järjestää ne niin, että yhdessä solussa saamasi tuote saattaa toimia hieman nopeammin tai toisessa solussa voi todella siirtyä toiseen soluun. osastoon erilaisten töiden tekemiseen.
JORGE: Jokaisella tietyn ihmisen solulla on suunnilleen sama genomi. Silti sama genomi synnyttää uskomattoman monipuolisen valikoiman eri solutyyppejä. Ja niin siinä määrin kuin aiomme tehdä analogian, jokainen solutyyppi käyttää eri ohjelmaa samasta lähdekoodista.
RICK: Juuri niin.
98 %:n toiminnot
JORGE: Sinun ei tarvitse olla asiantuntija tarkastellaksesi eri solutyyppejä ja nähdäksesi kuinka erilaisia ne voivat olla, eikö niin? Neuroni näyttää hyvin, hyvin, hyvin erilaiselta ja toimii hyvin, hyvin eri tavalla kuin esimerkiksi lihassolu. Mikä määrittää ohjelman, geneettisen ohjelman, jonka solu päättää suorittaa? Mikä tekee lihassolusta lihassolun ja mikä tekee hermosolusta hermosolun?
RICK: Aloitimme siten, että DNA tekee RNA:ta ja [RNA] tekee proteiinia. Se on keskeinen dogmi. Mutta noin puoli vuosisataa sitten tiedemiehet alkoivat väittää, että itse asiassa RNA alkoi luoda erilaisia toimintoja yksinään. Ja käy ilmi, että RNA:lla on itse asiassa osa aktiivisuudesta varhaisimmissa kehitysvaiheissa.
Kun siittiö kohtaa munan, se on äidin RNA, jonka hän laittaa munaan. On olemassa RNA-molekyylejä, jotka tekevät tämän. Osoittautuu, että käyttämämme antibiootit sitoutuvat rutiininomaisesti RNA:han. Joten RNA:lla on melko tärkeitä rooleja siellä. Se muutti ihmisten ajattelutavan. Sitten kun aloimme ajatella roska-DNA:ta, se on se DNA:n osa, joka ei koodaa proteiinia. No, entä jos maailma perustuu RNA:han eikä proteiiniin, ainakin tällä hetkellä alku? Ja niin nyt ymmärrämme, että valtava osa siitä, mitä kutsumme roska-DNA:ksi tai mitä kutsuimme roska-DNA:ksi, ei ole roskaa. Se on erittäin toimiva. Ja suurin osa siitä tekee RNA:ta.
Joten tavoitteesi minkä tahansa solun ohjelmoinnissa on käyttää vain sitä tiettyä sekvenssisarjaa, joka virittää kunkin yhteisen geenijoukon haluamallesi tasolle. . . Ongelmamme on, ettemme tunne ohjelmaa.
HANNE: Vau. Voitko hieman selventää maata, jossa olemme, ymmärtääksemme DNA:n koodaamattoman osan? Tiedätkö, mikä on nykyinen käsityksemme kaikista siellä olevista erilaisista mahdollisuuksista?
RICK: Vain 2 % genomistamme koodaa näitä proteiineihin meneviä aminohapposekvenssejä. Mitä sitten on kirjanpitäjämme kirjanpidossa siitä, mitä muut tekevät?
Noin puolet genomistamme on heterokromatiinia. Sieltä saat muinaisten virushyökkäysten tuotteita. Muinaiset retrovirukset tunkeutuivat, ja sitten ne muutettiin DNA:ksi, ja ne liitettiin genomiin. Joten se on itse asiassa keino, joka meillä on ollut koko evoluutiohistoriamme ajan piilottaaksemme sekvenssit, joita emme halua käsitellä. Ja se pysyy hiljaa genomissamme tärkeällä poikkeuksella.
Toinen puoli on siellä, missä kaikki aktiiviset proteiinia koodaavat geenit ovat, ja missä ovat kaikki aktiiviset ei-koodaavat geenit. Mitä se tekee? Siinä on pitkä luettelo säätelytoiminnoista, mutta yksinkertaistan sen kolmeen.
Yksi sen tehtävistä on kromosomien ylläpito. Joten nämä ovat paikkoja, joissa DNA:n replikaatio tapahtuu. Ne ovat paikkoja genomissamme, jotka ovat vastuussa sen laskosta, koska se on 2 metriä pitkä polymeeri. Sen täytyy taittua halkaisijaltaan parin mikronin ytimeen.
Toinen säätelyalue on kaikki nämä asiat, jotka ovat vastuussa geenisäätelystä. Todennäköisesti paljon suurempi osa genomista määrittää geenin ilmentymistä sääteleviä piirteitä kuin itse geenejä. Ja tämä johtuu siitä, että jokainen solu käyttää eri säätelyaluetta jokaiselle geenille.
HANNE: Se on niin mielenkiintoista, minusta kuulostaa melkein siltä, että siellä on kaappi, jossa on hyllyt tavaroita varten, joita meidän täytyy laittaa kaappiin hetkeksi, ja sitten on infrastruktuurikaappi.
Miksi tähän on tärkeää keskittyä niin paljon? Koska siellä tapahtuu yli 75 % kaikesta sairauksiin liittyvästä geneettisestä vaihtelusta.
RICK: Kyllä. Pohjimmiltaan sinulla on yhteinen joukko geenejä jokaisessa solussa, sekä koodaavissa että ei-koodaavissa. Ja sinulla on elementtejä, sinulla on todellisia sekvenssejä, jotka toimivat vain tietyissä solutyypeissä. Joten tavoitteesi minkä tahansa solun ohjelmoinnissa on käyttää vain sitä tiettyä sekvenssisarjaa, joka virittää kunkin yhteisen geenijoukon haluamallesi tasolle. Joten soitat hämmästyttävällä musiikki-instrumentilla, jossa on 20,000 XNUMX proteiinia koodaavaa geeniä ja suunnilleen sama määrä ei-koodaavia geenejä. Teet sen tiettyjen sekvenssien kautta. Ongelmamme on, että emme tiedä ohjelmaa.
Sääntelyohjelman kiusaaminen
HANNE: Joten miten aloitat susauksen? Mitä vihjeitä seuraat, kun alat yrittää ymmärtää tätä ohjelmaa?
RICK: Vihjeet ovat, että kunkin geenin säätelyalueet solussa näyttävät itsensä. He kertovat sinulle. Ja voit käyttää erilaista tekniikkaas, jotka kertovat hyvin nopeasti koko genomissa, tietyssä solutyypissä, esimerkiksi motorisessa neuronissa, mitkä ovat kaikki säätelyalueet, jotka ovat päällä kyseisessä solussa. Voit jopa nähdä, missä reostaatti on asetettu kullekin näistä geeneistä. Siellä nopea sekvensointi on antanut meille nämä mahdollisuudet päätellä samanaikaisesti kaikki geenien aktiiviset elementit, sekä koodaavat että ei-koodaavat tietyn solutyypin genomissa.
Ongelmamme tällä hetkellä on, että sinun on tehtävä tämä melko paljon yksi solutyyppi kerrallaan, ja meillä on monia, monia satoja solutyyppejä. Joskus on vaikea nähdä tiettyä solua kontaminoimatta sitä muilla soluilla, koska kaikki kudosemme ovat todellakin useiden solutyyppien yhdistelmiä.
JORGE: Kannattaako väittää analogisesti, jos sanomme, että koska jokaisessa solussa on koko genomi, jokaisella solulla on koko laulukirja, tietyt solutyypit valitsevat soittaa tiettyjä sinfoniaa, ja koneisto, joka auttaa säätelemään genomia, on pohjimmiltaan sen johtaja. orkesteri? Tuo koneisto on kapellimestari, joka määrittää, mitä kappaleita soittaa, mitä nuotteja lyödä, millä äänenvoimakkuudella, millä tempolla jne. Onko tämä järkevä analogia genomin säätelytoiminnon ymmärtämiselle?
RICK: Siinä mielessä, että on helppo nähdä, mikä tulos olisi. Mutta mikä on haastavampaa, kuka kirjoittaa kaikki muistiinpanot? Kuka on se säveltäjä, joka laittoi kaikki nuotit sinne ja sai kaiken kuntoon? Säveltäjä osoittautuu useimmille soluillemme ja suurimmalle osalle geeneistämme näitä transkriptiotekijöiksi kutsuttuja proteiinimolekyylejä, joiden tehtävänä on sitoutua geenien säätelyelementteihin ja antaa niille reostaattiasetus.
Tässä on nyt mielenkiintoinen ryppy, koska niissä paikoissa, joissa nuo transkriptiotekijät sitoutuvat, me kutsumme niitä tehostajiksi. Näissä tehostajakohdissa myös RNA:ta valmistetaan aina siitä kohdasta, johon ne ovat sitoutuneet. Olemme vasta äskettäin ymmärtäneet, että RNA:lla on tärkeä rooli säätelyssä. Vahvistaakseni tätä: tapa, jolla iPhone tunnistaa kasvosi, johtuu siitä, että kallon kasvojen rakenteen geenejä säätelevät tehostajat vaihtelevat jokaisessa ihmisessä.
Se, mitä sinulla on nyt täällä, on tämä triumviraatti. Sinulla on DNA-sekvenssi. Sen tunnistaa erityisesti sen muodostava molekyyli, transkriptiotekijä, mutta se tarvitsee tämän kolmannen kappaleen, tämän RNA-molekyylin. Joten DNA, RNA ja proteiini toimivat itse asiassa yhdessä näillä säätelyalueilla. Ja miksi on tärkeää keskittyä niin paljon tähän? Koska siellä tapahtuu yli 75 % kaikesta sairauksiin liittyvästä geneettisestä vaihtelusta.
HANNE: Ei mennä liian musiikillisesti nörttinä, mutta kuulostaa melkein soinnukselta, eikö? Kolmen nuotin rakenne soittaa yhdessä luodakseen jotain suurempaa.
RICK: Juuri niin.
Ohjelmoijat
JORGE: Yksi biologian kärjessä olevista alueista on kasvava kykymme yrittää ymmärtää joitain hallitsevia lakeja siitä, kuinka soluohjelmat määritetään ja kuinka solujen kohtalo määräytyy. Minulle yksi kiehtovimmista harppauksista ymmärryksessämme tuli Yamanakan tekemästä työstä, josta hänelle myönnettiin Nobel palkinto, joka osoittaa, että voit ohjelmoida solutyyppejä uudelleen vain altistamalla solut hyvin pienelle kouralliselle erityisille transkriptiotekijöille.
HANNE: Voitko kuvailla, miksi se oli juuri niin läpimurto alalle?
RICK: Minulla oli pieni rooli siinä elokuvassa. Osoittautuu, että vaikka luku on erittäin suuri, pieni määrä transkriptiotekijöitä voi tunnistaa kaikki säätelyelementit, jotka ovat välttämättömiä kyseisen solun identiteetille. Ja Yamanaka todisti tämän meille osoittamalla, että vain neljää näistä tekijöistä voitiin käyttää minkä tahansa ihmissolun tai urossolun ohjelmoimiseksi alkion kantasolua vastaavaksi.
Yksi tapa ajatella tätä on, että jos kappale on liian huono, organismi ei elä. Mutta jos se on vain vähän ohi, kasvat aikuiseksi, tulet aikuiseksi ja sitten saat kaikki nämä erilaiset sairaudet vanhetessamme.
JORGE: Ja se on hämmästyttävää, eikö? Koska se viittaa siihen, että järjestelmä on jotenkin suunniteltu siten, että uskomaton monimutkaisuus saadaan yksinkertaiselta kuulostavasta. Neljä transkriptiotekijää, jotka määrittävät kaiken monimutkaisen tapahtumasarjan, joka hallitsee eri solutyyppejä.
Osa tekemästäsi työstä on osoittanut, että nämä päätranskriptiotekijät muodostavat olennaisesti vastaavia piirejä, jotka ohjaavat geenejä, joita solu tarvitsee tilansa perustamiseen ja ylläpitämiseen. Voitko kuvailla, mitä tarkoitat geeninhallintapiireillä?
RICK: Geenien ohjauspiireissä on kaksi hienoa elementtiä. Yksi on, että kun pääsäätelijä löytää nämä tehostajat ja aiheuttaa kohdegeeniensä ilmentymisen, se on osa piiriä, se on tulos. Toinen niin siisti elementti on, että päätranskriptiotekijät säätelevät myös omaa ilmaisuaan. Palautesilmukka on siis olemassa. Kuten, sinulla olisi sähkökaavio, jossa mestarit hallitsevat omaa ilmentymistään omista geeneistään ja sitten sitoutuvat kohdegeenien ilmentymiseen ja hallitsevat sen ilmentymistä.
JORGE: Se on aika villiä. Se on melkein kuin pyöreä viittaus, jossa transkriptiotekijät ovat proteiinia, että proteiini on valmistettu DNA:sta, joka on koodattu geeniin. Transkriptiotekijät ovat osa koneistoa, joka auttaa ilmentymään geenien transkriptiossa. Ja siksi sanot, että transkriptiotekijät – proteiini – auttavat säätelemään transkriptiotekijöitä tekevien geenien ilmentymistä.
HANNE: Joo. Tässä koko sinfoniassa on mielikuva kaikista näistä pienistä soluista, jotka laulavat kaikki nämä erilaiset tekstuurit.
Sääntelygenomi ja sairaus
HANNE: Mitä se muuttaa, kun alamme ymmärtää, miten tämä kaikki toimii? Mitä voimme tehdä tällä tiedolla?
RICK: Näillä sivustoilla, joilla nämä päätranskriptiotekijät ohjaavat kunkin solun identiteettiä, suurin osa ihmisen vaihteluista aiheuttaa sairauksia. Yli 75 % sairauteen liittyvästä vaihtelusta esiintyy näissä tehostajaelementeissä, jotka ohjaavat avaingeenejä.
JORGE: Okei. Joten se on villiä, eikö? Kun ajattelemme mutaatioita, jotka aiheuttavat tai edistävät sairautta, ajattelemme tavallisesti mutaatiota, joka tapahtuu geenissä, joka vaikuttaa proteiiniin, jollakin tavalla rikkoo proteiinin ja joka aiheuttaa sairauden.
HANNE: Aivan.
JORGE: Mutta sinä sanot, että 75 %:ssa tapauksista tuo mutaatio todella tapahtuu geenien ulkopuolella, se tapahtuu tällä genomin ei-koodaavalla alueella. Jos geeni on kappale, se ei johdu siitä, että kappaletta soitetaan väärin, vaan se, että se saatetaan soittaa liian kovaa, liian hiljaa tai liian hitaasti tai liian nopeasti, mutta se on se, mikä aiheuttaa monia sairauksia.
RICK: Itse asiassa yksi tapa ajatella tätä on, että jos kappale on liian huono, organismi ei elä. Mutta jos se on vain vähän ohi, kasvat aikuiseksi, tulet aikuiseksi ja sitten saat kaikki nämä erilaiset sairaudet vanhetessamme.
Ensimmäistä kertaa meillä on kaikki nämä mallit, joilla asennat laitteen ja saat sen toimimaan.
JORGE: Ei tehdä väärää versiota geenistä, mutta saada väärä annos geeniä. Liian paljon tai liian vähän.
RICK: Se on oikein. Miten löydät terapioita, jotka käsittelevät tätä? Kuinka virität geeniä selektiivisesti ylös tai alas? Periaatteessa voimme tehdä sen monella tavalla, ja voimme tehdä sen geeniterapialla. Voimme tehdä sen CRISPR-geenin muokkauksella. Mutta tärkein asia, jonka mielestäni olemme havainneet viime vuosina, on, että jokaisella näistä geenisäätelyelementeistä on RNA. RNA on toimiva. Se on reostaatti, joka auttaa virittämään tuon geenin tuoton. Nyt on monia tapoja, joilla voit huumeiden RNA:t. Meillä on ASO:t (antisense-oligonukleotidit), kuten Spinraza spinaaliseen lihasatrofiaan. Meillä on RNA-häiriöitä. Meillä on näköpiirissä uusia pienimolekyylisiä lääkkeitä. Jos voisit ajatella tapoja ohjelmoida lääkettä, synteettistä RNA:ta, säätelemään säätelijä-RNA:ta, säätely-RNA:ta, sinulla on pääasiallinen tapa virittää mikä tahansa geeni missä tahansa solussa, jossa tämä solu voi päästä käsiksi kyseiseen lääkkeeseen.
HANNE: Kyseessä ei siis ole vain täysin erilainen käsitys siitä, miten sairaus ilmaantuu. Mutta se on täysin erilainen käsitys siitä, kuinka voimme mahdollisesti hoitaa sairauksia.
RICK: Aivan. Periaatteessa meillä on nyt ohjelmoitava tapa kehittää lääkettä, joka virittää minkä tahansa kiinnostavan geenin. Tällä hetkellä ihmiset yksinkertaisesti ohjelmoivat synteettisiä RNA-molekyylejä tuottamaan rokotteen tätä pandemiaa varten. Sellaisen, joka on niin hyvä tulos kuin voit koskaan odottaa rokotteelta.
JORGE: Kun ajattelemme sovelluksia tekniikka biologiassa, yritämme yleensä tehdä jommankumman kahdesta asiasta. Yritämme joko tutkia biologiaa hyvin syvällisesti ja ymmärtää sitä, lisäämällä sen monimutkaisuutta, tai yritämme puuttua asiaan. Pystymme yhä useammin tutkimaan biologiaa hyvin, hyvin syvällä tasolla, jotta ymmärrämme hallitsevat lait tai säännöt, joilla solut säätelevät. Ja meillä on se, meillä on yhä kehittyneempiä työkaluja, kuten nämä ohjelmoitavat lääketieteen menetelmät, jossa voimme kohdistaa RNA:han hyvin, hyvin tarkasti. Tämä on eräänlainen hyveellinen kierre kykymme välillä tutkia biologiaa ja sitten puuttua siihen yhä kehittyneemmillä tavoilla. Ja mielestäni se on yksi jännittävimmistä näkökohdista, missä olemme tällä hetkellä tällä alalla.
RICK: Olen samaa mieltä kanssasi. Kehitämme nyt niin syvää ymmärrystä monimutkaisuuden monista kerroksista, että voimme esittää terapeuttisia hypoteeseja, joita emme ole ennen nähneet. Voimme tehdä ne nopeudella, jota emme koskaan kuvitelleet vain muutama vuosi sitten. Ajallinen etäisyys peruslöydön ja ihmisiin 10 vuotta sitten suunnatun terapian välillä oli keskimäärin 14 vuotta. Nyt on ajateltavissa kehittää perustieteeseen perustuva terapeuttinen hypoteesi ja terapia, joka saavuttaa potilaan yhdeksässä kuukaudessa. Olemme nähdä sen tämän uuden rokotteen kanssa.
HANNE: Muutetaan siis paitsi tapamme, jolla ymmärrämme sairauksien ilmaantumisen, miten käsittelemme niitä, myös sitä, miten teemme itse tiedettä, ja kuinka nopeasti tiede voi tapahtua ja muuttua potilaiden kliiniseksi todellisuudeksi.
RNA lokeroijana
RICK: Aivan. Mutta nyt on kirsikka kakun päällä, koska olemme perinteisesti ajatellut farmakologiaa kahdella tavalla. Yksi oli lääkkeen vaikutus yksilöön. Toinen oli henkilön vaikutus lääkkeeseen. Ja tässä jälkimmäisessä segmentissä olet huolissasi lääkkeen jakautumisesta, mihin kudoksiin se menee, mihin kudoksiin se ei ole saatavilla. Koska oletamme vain, että kun lääke joutuu soluun, se diffundoituu solun läpi ja löytää kohteensa. Meillä on kalvoon sidottuja osastoja, joista olemme tienneet vuosisadan ajan.
JORGE: Mikä oli aina kysymys solun läpäisevyydestä, eikö niin? Voiko se ylittää kalvon?
RICK: Kyllä. Voiko se ylittää kalvon, ja pääseekö se ytimeen vai ei? Mutta olemme vasta viime vuosikymmenen aikana ymmärtäneet, että soluissa on myös monia ei-membraanikappaleita biomolekyyliset kondensaatit koska uskotaan, että yksi syy näiden kappaleiden muodostumiseen on, että ne tiivistyvät aivan kuten vesi tiivistyy kastepisaraksi. Mutta mikä tässä ymmärryksessä on ollut niin syvällistä, on se, että nämä kondensaatit lokeroivat proteiineja, DNA:ta ja RNA:ta tiettyjä toimintoja varten. Ja niin nyt olemme ymmärtäneet, että voit erottaa solun 5-10 miljardia proteiini- ja RNA-molekyyliä eri osastoihin, joissa ne toimivat kavereidensa kanssa.
HANNE: Huh.
JORGE: Poistummeko biologian valtakunnasta ja astumme fysiikan maailmaan?
RICK: Olemme tehneet juuri niin, koska faasien erotuksen uskotaan olevan liikkeellepaneva voima. Se on matematiikan kuvaama fysikaalinen ilmiö.
HANNE: Vau.
RICK: Nyt olemme oppineet, että tehokkaimmat kemoterapeuttiset lääkkeet ovat keskittämällä osastoissa, joissa heidän kohteensa asuvat. Ne keskittyvät 600-kertaisesti muuhun soluun, joten niillä on kohdeaktiivisuutta onkogeenien suhteen, mikä on 600 kertaa odotettuamme. Tämä ei vain kerro meille, että on olemassa upouusia oivalluksia, jotka ovat tärkeitä lääkkeiden löytämisessä ja tulevaisuuden kehittämisessä, mutta se saa meidät haluamaan paremmin ymmärtää, mitä nämä kondensaatit tekevät.
Tässä on mitä tarkoitan kakun päällä. Olemme ymmärtäneet, että nämä kondensaattiosastot, jotka funktionalisoivat solua niin tärkeillä tavoilla, ovat RNA:n säätelemiä. Niiden muodostumista voidaan stimuloida RNA:lla. Jos tuotat liikaa RNA:ta, nostat reostaattia 11:een, se liuottaa kondensaattia. Yhtäkkiä ymmärrämme, että RNA-lähtö missä tahansa solun sisällä voi virittää minkä tahansa toiminnan tehostamalla tai liuottamalla niitä kondensaatteja, joissa tämä toiminto tapahtuu. Ja se on mielestäni syvällistä, koska se on toinen tapa, jolla ohjelmoitavaa RNA:ta, synteettistä RNA-molekyyliä, voidaan käyttää säätämään solun toimintaa, josta on tullut toimintahäiriö. Ensimmäistä kertaa meillä on kaikki nämä mallit, joilla asennat laitteen ja saat sen toimimaan.
HANNE: Toinen nuppi numeroon.
RICK: Mutta kuinka sitten sammutat sen? Osoittautuu, että kun teet tuon pitkän RNA:n, se on vain suuri negatiivisten varausten sarja, ja se liuottaa kondensaatin ja sulkee geenin. Näin geenit säätelevät. Säädät kondensaattia RNA:lla ja suljet sen sitten RNA-tuotteella, joka syntyy, kun geeni transkriptoituu kokonaan.
HANNE: Todella siistiä. Siis todellakin pois ja päälle -kytkin.
RICK: Se on off/on-kytkin, jota kukaan ei odottanut. Ja se tarkoittaa jälleen kerran, että jos sinulla on ohjelmoitava lääke, sinulla on uusi tapa kohdistaa solujen toimintahäiriöitä, uusi ratkaisu terapeuttiseen ongelmaan.
JORGE: Yhden miehen roska-DNA on toisen miehen hienostunut genomin säätelykoneisto.
HANNE: Tai jokaisen miehen.
Lähetetty 15. heinäkuuta 2022
Tekniikka, innovaatiot ja tulevaisuus, kuten sitä rakentajat kertovat.
- Andreessen Horowitz
- Bio & Tiede
- Bitcoin
- blockchain
- lohkoketjun noudattaminen
- blockchain-konferenssi
- coinbase
- coingenius
- Yhteisymmärrys
- salauskonferenssi
- kryptointi
- kryptovaluutta
- hajautettu
- defi
- Digitaaliset varat
- ethereum
- koneoppiminen
- ei korvattava tunnus
- Platon
- plato ai
- Platonin tietotieto
- Platoblockchain
- PlatonData
- platopeliä
- Monikulmio
- todiste panoksesta
- W3
- zephyrnet