Introduction
Deux articles récents ont montré qu'au cours d'une première période critique du développement du cerveau, le microbiome de l'intestin - l'assortiment de bactéries qui s'y développent - aide à façonner un système cérébral qui est important pour les compétences sociales plus tard dans la vie. Les scientifiques ont trouvé cette influence chez les poissons, mais des preuves moléculaires et neurologiques suggèrent de manière plausible qu'une certaine forme de celle-ci pourrait également se produire chez les mammifères, y compris les humains.
In un document publié début novembre dans PLOS Biologie, les chercheurs ont découvert que les poissons zèbres qui ont grandi sans microbiome intestinal étaient beaucoup moins sociaux que leurs pairs avec des colons colonisés, et la structure de leur cerveau reflétait la différence. Dans un article lié in Génomique BMC fin septembre, ils ont décrit les caractéristiques moléculaires des neurones affectés par les bactéries intestinales. Des équivalents de ces neurones apparaissent chez les rongeurs, et les scientifiques peuvent désormais les rechercher chez d'autres espèces, y compris les humains.
Au cours des dernières décennies, les scientifiques ont compris que l'intestin et le cerveau ont de puissantes influences mutuelles. Certains types d'ulcères intestinaux, par exemple, ont été associés à une aggravation des symptômes chez les personnes atteintes de la maladie de Parkinson. Et les cliniciens savent depuis longtemps que les troubles gastro-intestinaux sont plus fréquents chez les personnes qui souffrent également de troubles du développement neurologique, tels que le TDAH et les troubles du spectre autistique.
"Non seulement le cerveau a un impact sur l'intestin, mais l'intestin peut aussi profondément affecter le cerveau", a déclaré Kara Margolis, un gastro-entérologue pédiatrique au Langone Health de l'Université de New York, qui n'a pas participé à la nouvelle recherche. Cependant, la façon dont ces organes anatomiquement séparés exercent leurs effets est beaucoup moins claire.
Philippe Washbourne, biologiste moléculaire à l'Université de l'Oregon et l'un des principaux co-auteurs des nouvelles études, étudie les gènes impliqués dans l'autisme et le développement des comportements sociaux depuis plus de deux décennies. Mais lui et son laboratoire cherchaient un nouvel organisme modèle, un organisme qui affichait un comportement social mais qui était plus rapide et plus facile à reproduire que leurs souris préférées. « Pouvons-nous faire cela avec du poisson ? » il se souvient d'avoir pensé, puis: "Soyons vraiment quantitatifs et voyons si nous pouvons mesurer à quel point les poissons deviennent amicaux."
Poisson sans germes
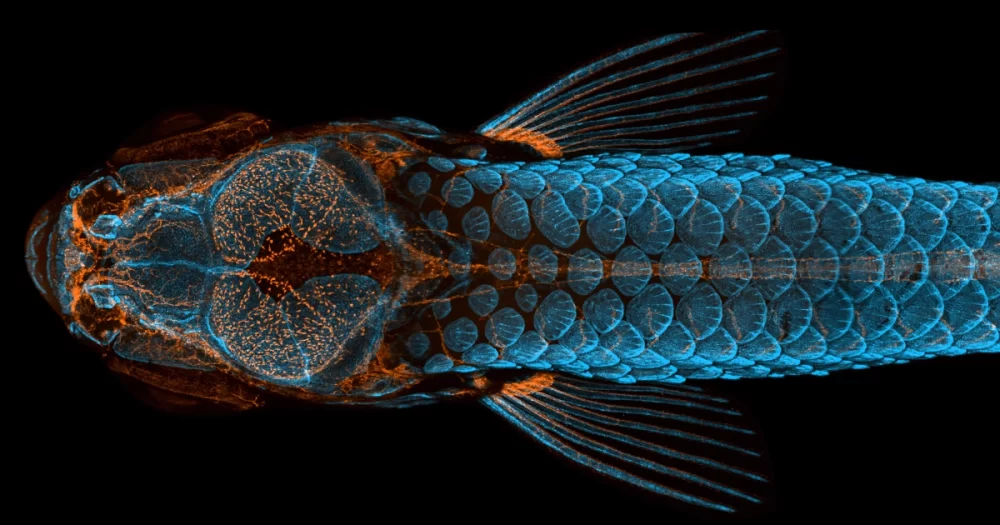
Les poissons zèbres, qui sont également largement utilisés dans la recherche génétique, se reproduisent rapidement et sont naturellement sociaux. Après avoir atteint l'âge de deux semaines, ils commencent à traîner en bancs de quatre à 12 poissons. Ils sont également transparents jusqu'à l'âge adulte, ce qui permet aux chercheurs d'observer leur développement interne sans avoir à les disséquer, un exploit pratiquement impossible dans les modèles mammifères, comme les souris.
L'équipe a commencé à expérimenter avec des embryons d'une lignée de poissons zèbres "sans germes" élevés pour ne pas avoir de microbiome intestinal. Après l'éclosion des petits poissons, les chercheurs ont immédiatement inoculé certains d'entre eux avec un mélange sain de bactéries intestinales. Mais ils ont attendu une semaine complète avant d'inoculer les poissons restants, les obligeant à commencer leur développement avec une ardoise vierge.
Les poissons qui avaient été inoculés à la naissance ont commencé à grandir comme prévu, à environ 15 jours. Mais quand est venu le temps pour les poissons sans germes de commencer, "étonnamment, ils ne l'ont pas fait", a déclaré Judith Eisen, neuroscientifique à l'Université de l'Oregon et co-auteur de la nouvelle recherche. Même si les poissons avaient été dosés rétroactivement avec des microbes intestinaux, ils n'atteignaient pas les mêmes étapes de développement social que leurs pairs.
Lorsque Eisen, Washbourne et leur équipe ont examiné le cerveau des poissons, ils ont découvert des différences structurelles évidentes. Chez les poissons qui ont passé leur première semaine de vie sans microbiome, un groupe spécifique de neurones du cerveau antérieur qui affectent le comportement social a montré plus d'interconnexions. Le cluster avait également beaucoup moins de microglie, les cellules immunitaires neurales responsables du nettoyage des détritus dans le cerveau. "Ce sont de grands changements majeurs dans le système nerveux", a déclaré Eisen. "Pour moi, c'est énorme."
L'équipe a émis l'hypothèse qu'un microbiote intestinal sain permet en quelque sorte à la microglie de s'épanouir dans le cerveau des poissons zèbres. Ensuite, pendant certaines périodes de développement critiques, la microglie agit comme des agents de maintenance, taillant les «bras» extrêmement ramifiés des neurones. Sans microglie pour les tailler, les neurones sociaux des poissons sans germes se sont emmêlés et envahis comme une ronce non entretenue.
La façon dont les microbes intestinaux envoient des signaux au cerveau en développement des poissons pour produire ces effets n'est pas claire. Les bactéries libèrent une gamme stupéfiante de produits chimiques, et tout composé suffisamment petit pourrait théoriquement traverser la barrière hémato-encéphalique. Mais il est également possible que les cellules immunitaires se déplaçant entre l'intestin et le cerveau transportent avec elles des molécules de signal, ou que certains signaux remontent de l'intestin le long du nerf vague.
De nombreuses espèces sociables
Des mécanismes similaires peuvent être en jeu dans le développement social d'autres vertébrés, y compris les humains. Le regroupement social est une stratégie de survie courante dans tout le règne animal. "C'est l'un des comportements les plus préservés à travers l'évolution", a déclaré Livia Hecke Morais, un biologiste chercheur au California Institute of Technology qui n'a pas participé aux nouvelles études.
En fait, Washbourne et Eisen avaient précédemment identifié des neurones sociaux presque identiques chez la souris. "Si vous pouvez trouver les mêmes types de cellules entre un poisson et une souris, vous pouvez probablement trouver les mêmes types de cellules chez l'homme", a déclaré Washbourne.
Introduction
Morais a toutefois averti que ni les poissons zèbres ni les souris ne sont des analogues parfaits pour les êtres humains – ou les uns pour les autres. Les voies neuronales sont un peu différentes chez les poissons et les souris, a-t-elle déclaré. Et chacun de ces organismes possède un ensemble distinct de microbes intestinaux, qui peuvent libérer différents signaux chimiques.
Néanmoins, le principe pourrait être largement vrai pour divers groupes d'organismes. Il est possible que différents produits chimiques microbiens puissent encore influencer l'abondance microgliale dans le cerveau des poissons zèbres, des souris, des humains et d'autres animaux, a déclaré Eisen. Mais elle convient qu'il est dangereux de confondre sans équivoque différentes espèces. Les organismes modèles "ne sont pas exactement les mêmes que les gens", a-t-elle déclaré.
Une multiplicité de microbiomes
À l'avenir, Eisen, Washbourne et leurs équipes veulent déterminer exactement comment les microbes intestinaux du poisson zèbre envoient des signaux à son cerveau. Ils veulent également établir la durée de la période sensible du développement neurologique, pour voir si une intervention précoce dans l'intestin peut remettre le développement du cerveau sur les rails. Finalement, ils espèrent que cette recherche fournira une meilleure compréhension de la façon dont les troubles neurodéveloppementaux surviennent chez les personnes - bien que cela puisse s'avérer difficile.
"Le problème est que l'hypothèse doit être testée chez l'homme", a déclaré Margolis, "mais c'est très difficile à faire." La logistique de la conception d'un essai clinique pour tester les interventions intestinales chez les nourrissons humains serait difficile car des conditions telles que les troubles du spectre autistique ne sont généralement pas diagnostiquées avant l'âge de 7 ans ou plus, probablement longtemps après la fermeture de la fenêtre critique.
Les microbiomes varient également de manière significative même entre les individus de la même espèce. Deux personnes qui semblent presque identiques à bien des égards peuvent avoir des communautés microbiennes intestinales qui diffèrent de plus de 70 %. Le simple fait de regarder le microbiome d'une personne n'est pas un outil de diagnostic utile pour les troubles neurodéveloppementaux. "Il n'y a pas un seul microbiome autistique", a déclaré Margolis.
Pour Washbourne, si cette période de développement sensible existe chez l'homme, cela pourrait rendre l'intervention presque impossible. "Je ne pense pas que nous nous rapprochions d'une solution miracle", a-t-il déclaré. Mais même être capable de caractériser l'effet de l'intestin sur le cerveau d'une certaine manière aide à percer un mystère humain profondément complexe. Pour l'instant, dit-il, ça suffit.