Rick Young è un professore di biologia al MIT che studia l'RNA trascritto dalla parte del genoma che non codifica per proteine, noto come DNA non codificante. Questa parte del genoma una volta veniva chiamata "DNA spazzatura", il che dà un'idea di ciò che molti pensavano del suo valore. Gli scienziati sono rimasti sorpresi nello scoprire che costituisce il 98% del genoma umano, il che ha innescato una ricerca per trovarne le funzioni.
In questa conversazione, Rick Young chiacchiera con Hanne Winarsky da Bio Eats World e socio accomandatario a16z Jorge Condé, che guida gli investimenti all'intersezione tra biologia, informatica e ingegneria. Prima di entrare in a16z, Conde è stato Chief Strategy Officer presso Syros Pharmaceuticals e ha co-fondato la società di interpretazione genomica Knome.
La conversazione riguarda ciò che abbiamo appreso riguardo a quel 98% del genoma che pensavamo fosse spazzatura. Si scopre che ha diversi compiti, dal nascondere le prove di antiche infezioni virali al rendere unico ogni volto. Discutono anche del suo ruolo enorme ma ancora poco compreso nelle malattie e di come lo studio del DNA spazzatura abbia portato alla scoperta di un interruttore di accensione/spegnimento del gene che nessuno si aspettava.
Nota: questa conversazione è stata originariamente pubblicata come episodio di Bio mangia il mondo. Puoi ascoltare quell'episodio qui.
HANNE WINARSKY: Siamo qui oggi per parlare di quello che viene chiamato DNA spazzatura. Possiamo iniziare con una semplice definizione?
RICK YOUNG: È un termine vecchio di mezzo secolo. Gli scienziati conoscevano porzioni del genoma che non codificano proteine, e lo sapevano teorizzato che questa era spazzatura. Sapevamo che alcuni di essi erano solo i resti di antiche invasioni virali del genoma. Ma quella frase, DNA spazzatura, ci ha perseguitato.
HANNE: Allora qual è il termine che stai cercando di usare invece? La materia oscura del DNA di cui ogni giorno comprendiamo di più?
RICK: DNA non codificante.
HANNE: Perché lo consideravano detriti? Hai menzionato che alcuni di essi erano residui di vecchi virus. Ma perché non era solo un mistero fin dall'inizio?
RICK: Perché nel corso della storia biologica c'è stato questo dibattito su quale fosse il materiale genetico e inizialmente si pensava che fossero proteine. Ma una volta che divenne chiaro che le proteine erano il meccanismo e il DNA il modello del meccanismo, la gente si diede da fare perché i difetti del meccanismo causano le malattie. Ma poi si è scoperto che solo il 2% del genoma codifica gli aminoacidi delle proteine. La stragrande maggioranza, il 98%, non lo fa. E nel 2000, quando gli scienziati del Progetto Genoma Umano presentata la sequenza del genoma umano, quei dati hanno confermato che il 98% dei nostri 3.2 miliardi di basi non codificano proteine.
Ogni gene ha la straordinaria capacità di prendere pezzetti di segmenti della proteina che codificherà e di organizzarli in modo che il prodotto che si ottiene in una cellula possa funzionare un po' più velocemente, o in un'altra cellula possa effettivamente andare in un'altra cellula. compartimento per fare un lavoro diverso.
JORGE CONDE: Quali erano le stime iniziali su quanti geni sarebbero stati codificati in quei 3.2 miliardi di paia di basi?
RICK: Abbiamo deciso per circa 100,000. Abbiamo semplicemente ipotizzato che più siamo complessi, più grande è il genoma e maggiore è il numero di geni. Siamo rimasti un po’ scioccati quando ci siamo resi conto che noi e gli insetti abbiamo più o meno lo stesso numero di geni.
JORGE: Meno geni di quanto ci aspettavamo codificassero per quello che consideriamo un organismo incredibilmente complesso, giusto?
HANNE: E' un po' uno shock.
Stesso codice sorgente, programmi diversi
JORGE: Una cosa che abbiamo imparato tutti al liceo è che i codici del DNA per l'RNA, i codici dell'RNA per gli amminoacidi e gli amminoacidi ci danno le proteine, giusto? Questo è il dogma centrale della biologia moderna.
RICK: Sì. Uno dei motivi principali per cui le persone si sono affrettate ad attribuire il titolo di "DNA spazzatura" a quel 98% del genoma che non codifica per proteine è perché si credeva, in gran parte, che lo scopo del genoma fosse quello di creare proteine.
JORGE: Allora quando i genetisti hanno iniziato ad avere la sensazione che il DNA spazzatura potrebbe essere più che spazzatura?
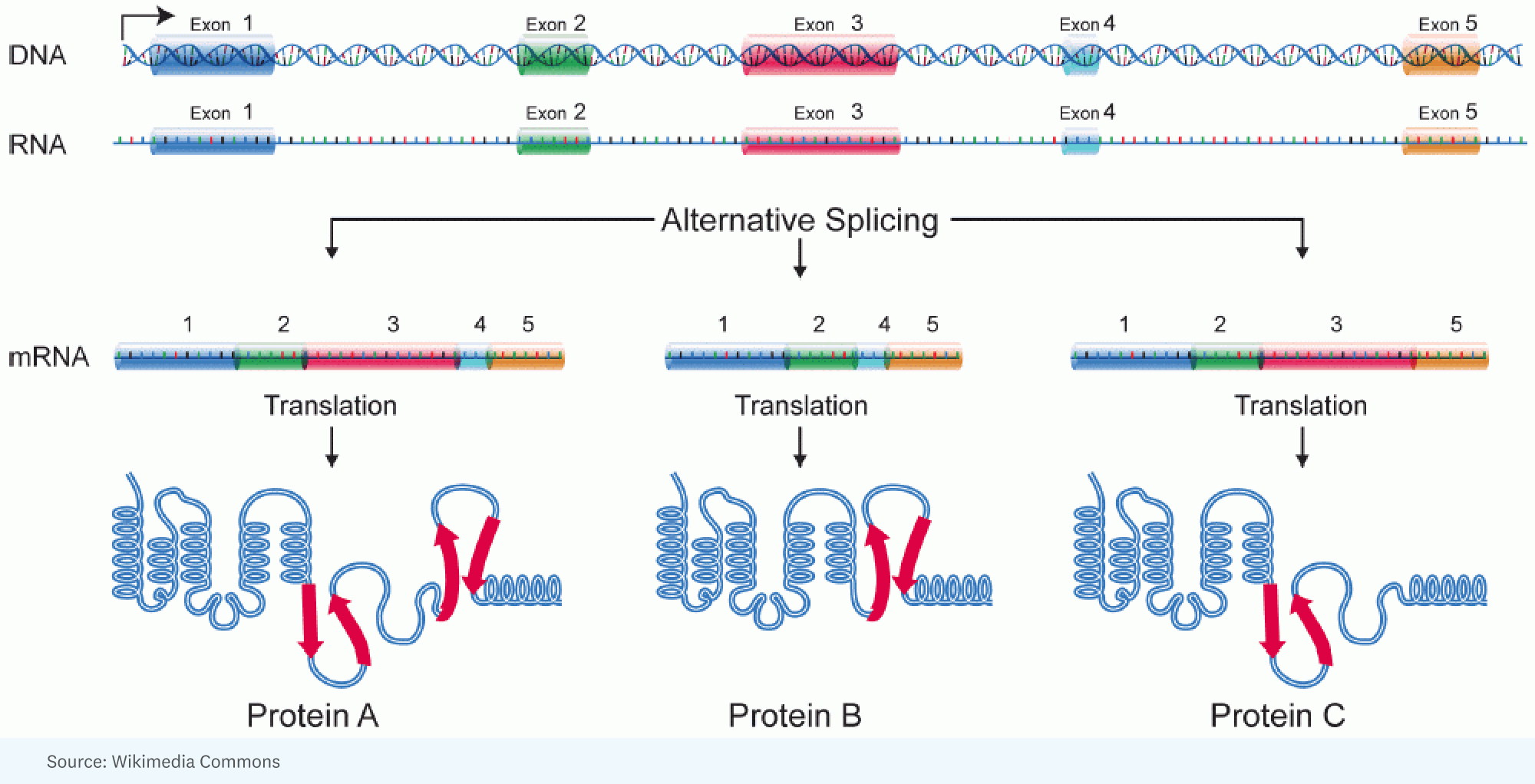
RICK: [Tutto è iniziato con] la consapevolezza che si poteva spiegare la complessità aggiuntiva tra gli esseri umani e gli insetti attraverso un'enorme quantità di splicing alternativo. È lì che si ha, per un singolo gene, un grande RNA che viene prodotto, ma viene unito in modo diverso in una cellula rispetto a un'altra cellula. In altre parole, porzioni diverse del gene finiscono nella molecola di RNA che specificherà la proteina. Quindi la proteina è leggermente diversa.
HANNE: Sembra un po' un caleidoscopio con la luce che lo colpisce in modo diverso, si ottengono colori diversi, angolazioni diverse.
RICK: Beh, e questa è un'analogia interessante. Penso che un'analogia migliore sia quando hai questi Lego e puoi costruire una macchina, ma puoi realizzarla in tanti modi diversi, in tante strutture e colori diversi. Ogni gene ha la straordinaria capacità di prendere pezzetti di segmenti della proteina che codificherà e di organizzarli in modo che il prodotto che si ottiene in una cellula possa funzionare un po' più velocemente, o in un'altra cellula possa effettivamente andare in un'altra cellula. compartimento per fare un lavoro diverso.
JORGE: Ogni singola cellula di un dato essere umano ha approssimativamente lo stesso genoma. Eppure lo stesso genoma dà origine a una gamma incredibilmente diversificata di diversi tipi di cellule. Quindi, nella misura in cui faremo un'analogia, ogni tipo di cella esegue un programma diverso dallo stesso codice sorgente.
RICK: Esatto.
Le funzioni del 98%
JORGE: Non è necessario essere un esperto per osservare i diversi tipi di cellule e vedere quanto possono essere vari, giusto? Un neurone ha un aspetto molto, molto, molto diverso e funziona in modo molto, molto diverso rispetto, ad esempio, a una cellula muscolare. Cosa determina il programma, il programma genetico che una cellula sceglie di eseguire? Cosa rende una cellula muscolare una cellula muscolare e cosa rende un neurone un neurone?
RICK: Quindi abbiamo iniziato con il DNA che produce RNA e l'RNA che produce proteine. Questo è il dogma centrale. Ma circa mezzo secolo fa, gli scienziati iniziarono a sostenere che in realtà l’RNA aveva cominciato a creare vari tipi di funzioni da solo. E si scopre che l'RNA in realtà svolge parte dell'attività nelle prime fasi dello sviluppo.
Quando lo sperma incontra l'ovulo, è l'RNA della madre che ella inserisce nell'ovulo. Ci sono molecole di RNA che fanno questo. Si scopre che gli antibiotici che usiamo abitualmente si legano all'RNA. Quindi l'RNA ha alcuni ruoli piuttosto importanti lì. Ciò ha cambiato il modo di pensare delle persone. Poi, quando abbiamo iniziato a pensare al DNA spazzatura, quella è la parte del DNA che non codifica per le proteine. Ebbene, e se il mondo fosse basato sull'RNA e non sulle proteine, almeno per il momento? inizio? E così ora capiamo che un'enorme frazione di ciò che chiamiamo DNA spazzatura, o quello che chiamavamo DNA spazzatura, non è spazzatura. È altamente funzionale. E la maggior parte produce RNA.
Quindi il vostro obiettivo nel programmare una qualsiasi cellula è usare proprio quello specifico insieme di sequenze che sintonizzeranno ciascuno di quell'insieme comune di geni al livello desiderato. . . Il nostro problema è che in realtà non conosciamo il programma.
HANNE: Wow. Puoi farci un'idea di dove siamo nella comprensione della parte non codificante del DNA? Sai, qual è la nostra attuale comprensione di tutte le diverse possibilità lì?
RICK: Solo il 2% del nostro genoma codifica queste sequenze di amminoacidi che vanno nelle proteine. Allora cosa c'è nel registro del nostro contabile per quello che fa il resto?
Circa la metà del nostro genoma è ciò che chiamiamo eterocromatina. È lì che si ottengono i prodotti di antiche invasioni virali. Antichi retrovirus hanno invaso e poi sono stati trasformati in DNA e inseriti nel genoma. Questo in realtà è un mezzo che abbiamo avuto nel corso della nostra storia evolutiva per nascondere sequenze che non vogliamo affrontare. E rimane silenzioso nel nostro genoma con un'importante eccezione.
L'altra metà è dove si trovano tutti i geni codificanti proteine attive e dove si trovano tutti i geni non codificanti attivi. Quindi, che cosa fa? Ha un lungo elenco di funzioni normative, ma lo semplificherò in tre.
Una delle sue funzioni è il mantenimento dei cromosomi. Quindi, quelli sono i luoghi in cui avviene la replicazione del DNA. Sono i siti del nostro genoma responsabili del suo ripiegamento perché è un polimero lungo 2 metri. Deve ripiegarsi in un nucleo del diametro di un paio di micron.
La seconda regione regolatoria comprende tutte queste cose responsabili della regolazione genetica. Probabilmente molto più del genoma specifica le caratteristiche regolatrici dell'espressione genetica di quanto non specifichi i geni stessi. E questo perché ogni cellula utilizza una regione regolatrice diversa per ciascun gene.
HANNE: È così interessante, mi sembra quasi che ci sia l'armadio con gli scaffali sopra delle cose che dobbiamo mettere nell'armadio per un po', e poi c'è l'armadio delle infrastrutture.
Perché è importante concentrarsi così tanto su questo? Perché è lì che si verifica oltre il 75% di tutte le variazioni genetiche associate alle malattie.
RICK: Sì. Fondamentalmente, ciò che abbiamo è un insieme comune di geni in ogni cellula, sia codificanti che non codificanti. E hai elementi, hai sequenze effettive che operano solo in tipi di cellule specifici. Quindi il vostro obiettivo nel programmare una qualsiasi cellula è usare proprio quello specifico insieme di sequenze che sintonizzeranno ciascuno di quell'insieme comune di geni al livello desiderato. Quindi stai suonando uno straordinario strumento musicale composto da 20,000 geni codificanti proteine e circa lo stesso numero di geni non codificanti. Lo stai facendo attraverso sequenze specifiche. Il nostro problema è che in realtà non conosciamo il programma.
Elaborazione del programma normativo
HANNE: Allora come inizi a capirlo? Quali sono i suggerimenti che segui quando inizi a provare a comprendere questo programma?
RICK: Il indizio è che le regioni regolatrici di ciascun gene in una cellula si mostrano da sole. Te lo dicono. E puoi usare varie tecnologieQuesto ti dice molto rapidamente attraverso l'intero genoma, in un particolare tipo di cellula, diciamo in un motoneurone, quali sono tutte le regioni regolatrici presenti in quella cellula. Puoi anche vedere dove è impostato il reostato per ciascuno di questi geni. È qui che il sequenziamento rapido ci ha dato la capacità di dedurre simultaneamente tutti gli elementi attivi dei geni, sia codificanti che non codificanti, nel genoma di un particolare tipo di cellula.
Il nostro problema al momento è che devi farlo praticamente un tipo di cellula alla volta, e abbiamo molte, molte centinaia di tipi di cellule. A volte è difficile vedere effettivamente una cellula particolare senza contaminarla con altre cellule, perché tutti i nostri tessuti sono in realtà combinazioni di più tipi di cellule.
JORGE: Vale la pena discutere per analogia se dicessimo che, dato che ogni cellula ha l'intero genoma, ogni cellula ha l'intero libro dei canti, tipi cellulari specifici scelgono di suonare sinfonie specifiche e il meccanismo che aiuta a regolare il genoma è essenzialmente il conduttore di l'Orchestra? Quel macchinario è il direttore d'orchestra che determina quali canzoni suonare, quali note suonare, a quale volume suonarle, a quale tempo, ecc. È un'analogia ragionevole con la comprensione della funzione regolatrice del genoma?
RICK: Nel senso che è facile vedere quale sarebbe il risultato. Ma la cosa più impegnativa è: chi scrive tutte le note? Chi è il compositore che ha messo tutte quelle note lì dentro e ha capito tutto bene? Il compositore risulta essere, per la maggior parte delle nostre cellule e della maggior parte dei nostri geni, queste molecole proteiche chiamate fattori di trascrizione, il cui compito è legarsi agli elementi regolatori dei geni e fornire loro un'impostazione reostatica.
Ora, c'è un aspetto interessante in questo perché nei siti in cui si legano questi fattori di trascrizione, li chiamiamo potenziatori. In questi siti potenziatori c'è sempre anche un RNA che viene prodotto da quel sito dove sono legati. Solo di recente siamo arrivati a capire che l’RNA svolge un ruolo importante nella regolazione. Giusto per amplificarlo: il modo in cui il tuo iPhone riconosce il tuo viso è perché gli potenziatori che controllano i geni della struttura facciale cranica variano in ogni essere umano.
Quello che abbiamo qui adesso è questo triumvirato. Hai la sequenza del DNA. Viene riconosciuto specificamente dalla molecola che lo compone, il fattore di trascrizione, ma ha bisogno di questo terzo pezzo, questa molecola di RNA. Quindi il DNA, l’RNA e le proteine lavorano effettivamente insieme in quelle regioni regolatrici. E perché è importante concentrarsi così tanto su questo? Perché è lì che si verifica oltre il 75% di tutte le variazioni genetiche associate alle malattie.
HANNE: Non per diventare troppo musicalmente nerd, ma suona quasi come un accordo, giusto? La struttura a tre note suona tutte insieme per creare qualcosa di più grande.
RICK: Esatto.
I programmatori
JORGE: Una delle aree più all'avanguardia della biologia è la nostra crescente capacità di cercare di comprendere alcune delle leggi che governano come vengono determinati i programmi cellulari, come viene determinato il destino delle cellule. Per me uno degli affascinanti passi avanti nella nostra comprensione è venuto dal lavoro svolto da Yamanaka, per il quale gli è stato assegnato il Premio Nobel, dimostrando che è possibile riprogrammare i tipi di cellule semplicemente esponendole a una manciata molto piccola di fattori di trascrizione specifici.
HANNE: Puoi descrivere esattamente il motivo per cui si è trattato di un tale passo avanti per il settore?
RICK: Ho avuto un piccolo ruolo in quel film. Si scopre che, sebbene si tratti di un numero molto elevato, un piccolo numero di fattori di trascrizione può identificare tutti gli elementi regolatori essenziali per l'identità di quella cellula. E Yamanaka ce lo ha dimostrato mostrando che solo quattro di questi fattori potrebbero essere usati per programmare qualsiasi cellula umana, o qualsiasi cellula maschile, nell'equivalente di una cellula staminale embrionale.
Un modo per pensarci è che se la canzone è troppo brutta, l'organismo non vive. Ma se è solo un po' fuori, cresci, diventi adulto e poi acquisisci tutte queste varie malattie man mano che invecchiamo.
JORGE: E questo è fantastico, vero? Perché ciò suggerirebbe che il sistema è in qualche modo progettato in cui l’incredibile complessità viene ricavata da ciò che sembra semplicità. Quattro fattori di trascrizione che determinano tutta la complessa cascata di eventi che governano i diversi tipi di cellule.
Parte del lavoro da voi svolto ha dimostrato che questi fattori principali di trascrizione costituiscono essenzialmente l'equivalente dei circuiti che controllano i geni necessari affinché una cellula stabilisca e mantenga il suo stato. Puoi descrivere cosa intendi per circuiti di controllo genetico?
RICK: Ci sono due elementi interessanti nei circuiti di controllo genetico. Il primo è che quando un regolatore principale trova questi potenziatori e provoca l'espressione dei suoi geni bersaglio, quella è una parte del circuito, quello è l'output. L'altro elemento interessante è che i fattori principali di trascrizione regolano anche la propria espressione. Quindi c'è un ciclo di feedback. Ad esempio, avresti uno schema elettrico in cui i padroni controllano la propria espressione dai propri geni e quindi si legano e controllano l'espressione di un insieme di geni bersaglio.
JORGE: E' piuttosto assurdo. È quasi come un riferimento circolare, dove i fattori di trascrizione sono proteine, che la proteina è costituita da DNA, codificata in un gene. I fattori di trascrizione fanno parte del meccanismo che aiuta l'espressione nella trascrizione dei geni. E quindi, stai dicendo che i fattori di trascrizione – le proteine – aiutano a regolare l'espressione dei geni che producono i fattori di trascrizione.
HANNE: Sì. C'è un'immagine mentale di tutta questa sinfonia di tutte queste piccole cellule, sai, che cantano tutte queste diverse trame.
Il genoma regolatore e la malattia
HANNE: Cosa cambia quando cominciamo a capire come funziona tutto questo? Cosa possiamo fare con questa conoscenza?
RICK: Questi siti dove questi fattori principali di trascrizione guidano l'identità di ogni cellula sono dove si trova la maggior parte della variazione umana che causa la malattia. Oltre il 75% delle variazioni associate alla malattia si verificano in questi elementi potenziatori che guidano i geni chiave.
JORGE: Va bene. Quindi è pazzesco, vero? Quando pensiamo alle mutazioni che causano o contribuiscono alla malattia, normalmente pensiamo a una mutazione che si verifica all'interno di un gene che colpisce la proteina, in qualche modo rompe la proteina e dà origine alla malattia.
HANNE: Giusto.
JORGE: Ma quello che stai dicendo è che nel 75% dei casi, la mutazione avviene effettivamente al di fuori dei geni, avviene in questa regione non codificante del genoma. Se il gene è la canzone, non è che la canzone venga suonata male, è che potrebbe essere suonata troppo forte, o troppo piano, o troppo lentamente, o troppo velocemente, ma questo è ciò che provoca molte malattie.
RICK: In effetti, un modo di pensarci è che se la canzone è troppo brutta, l'organismo non vive. Ma se è solo un po' fuori, cresci, diventi adulto e poi acquisisci tutte queste varie malattie man mano che invecchiamo.
Per la prima volta abbiamo tutti questi modelli su come impostare l'apparato e farlo funzionare.
JORGE: Non creando la versione sbagliata del gene, ma ottenendo il dosaggio sbagliato del gene. Troppo o troppo poco.
RICK: Esatto. Come trovare terapie che affrontino questo problema? Come si ottimizza o attenua selettivamente il gene? In linea di principio, possiamo farlo in molti modi, e possiamo farlo con la terapia genica. Possiamo farlo con l’editing genetico CRISPR. Ma la cosa più importante che penso che abbiamo scoperto negli ultimi anni è che ciascuno di questi elementi regolatori dei geni ha un RNA. L'RNA è funzionale. È un reostato che aiuta a regolare l'output di quel gene. Ora ci sono molti modi in cui puoi RNA dei farmaci. Abbiamo ASO (oligonucleotidi antisenso), come Spinraza per l'atrofia muscolare spinale. Abbiamo un'interferenza dell'RNA. Abbiamo alcuni nuovi farmaci a piccole molecole all'orizzonte. Se potessimo pensare a come programmare ora un farmaco, un RNA sintetico, per regolare l'RNA regolatore, l'RNA regolatore, avremmo il modo principale di sintonizzare qualsiasi gene in qualsiasi cellula in cui quella cellula può accedere a quel farmaco.
HANNE: Quindi non si tratta solo di una comprensione completamente diversa di come emerge la malattia. Ma si tratta di una comprensione completamente diversa di come potremmo potenzialmente trattare le malattie.
RICK: Esattamente. In linea di principio, ora disponiamo di un modo programmabile per sviluppare un farmaco che sintonizzi qualsiasi gene di interesse. In questo momento, le persone stanno semplicemente programmando molecole di RNA sintetico per produrre un vaccino per questa pandemia. Uno dei risultati migliori che ci si potrebbe mai aspettare da un vaccino.
JORGE: Quando pensiamo alle applicazioni di tecnologia in biologia, di solito proviamo a fare una delle due cose. O stiamo cercando di interrogare la biologia molto profondamente e di comprenderla, aumentando i livelli della sua complessità, oppure stiamo cercando di intervenire. Siamo sempre più in grado di interrogare la biologia a un livello molto, molto profondo in modo da comprendere le leggi che governano o le regole su come le cellule sono regolate. E noi ce l'abbiamo, abbiamo strumenti sempre più sofisticati, come questi modalità programmabili della medicina, dove possiamo prendere di mira l'RNA in modo molto, molto specifico. Sarà una sorta di circolo virtuoso tra la nostra capacità di interrogare la biologia e poi di intervenire in modi sempre più sofisticati. E penso che questo sia uno degli aspetti più interessanti di dove ci troviamo oggi in questo campo.
RICK: Sono d'accordo con te. Ora stiamo sviluppando una comprensione così profonda dei molteplici livelli di complessità che possiamo elaborare ipotesi terapeutiche mai viste prima. Possiamo realizzarli con una velocità che non avremmo mai immaginato solo pochi anni fa. La distanza temporale tra una scoperta fondamentale e la terapia applicata alle persone 10 anni fa era in media di 14 anni. Ora è pensabile pensare di sviluppare un'ipotesi terapeutica basata sulla scienza di base e una terapia che raggiunga il paziente in nove mesi. Erano visto che con questo nuovo vaccino.
HANNE: Quindi, cambiando non solo il modo in cui comprendiamo l'emergere delle malattie, il modo in cui le trattiamo, ma anche il modo in cui facciamo la scienza stessa, e quindi la velocità con cui la scienza può svilupparsi e trasformarsi in realtà clinica per i pazienti.
RNA come compartimentatore
RICK: Esattamente. Ma ora c'è la ciliegina sulla torta perché, tradizionalmente, abbiamo pensato alla farmacologia in due modi. Uno era l'effetto del farmaco sull'individuo. L'altro era l'effetto dell'individuo sul farmaco. E in quest'ultimo segmento, sei preoccupato per la distribuzione del farmaco, in quali tessuti va, in quali tessuti non è disponibile. Perché presupponiamo semplicemente che una volta che un farmaco entra in una cellula, si diffonde attraverso la cellula e trova il suo bersaglio. Abbiamo compartimenti delimitati da membrana, che conosciamo da un secolo.
JORGE: Qual è sempre stata la questione della permeabilità cellulare, giusto? Può attraversare la membrana?
RICK: Sì. Può attraversare una membrana ed entrare nel nucleo oppure no? Ma solo nell'ultimo decennio abbiamo capito che nelle cellule ci sono anche molti corpi non di membrana chiamati condensati biomolecolari perché si pensa che una delle ragioni per cui questi corpi si formano è che si condensano in modo molto simile all'acqua che si condensa in una goccia di rugiada. Ma l’aspetto più profondo di questa comprensione è che questi condensati suddividono in compartimenti proteine, DNA e RNA per funzioni specifiche. E così ora siamo arrivati a capire che è possibile separare dai 5 ai 10 miliardi di molecole di proteine e RNA presenti in una cellula in vari compartimenti dove funzionano con i loro compagni.
HANNE: Eh.
JORGE: Stiamo lasciando il regno della biologia ed entrando nel regno della fisica?
RICK: Abbiamo fatto esattamente questo perché si ritiene che la separazione di fase sia la forza trainante. Questo è un fenomeno fisico descritto dalla matematica.
HANNE: Wow.
RICK: Ora, abbiamo imparato che i farmaci chemioterapici più efficaci sono concentrandosi all'interno dei compartimenti in cui vivono i loro obiettivi. Si stanno concentrando 600 volte rispetto al resto della cellula, quindi hanno un'attività mirata sugli oncogeni che è 600 volte quella che ci aspettavamo. Questo non solo ci dice che ci sono nuove intuizioni che sono importanti per la scoperta e lo sviluppo di farmaci per il futuro, ma ci fa venire voglia di capire meglio cosa fanno questi condensati.
Ecco cosa intendo per ciliegina sulla torta. Ciò che siamo arrivati a capire è che questi compartimenti condensati che funzionalizzano la cellula in modi così importanti sono regolati dall'RNA. La loro formazione può essere stimolata dall'RNA. Se produci troppo RNA, porti il reostato fino a 11, scioglierà un condensato. Quindi, all'improvviso, ci rendiamo conto che l'RNA prodotto in qualsiasi sito all'interno di una cellula può regolare la funzione di qualsiasi cosa potenziando o dissolvendo i condensati in cui si verifica quella funzione. E questo, credo, è profondo perché è un altro modo in cui un RNA programmabile, una molecola di RNA sintetico, potrebbe essere impiegato per regolare la funzione di una cellula che è diventata disfunzionale. Per la prima volta abbiamo tutti questi modelli su come impostare l'apparato e farlo funzionare.
HANNE: Un'altra manopola da manovrare.
RICK: Ma allora come lo spegni? Si scopre che quando si produce quel lungo RNA, si forma solo una lunga serie di cariche negative, che dissolve il condensato e spegne il gene. È così che i geni vengono regolati. Sintonizzi il condensato con un RNA, poi lo spegni con il prodotto di RNA che viene prodotto quando il gene viene completamente trascritto.
HANNE: Fantastico. Quindi un interruttore di accensione e spegnimento, davvero.
RICK: È un interruttore di accensione/spegnimento che nessuno aveva previsto. E significa, ancora una volta, che se si dispone di un farmaco programmabile, si dispone di un nuovo modo di colpire le funzioni cellulari che sono disfunzionali, una nuova soluzione per un problema terapeutico.
JORGE: Il DNA spazzatura di un uomo è il sofisticato meccanismo di regolazione del genoma di un altro.
HANNE: O di ogni uomo.
Pubblicato il 15 luglio 2022
Tecnologia, innovazione e futuro, raccontato da chi lo costruisce.
- Andreessen Horowitz
- Bio e scienza
- Bitcoin
- blockchain
- conformità blockchain
- conferenza blockchain
- coinbase
- geniale
- Consenso
- conferenza crittografica
- criptazione mineraria
- criptovaluta
- decentrata
- DeFi
- Risorse digitali
- Ethereum
- machine learning
- gettone non fungibile
- Platone
- platone ai
- Platone Data Intelligence
- Platoneblockchain
- PlatoneDati
- gioco di plato
- Poligono
- prova di palo
- W3
- zefiro