Een nieuw type computermodel dat stralingsschade op cellulair niveau aan het licht kan brengen, zou de resultaten van radiotherapie voor longkankerpatiënten kunnen verbeteren.
Romeinse Bauer, een computationeel neurowetenschapper aan de Universiteit van Surrey in Groot-Brittannië, in samenwerking met Markeer tijdens en Nicolò Cogno oppompen van GSI Helmholtzentrum für Schwerionenforschung in Duitsland creëerde het model, dat cel voor cel simuleert hoe straling interageert met de longen.
Ruim de helft van alle patiënten met longkanker wordt behandeld met radiotherapie. Hoewel deze aanpak effectief is, blijft tot 30% van de ontvangers door straling veroorzaakte verwondingen over. Deze kunnen ernstige aandoeningen veroorzaken die de ademhaling beïnvloeden, zoals fibrose – waarbij de bekleding van de longblaasjes (luchtzakjes) in de longen dikker en verstijfder wordt – en pneumonitis – wanneer de wanden van de longblaasjes ontstoken raken.
Om stralingsschade aan gezond weefsel te beperken en toch kankercellen te doden, wordt radiotherapie in verschillende afzonderlijke ‘fracties’ toegediend. Hierdoor kan in totaal een hogere – en dus effectievere – dosis worden toegediend, omdat een deel van de beschadigde gezonde cellen zichzelf tussen elke fractie kan herstellen.
Momenteel worden fractioneringsschema's voor radiotherapie gekozen op basis van ervaringen uit het verleden en gegeneraliseerde statistische modellen, en zijn ze dus niet geoptimaliseerd voor individuele patiënten. Daarentegen zou gepersonaliseerde geneeskunde kunnen worden bereikt dankzij dit nieuwe model dat, aldus Durante, directeur van de Afdeling Biofysica bij GSI legt uit, kijkt naar “toxiciteit in weefsels, uitgaande van de fundamentele cellulaire reacties en [is] daarom in staat te voorspellen wat er met elke patiënt gebeurt” wanneer verschillende fractioneringsschema’s worden gekozen.
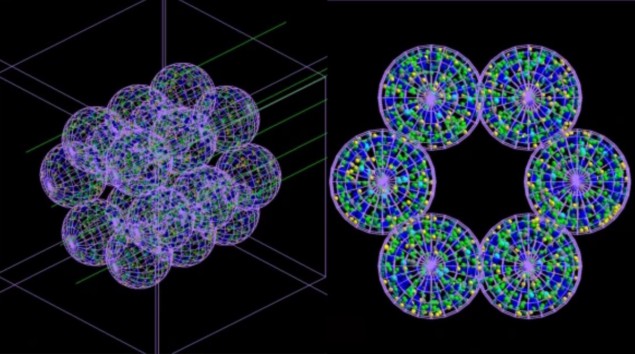
Het team ontwikkelde een ‘agent-based’ model (ABM), bestaande uit afzonderlijke op elkaar inwerkende eenheden of agenten – die in dit geval longcellen nabootsen – gekoppeld aan een Monte Carlo-simulator. De ABM, beschreven in Communicatie geneeskunde, bouwt een weergave van een alveolair segment bestaande uit 18 longblaasjes met elk een diameter van 260 µm. Vervolgens worden Monte Carlo-simulaties van de bestraling van deze longblaasjes uitgevoerd op microscopische en nanoscopische schaal, en informatie over de stralingsdosis die aan elke cel wordt afgegeven en de verdeling ervan wordt teruggevoerd naar de ABM.
De ABM gebruikt deze informatie om uit te zoeken of elke cel zou leven of sterven, en geeft de uiteindelijke resultaten weer in de vorm van een 3D-afbeelding. Cruciaal is dat het gekoppelde model het verstrijken van de tijd kan simuleren en zo de ernst van de stralingsschade kan aantonen – en de progressie van de medische aandoeningen die het kan veroorzaken – uren, dagen, maanden of zelfs jaren na de behandeling.
“Wat ik heel spannend vond, is dat deze computersimulaties daadwerkelijk resultaten opleverden die overeenkwamen met verschillende experimentele observaties van verschillende groepen, laboratoria en ziekenhuizen. Onze computationele aanpak zou dus in principe kunnen worden gebruikt binnen een klinische setting”, zegt Bauer, de woordvoerder van de internationale groep BioDynaMo-samenwerking, dat tot doel heeft nieuwe computationele methoden in de gezondheidszorg te introduceren via de softwaresuite die wordt gebruikt om dit model te bouwen.
Bauer begon te werken aan computationele kankermodellen nadat een goede vriend op 34-jarige leeftijd aan de ziekte stierf. “Elke kanker is anders en elke persoon is anders, met verschillend gevormde organen, genetische aanleg en levensstijl”, legt hij uit. Hij hoopt dat informatie uit scans, biopsieën en andere tests in het nieuwe model kan worden ingevoerd om een beeld van elk individu te krijgen. Er zou dan een AI-ondersteund therapieprotocol kunnen worden opgesteld dat een nauwkeurig op maat gemaakt behandelplan zou opleveren dat de overlevingskansen van de patiënt zou verbeteren.
Patiëntspecifieke planning kan de resultaten van radiotherapie verbeteren
Bauer is momenteel op zoek naar medewerkers uit andere disciplines, waaronder de natuurkunde, om te helpen bij het ontwikkelen van een klinische proef waarbij longkankerpatiënten gedurende meerdere jaren worden gevolgd. Ondertussen is het team van plan het gebruik van het model uit te breiden naar andere gebieden van de geneeskunde.
Durante hoopt bijvoorbeeld virale infecties te bestuderen met dit longmodel, omdat het “de longontsteking kan voorspellen die wordt veroorzaakt door de COVID-19-infectie”. Ondertussen is Bauer begonnen met het simuleren van de ontwikkeling van circuits in de hersenen van premature baby's, met als doel beter te begrijpen "op welk tijdstip moet worden ingegrepen en hoe".
- Door SEO aangedreven content en PR-distributie. Word vandaag nog versterkt.
- PlatoData.Network Verticale generatieve AI. Versterk jezelf. Toegang hier.
- PlatoAiStream. Web3-intelligentie. Kennis versterkt. Toegang hier.
- PlatoESG. carbon, CleanTech, Energie, Milieu, Zonne, Afvalbeheer. Toegang hier.
- Plato Gezondheid. Intelligentie op het gebied van biotech en klinische proeven. Toegang hier.
- Bron: https://physicsworld.com/a/modelling-lung-cells-could-help-personalize-radiotherapy/
- : heeft
- :is
- :niet
- $UP
- 135
- 3d
- a
- in staat
- Over
- AC
- bereikt
- werkelijk
- toegediend
- invloed hebben op
- Na
- oud
- agenten
- wil
- AIR
- Alles
- toestaat
- Hoewel
- an
- en
- elke
- nadering
- ZIJN
- gebieden
- AS
- At
- terug
- gebaseerde
- basis-
- basis
- BE
- omdat
- worden
- begon
- begonnen
- Betere
- tussen
- ademhaling
- brengen
- bouw
- bouwt
- by
- CAN
- Kanker
- Kankercellen
- gedragen
- geval
- Veroorzaken
- cel
- Cellen
- kansen
- uitgekozen
- Klinisch
- Sluiten
- van nabij
- samenwerking
- medewerkers
- computationeel
- computer
- voorwaarden
- bestaande uit
- contrast
- kon
- gepaard
- Covid-19
- aangemaakt
- cruciaal
- Op dit moment
- schade
- dagen
- geleverd
- afdeling
- beschreven
- ontwikkelde
- Ontwikkeling
- De
- gestorven
- anders
- Director
- disciplines
- Ziekte
- distributie
- dosis
- elk
- effectief
- Zelfs
- Alle
- opwindend
- Uitvouwen
- ervaring
- experimenteel
- Verklaart
- Fed
- finale
- volgend
- Voor
- formulier
- gevonden
- fractie
- vriend
- oppompen van
- gegeneraliseerde
- genetisch
- Duitsland
- doel
- Groep
- Helft
- gebeurt
- he
- gezondheidszorg
- gezond
- hulp
- hoger
- zijn
- hoop
- in de hoop
- ziekenhuizen
- HOURS
- Hoe
- HTTPS
- i
- verbeteren
- verbetert
- in
- Inclusief
- individueel
- informatie
- verwondingen
- instantie
- voornemens
- interactie
- wisselwerking
- Internationale
- ingrijpen
- in
- kwestie
- IT
- HAAR
- jpg
- voor slechts
- doden
- Labs
- Niveau
- leefstijlen
- LIMIT
- voering
- leven
- LOOKS
- op elkaar afgestemd
- max-width
- Mei..
- Ondertussen
- medisch
- geneeskunde
- methoden
- microscopisch
- model
- modellering
- modellen
- maanden
- meer
- beweging
- NATUUR
- New
- volgende
- of
- on
- geoptimaliseerde
- or
- bestellen
- Overige
- onze
- uit
- resultaten
- uitgang
- uitgangen
- over
- totaal
- passage
- verleden
- patiënt
- patiënten
- persoon
- Verpersoonlijken
- Gepersonaliseerde
- Fysica
- Natuurkunde wereld
- beeld
- plan
- planning
- Plato
- Plato gegevensintelligentie
- PlatoData
- punt
- voorspellen
- Prematuur
- principe
- progressie
- protocol
- zorgen voor
- radiotherapie
- reacties
- ontvangers
- reparatie
- vertegenwoordiging
- Resultaten
- onthullen
- zegt
- Scale
- scant
- regelingen
- op zoek naar
- segment
- apart
- ernstig
- het instellen van
- verscheidene
- gevormd
- tonen
- simuleren
- simulaties
- simulator
- So
- Software
- sommige
- woordvoerder
- Start
- statistisch
- Still
- Studie
- dergelijk
- suite
- Surrey
- overleving
- op maat gemaakt
- team
- testen
- Bedankt
- dat
- De
- Brittannië
- zich
- harte
- therapie
- daarom
- Deze
- dit
- thumbnail
- Dus
- niet de tijd of
- naar
- in de richting van
- behandeld
- behandeling
- proces
- leiden
- waar
- type dan:
- Uk
- begrip
- eenheden
- .
- gebruikt
- toepassingen
- gebruik
- divers
- zeer
- via
- virale
- Wat
- wanneer
- of
- welke
- en
- Met
- binnen
- Mijn werk
- uitwerken
- werkzaam
- wereld
- zou
- jaar
- zephyrnet