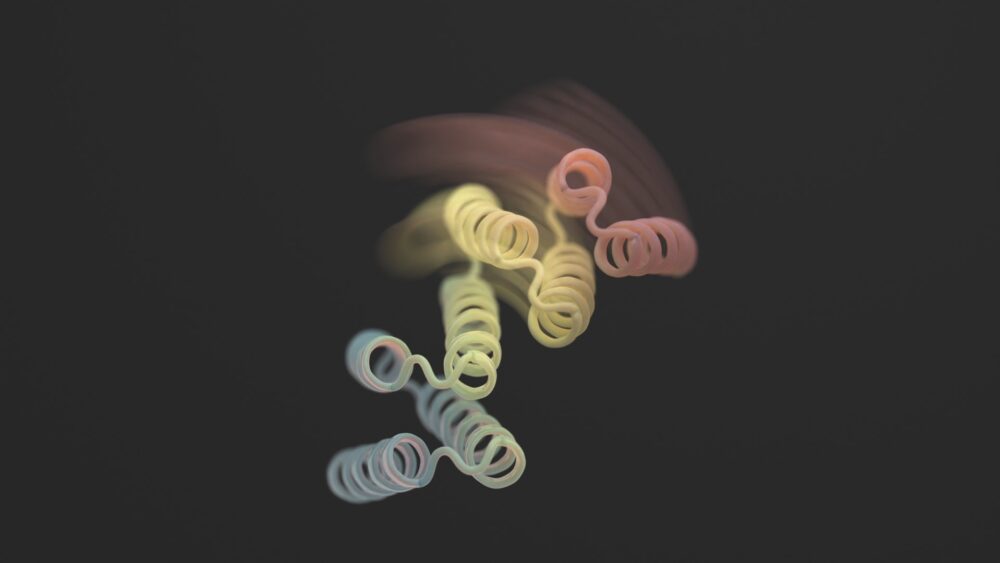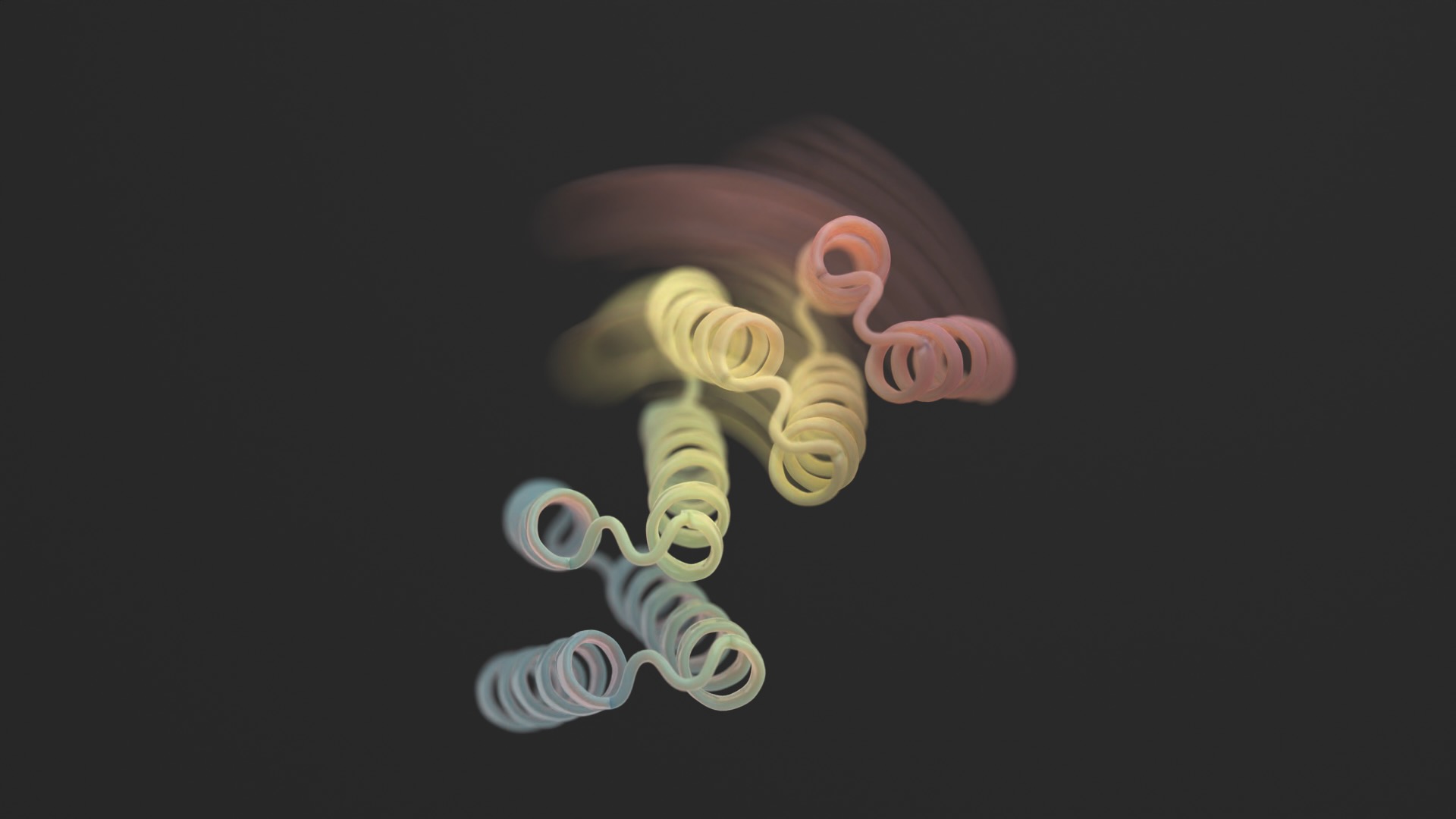
Vi tänker ofta på proteiner som oföränderliga 3D-skulpturer.
Det är inte helt rätt. Många proteiner är transformatorer som vrider och ändrar sina former beroende på biologiska behov. En konfiguration kan sprida skadliga signaler från en stroke eller hjärtinfarkt. En annan kan blockera den resulterande molekylära kaskaden och begränsa skadan.
På ett sätt fungerar proteiner som biologiska transistorer - på/av-brytare vid roten av kroppens molekylära "dator" som avgör hur den reagerar på externa och interna krafter och återkoppling. Forskare har länge studerat dessa formskiftande proteiner för att dechiffrera hur våra kroppar fungerar.
Men varför lita bara på naturen? Kan vi skapa biologiska "transistorer", okända för det biologiska universum, från grunden?
Ange AI. Flera metoder för djupinlärning kan redan exakt förutsäga proteinstrukturer—ett genombrott ett halvt sekel i vardande. Efterföljande studier som använder allt kraftfullare algoritmer har hallucinerade proteinstrukturer obundna av evolutionens krafter.
Ändå har dessa AI-genererade strukturer en undergång: även om de är mycket intrikat, är de flesta helt statiska - i huvudsak en sorts digital proteinskulptur frusen i tiden.
En ny studie in Vetenskap denna månad bröt formen genom att lägga till flexibilitet till designerproteiner. De nya strukturerna är inte förvrängda utan gränser. Designerproteinerna kan dock stabiliseras i två olika former - tänk ett gångjärn i antingen en öppen eller stängd konfiguration - beroende på en extern biologisk "lås". Varje tillstånd är analogt med en dators "0" eller "1", som sedan styr cellens utsignal.
"Tidigare kunde vi bara skapa proteiner som hade en stabil konfiguration", säger studieförfattaren Dr Florian Praetorius vid University of Washington. "Nu kan vi äntligen skapa proteiner som rör sig, vilket borde öppna upp för ett extraordinärt utbud av applikationer."
Huvudförfattaren Dr. David Baker har idéer: "Från att bilda nanostrukturer som svarar på kemikalier i miljön till tillämpningar inom läkemedelsleverans, vi har precis börjat utnyttja deras potential."
Ett proteinäktenskap gjord i AI
En snabb bit av biologi 101.
Proteiner bygger och driver våra kroppar. Dessa makromolekyler börjar sin resa från DNA. Genetisk information översätts till aminosyror, byggstenarna i ett protein – bildpärlor på ett snöre. Varje sträng viks sedan till intrikata 3D-former, med vissa delar som fastnar vid andra. Kallas sekundära strukturer, vissa konfigurationer ser ut som Twizzlers. Andra väver till mattliknande lakan. Dessa former bygger vidare på varandra och bildar mycket sofistikerade proteinarkitekturer.
Genom att förstå hur proteiner får sina former kan vi potentiellt konstruera nya från grunden, expandera det biologiska universum och skapa nya vapen mot virusinfektioner och andra sjukdomar.
Redan 2020 bröt DeepMinds AlphaFold och David Bakers lab RoseTTAFold det strukturella biologiska internet genom att noggrant förutsäga proteinstrukturer baserat på enbart deras aminosyrasekvenser.
Sedan dess har AI-modellerna förutspått formen på nästan varje protein som är känt – och okänt – för vetenskapen. Dessa kraftfulla verktyg omformar redan den biologiska forskningen och hjälper forskare att snabbt hitta potentiella mål bekämpa antibiotikaresistens, studera "hus" av vårt DNA, utveckla nya vacciner eller till och med belysa sjukdomar som härjar hjärnan, som Parkinsons sjukdom.
Sedan kom en bomb: generativa AI-modeller, som DALL-E och ChatGPT, erbjöd ett lockande perspektiv. Istället för att bara förutsäga proteinstrukturer, varför inte har AI drömt upp helt ny proteinstrukturer istället? Från ett protein som binder hormoner för att reglera kalciumnivåerna till artificiella enzymer som katalyserar bioluminescens, väckte initiala resultat entusiasm och potentialen för AI-designade proteiner verkade oändliga.
Vid rodret för dessa upptäckter är Bakers labb. Kort efter att ha släppt RoseTTAFold vidareutvecklade de algoritmen för att spika fast funktionella platser på ett protein – där det interagerar med andra proteiner, läkemedel eller antikroppar – vilket banar väg för forskare att drömma upp nya mediciner som de ännu inte har föreställt sig.
Ändå saknades en sak: flexibilitet. Ett stort antal proteiner "kodskiftar" i form för att ändra deras biologiska budskap. Resultatet kan bokstavligen bli liv eller död: ett protein som heter Bax, till exempel, ändrar sin form till en konformation som utlöser celldöd. Amyloid beta, ett protein som är inblandat i Alzheimers sjukdom, tar notoriskt en annan form eftersom det skadar hjärnceller.
En AI som hallucinerar liknande flip-flop-proteiner kan få oss närmare att förstå och rekapitulera dessa biologiska gåtor – vilket leder till nya medicinska lösningar.
Gångjärn, Line och Sinker
Att designa ett protein på atomnivå - och hoppas att det fungerar i en levande cell - är svårt. Att designa en med två konfigurationer är en mardröm.
Som en lös analogi, tänk på iskristaller i ett moln som så småningom formas till snöflingor, var och en olika i struktur. AI:s uppgift är att göra proteiner som kan växla mellan två olika "snöflingor" med samma aminosyra "iskristaller", där varje tillstånd motsvarar en "på" eller "av"-knapp. Dessutom måste proteinet spela bra inuti levande celler.
Laget började med flera regler. För det första bör varje struktur se väldigt olika ut mellan de två staterna - som en mänsklig profil som står eller sitter. De kunde kontrollera detta genom att mäta avstånd mellan atomer, förklarade teamet. För det andra måste förändringen ske snabbt. Detta innebär att proteinet inte kan vecklas ut helt innan det sätts ihop igen till en annan form, vilket tar tid.
Sedan finns det några riktlinjer för ett funktionellt protein: det måste fungera bra med kroppsvätskor i båda tillstånden. Slutligen måste den fungera som en omkopplare och ändra form beroende på ingångar och utgångar.
Att möta alla "dessa egenskaper i ett proteinsystem är utmanande", sa teamet.
Med en blandning av AlphaFold, Rosetta och proteinMPNN ser den slutliga designen ut som ett gångjärn. Den har två styva delar som kan röra sig i förhållande till varandra, medan en annan bit förblir vikt. Normalt är proteinet stängt. Utlösaren är en liten peptid - en kort kedja av aminosyror - som binder till gångjärnen och utlöser dess formförändring. Dessa så kallade "effektorpeptider" designades noggrant för specificitet, vilket minskade deras chanser att ta tag i delar utanför målet.
Teamet lade först till glöd-i-mörkret triggerpeptider till flera gångjärnsdesigner. Efterföljande analys visade att avtryckaren lätt tog tag i gångjärnet. Proteinets konfiguration ändrades. Som en förnuftskontroll var formen en som tidigare förutspåtts med hjälp av AI-analys.
Ytterligare studier med kristalliserade strukturer av proteindesignerna, antingen med eller utan effektorn, validerade resultaten ytterligare. Dessa tester jagade också designprinciper som fick gångjärnet att fungera och parametrar som tippar det ena tillståndet till det andra.
Take away? AI kan nu designa proteiner med två olika tillstånd – huvudsakligen bygga biologiska transistorer för syntetisk biologi. För närvarande använder systemet endast specialdesignade effektorpeptider i sina studier, vilket kan begränsa forskning och klinisk potential. Men enligt teamet kan strategin också sträcka sig till naturliga peptider, som de som binder proteiner som är involverade i att reglera blodsockret, reglerar vatten i vävnader eller påverkar hjärnans aktivitet.
"Som transistorer i elektroniska kretsar, kan vi koppla omkopplarna till externa utgångar och ingångar för att skapa avkänningsenheter och integrera dem i större proteinsystem," sa teamet.
Studieförfattaren Dr. Philip Leung tillägger: "Detta kan revolutionera biotekniken på samma sätt som transistorer transformerade elektronik."
Bildkredit: Ian C Haydon/UW Institute for Protein Design
- SEO-drivet innehåll och PR-distribution. Bli förstärkt idag.
- PlatoData.Network Vertical Generative Ai. Styrka dig själv. Tillgång här.
- PlatoAiStream. Web3 Intelligence. Kunskap förstärkt. Tillgång här.
- Platoesg. Fordon / elbilar, Kol, CleanTech, Energi, Miljö, Sol, Avfallshantering. Tillgång här.
- PlatoHealth. Biotech och kliniska prövningar Intelligence. Tillgång här.
- ChartPrime. Höj ditt handelsspel med ChartPrime. Tillgång här.
- BlockOffsets. Modernisera miljökompensation ägande. Tillgång här.
- Källa: https://singularityhub.com/2023/08/22/ai-can-now-design-proteins-that-behave-like-biological-transistors/
- : har
- :är
- :inte
- $UPP
- 2020
- 3d
- a
- AC
- Enligt
- exakt
- Agera
- aktivitet
- lagt till
- tillsats
- Dessutom
- Lägger
- Efter
- mot
- AI
- AI-modeller
- algoritm
- algoritmer
- Alla
- ensam
- redan
- också
- Även
- Alzheimers
- an
- analys
- och
- Annan
- tillämpningar
- ÄR
- AS
- At
- attackera
- Författaren
- bort
- tillbaka
- bagare
- baserat
- BE
- innan
- började
- börja
- beta
- mellan
- binda
- biologi
- bioteknik
- Bit
- Blockera
- Block
- blod
- organ
- båda
- Hjärna
- Hjärnaktivitet
- Hjärnceller
- genombrott
- Pank
- SLUTRESULTAT
- Byggnad
- men
- by
- Kalcium
- kallas
- kom
- KAN
- försiktigt
- vattenfall
- katalyserar
- Celler
- Århundrade
- kedja
- utmanande
- chanser
- byta
- ändrats
- byte
- ChatGPT
- ta
- Klinisk
- stängt
- närmare
- cloud
- fullständigt
- konfiguration
- kontroller
- Motsvarande
- kunde
- Par
- skapa
- Skapa
- kredit
- dalls
- skada
- David
- Död
- Dechiffrera
- djup
- djupt lärande
- Deepmind
- leverans
- beroende
- Designa
- konstruktionsprinciper
- utformade
- designer
- design
- mönster
- bestämmande
- utvecklade
- enheter
- olika
- digital
- Sjukdom
- sjukdomar
- DNA-
- ner
- undergång
- dr
- drömmen
- drog
- Läkemedel
- varje
- lätt
- kant
- antingen
- Elektronisk
- Elektronik
- Endless
- ingenjör
- entusiasm
- Miljö
- Även
- så småningom
- Varje
- Utvecklingen
- exempel
- expanderande
- förklarade
- förlänga
- extern
- extraordinära
- SNABB
- återkoppling
- slutlig
- Slutligen
- Förnamn
- Flexibilitet
- För
- Krafter
- formen
- hittade
- från
- frystes
- fungera
- funktionella
- ytterligare
- Få
- generativ
- Generativ AI
- riktlinjer
- hade
- Hälften
- hända
- Hård
- skada
- skador
- Har
- Hjärta
- HJÄRTATTACK
- hjälpa
- höggradigt
- gångjärn
- hoppas
- Hur ser din drömresa ut
- Men
- HTTPS
- humant
- IS
- idéer
- inbillade
- oföränderlig
- in
- införliva
- alltmer
- infektioner
- påverka
- informationen
- inledande
- ingångar
- inuti
- istället
- Institute
- interagerar
- inre
- Internet
- in
- involverade
- IT
- DESS
- sig
- Jobb
- resa
- bara
- lab
- Large
- större
- inlärning
- nivåer
- livet
- ljus
- tycka om
- BEGRÄNSA
- gränser
- linje
- levande
- Lång
- se
- ser ut som
- UTSEENDE
- sänkning
- gjord
- göra
- många
- Maj..
- betyder
- mätning
- medicinsk
- meddelande
- metoder
- saknas
- Blanda
- modeller
- molekylär
- Månad
- mest
- flytta
- multipel
- Natural
- Natur
- behov
- Nya
- trevligt
- NIH
- normalt
- nu
- antal
- of
- erbjuds
- Ofta
- on
- ONE
- ettor
- endast
- till
- öppet
- or
- Övriga
- Övrigt
- vår
- produktion
- parametrar
- reservdelar till din klassiker
- bit
- plato
- Platon Data Intelligence
- PlatonData
- Spela
- potentiell
- potentiellt
- den mäktigaste
- förutse
- förutsagda
- förutsäga
- tidigare
- Principerna
- Profil
- egenskaper
- utsikter
- Protein
- Proteiner
- Snabbt
- snabbt
- område
- snarare
- reagerar
- Reglera
- reglerande
- relativ
- frisättande
- förlita
- resterna
- forskning
- Svara
- resultera
- resulterande
- Resultat
- revolutionera
- höger
- styv
- rot
- regler
- Körning
- Nämnda
- Samma
- Vetenskap
- vetenskapsmän
- repa
- Andra
- sekundär
- verkade
- flera
- Forma
- former
- skjul
- skifta
- Kort
- Inom kort
- skall
- signaler
- liknande
- helt enkelt
- Områden
- Sittande
- Small
- snöflingor
- Lösningar
- några
- sofistikerade
- utlöste
- specificitet
- stabilisera
- stabil
- Starta
- Ange
- Stater
- fastklibbning
- Strategi
- Sträng
- strukturell
- struktur
- studerade
- studier
- Läsa på
- senare
- Senare
- sådana
- socker
- Växla
- syntetisk
- system
- System
- Ta
- tar
- Tryck
- mål
- grupp
- tester
- än
- den där
- Smakämnen
- deras
- Dem
- sedan
- Där.
- Dessa
- de
- sak
- tror
- detta
- de
- tid
- Tips
- till
- tillsammans
- verktyg
- transformerad
- transformatorer
- utlösa
- vridning
- två
- förståelse
- Universum
- universitet
- okänd
- us
- användningar
- med hjälp av
- validerade
- vastly
- virala
- var
- washington
- Vatten
- Sätt..
- we
- Vapen
- Weave
- webb
- były
- som
- medan
- varför
- med
- utan
- Arbete
- fungerar
- ännu
- zephyrnet