Рік Янг є професором біології в Массачусетському технологічному інституті, який вивчає РНК, яка транскрибується з частини геному, яка не кодує білки, відомої як некодуюча ДНК. Цю частину геному колись називали «сміттєвою ДНК», що дає вам зрозуміти, що багато хто думав про її цінність. Вчені були вражені виявленням, що він становить 98% геному людини, що спровокувало пошуки його функцій.
У цій розмові Рік Янг спілкується з Ганна Вінарська від Bio Eats World і генерального партнера a16z Хорхе Конде, який веде інвестиції на стику біології, інформатики та інженерії. До того як приєднатися до a16z, Конде був головним директором зі стратегії Syros Pharmaceuticals і був співзасновником компанії Knome, що займається інтерпретацією геномних даних.
Розмова охоплює те, що ми дізналися про ті 98% геному, які ми вважали сміттям. Виявляється, у нього є різноманітні завдання: від приховування доказів давніх вірусних інфекцій до створення унікального вигляду кожного обличчя. Вони також обговорюють його величезну, але все ще погано вивчену роль у захворюваннях, і те, як вивчення сміттєвої ДНК призвело до відкриття генного перемикача, якого ніхто не очікував.
Примітка: ця розмова спочатку була опублікована як епізод Bio Eats World. Ви можете послухати цей епізод тут.
ХАННЕ ВІНАРСЬКІ: Ми зібралися сьогодні, щоб поговорити про те, що називають смітною ДНК. Чи можемо ми почати з простого визначення?
РІК ЯНГ: Це термін приблизно півстоліття тому. Вчені знали про частини геному, які не кодують білки, і вони теоретизований що це сміття. Ми знали, що деякі з них були лише залишками давніх вірусних вторгнень у геном. Але ця фраза «сміттєва ДНК» переслідувала нас.
ХАННЕ: Тож який термін ви намагаєтеся використати замість цього? Темна матерія ДНК, про яку ми щодня все більше розуміємо?
РІК: Некодуюча ДНК.
ХАННЕ: Чому вони подумали про це як про уламки? Ви згадали, що деякі з них були залишками старих вірусів. Але чому це не було просто загадкою з самого початку?
РІК: Тому що протягом всієї біологічної історії точилися дебати щодо того, що таке генетичний матеріал, і спочатку вважалося, що це білок. Але як тільки стало зрозуміло, що білок — це механізм, а ДНК — схема механізму, люди почали працювати над механізмом, оскільки дефекти в механізмі викликають захворювання. Але потім виявилося, що лише 2% геному кодує амінокислоти для білків. Переважна більшість, 98%, ні. А в 2000 році, коли вчені Проекту геному людини представлений послідовність геному людини, ці дані підтвердили, що 98% з наших 3.2 мільярдів основ не кодують білки.
Кожен ген має дивовижну здатність брати часточки сегментів білка, які він кодує, і впорядковувати їх таким чином, щоб продукт, який ви отримуєте в одній клітині, міг працювати трохи швидше, або в іншій клітині міг фактично потрапити в іншу клітину. відсік для виконання іншої роботи.
ХОРХЕ КОНДЕ: Якими були початкові оцінки того, скільки генів буде закодовано в цих 3.2 мільярдах пар основ?
РІК: Ми зупинилися приблизно на 100,000 XNUMX. Ми просто припустили, що чим складніші ми, тим більший геном і більше кількість генів. Був певний шок, коли ми зрозуміли, що ми та комахи маємо приблизно однакову кількість генів.
ХОРХЕ: Менше генів, ніж ми очікували, кодує те, що ми вважаємо неймовірно складним організмом, чи не так?
ХАННЕ: Це трохи шок.
Той самий вихідний код, різні програми
ХОРХЕ: У старшій школі ми всі навчилися тому, що ДНК кодує РНК, РНК кодує амінокислоти, а амінокислоти дають нам білки, чи не так? Це центральна догма сучасної біології.
РІК: Так. Одна з важливих причин, чому люди швидко назвали «сміттєвою ДНК» тих 98% геному, які не кодують білки, полягає в тому, що вважалося, що головним чином комерційна мета геному полягає в тому, щоб зробити білки.
ХОРХЕ: Отже, коли генетики почали припускати, що сміттєва ДНК може бути чимось більшим, ніж сміттям?
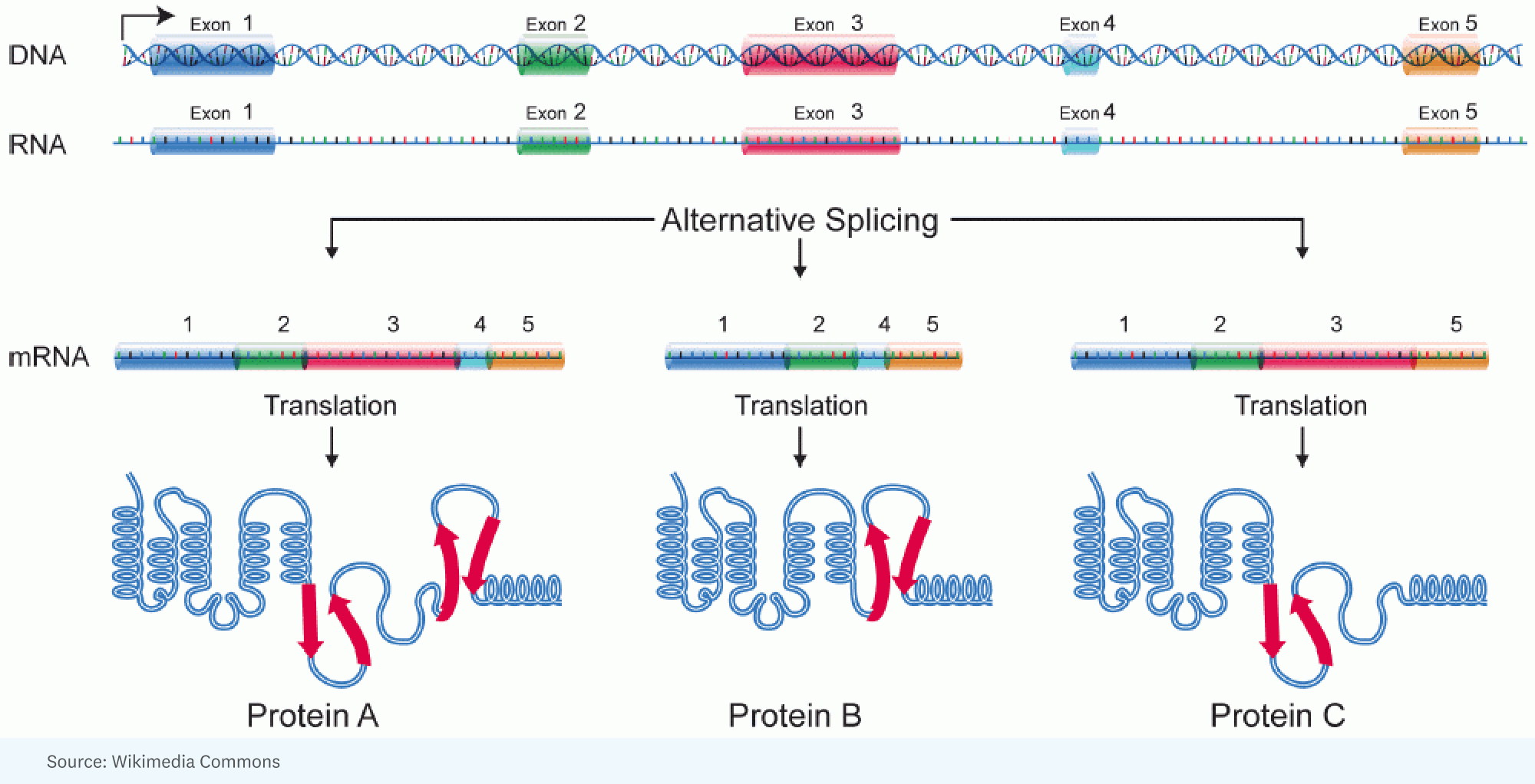
РІК: [Це почалося з] усвідомлення того, що додаткову складність людських істот порівняно з комахами можна пояснити величезною кількістю альтернативного сплайсингу. Ось де для одного гена утворюється велика РНК, але вона по-різному зрощується в одній клітині та в іншій. Іншими словами, різні частини гена потрапляють у молекулу РНК, яка специфікує білок. Отже, протеїн трохи інший.
ХАННЕ: Це трохи нагадує калейдоскоп, світло якого падає по-різному, ви отримуєте різні кольори, різні кути.
РІК: Ну, і це цікава аналогія. Я вважаю, що кращою аналогією є те, що у вас є Лего, і ви можете зробити машину, але ви можете зробити її багатьма різними способами, різними структурами, кольорами. Кожен ген має дивовижну здатність брати часточки сегментів білка, які він кодує, і впорядковувати їх таким чином, щоб продукт, який ви отримуєте в одній клітині, міг працювати трохи швидше, або в іншій клітині міг фактично потрапити в іншу клітину. відсік для виконання іншої роботи.
ХОРХЕ: Кожна окрема клітина в даній людині має приблизно однаковий геном. Проте той самий геном створює неймовірно різноманітний набір різних типів клітин. І тому в тій мірі, в якій ми збираємося провести аналогію, кожен тип комірки запускає різні програми з того самого вихідного коду.
РІК: Саме так.
Функції 98%
ХОРХЕ: Вам не потрібно бути експертом, щоб розглядати різні типи клітин і бачити, наскільки вони різноманітні, чи не так? Нейрон виглядає дуже, дуже, дуже по-іншому і функціонує дуже, дуже по-іншому, ніж, скажімо, м'язова клітина. Що визначає програму, генетичну програму, яку вибирає виконувати клітина? Що робить м’язову клітину м’язовою клітиною, а що робить нейрон нейроном?
РІК: Отже, ми почали з того, що ДНК створює РНК, а [РНК] — білок. Це центральна догма. Але приблизно півстоліття тому вчені почали наводити аргументи, що насправді РНК почала створювати різноманітні функції сама по собі. І виявилося, що РНК насправді має певну активність на найраніших стадіях розвитку.
Коли сперматозоїд зустрічається з яйцеклітиною, це РНК матері, яку вона вкладає в це яйце. Існують молекули РНК, які це роблять. Виявляється, антибіотики, які ми регулярно використовуємо, зв’язуються з РНК. Отже, РНК тут відіграє досить важливу роль. Це змінило спосіб мислення людей. Потім, коли ми почали думати про сміттєву ДНК, це частина ДНК, яка не кодує білок. Що ж, якщо світ заснований на РНК, а не на білку, принаймні початок? І тепер ми розуміємо, що величезна частина того, що ми називаємо сміттєвою ДНК, або те, що ми звикли називати сміттєвою ДНК, не є сміттям. Це дуже функціонально. І більшість з них утворює РНК.
Отже, ваша мета в програмуванні будь-якої однієї клітини полягає в тому, щоб використовувати саме той конкретний набір послідовностей, який налаштує кожен із цього загального набору генів на потрібний вам рівень. . . .Наша проблема в тому, що ми насправді не знаємо програми.
ХАННЕ: Вау. Чи можете ви трохи розповісти про те, де ми знаходимося в розумінні некодуючої частини ДНК? Знаєте, яке наше теперішнє розуміння всіх різноманітних можливостей?
РІК: Лише 2% нашого геному кодують ці амінокислотні послідовності, які входять до білків. Отже, що в бухгалтерській книзі нашого бухгалтера за те, що робить решта?
Близько половини нашого геному становить те, що ми називаємо гетерохроматином. Саме там ви отримуєте продукти давніх вірусних інвазій. Стародавні ретровіруси вторглися, а потім були перетворені в ДНК і вставлені в геном. Тож це фактично засіб, який ми мали протягом усієї нашої еволюційної історії, щоб приховати послідовності, з якими ми не хочемо мати справу. І це залишається мовчазним у нашому геномі за важливим винятком.
В іншій половині знаходяться всі активні гени, що кодують білок, і де знаходяться всі активні некодуючі гени. Отже, що це робить? Він має довгий список регуляторних функцій, але я спростю його до трьох.
Однією з його функцій є підтримка хромосом. Отже, це місця, де відбувається реплікація ДНК. Це ділянки в нашому геномі, які відповідають за його згортання, тому що це 2-метровий полімер. Його потрібно скласти в ядро діаметром пару мікрон.
Друга регуляторна область - це всі ці речі, які відповідають за регуляцію генів. Ймовірно, набагато більше генома визначає регуляторні особливості для експресії генів, ніж визначає самі гени. І це тому, що кожна клітина використовує різні регуляторні області для кожного гена.
ХАННЕ: Це так цікаво, для мене це звучить майже так, ніби є шафа з полицями на ньому речей, які нам потрібно покласти в шафу на деякий час, а потім є шафа інфраструктури.
Чому так важливо зосередитися на цьому? Тому що саме там відбувається понад 75% усіх генетичних варіацій, пов’язаних із захворюваннями.
РІК: Так. По суті, у вас є загальний набір генів у кожній клітині, як кодуючих, так і некодуючих. І у вас є елементи, у вас є фактичні послідовності, які працюють лише в певних типах клітинок. Отже, ваша мета в програмуванні будь-якої однієї клітини полягає в тому, щоб використовувати саме той конкретний набір послідовностей, який налаштує кожен із цього загального набору генів на потрібний вам рівень. Отже, ви граєте на дивовижному музичному інструменті з 20,000 XNUMX генів, що кодують білок, і приблизно стільки ж некодуючих генів. Ви робите це через певні послідовності. Наша проблема в тому, що ми насправді не знаємо програми.
Дражнити регуляторну програму
ХАННЕ: Отже, як це почати розбиратися? Якими підказками ви керуєтеся, коли починаєте намагатися зрозуміти цю програму?
РІК: Натяки полягають у тому, що регуляторні ділянки для кожного гена в клітині відображаються самі. Вони кажуть вам. І можна використовувати різноманітна технікаякі дуже швидко повідомляють вам по всьому геному, в певному типі клітини, скажімо, в моторному нейроні, які всі регуляторні області знаходяться в цій клітині. Ви навіть можете побачити, де встановлено реостат для кожного з цих генів. Ось де швидке секвенування дало нам ці можливості одночасного визначення всіх активних елементів для генів, як кодуючих, так і некодуючих у геномі певного типу клітин.
Наша проблема на даний момент полягає в тому, що ви повинні робити це майже по одному типу клітин за раз, а у нас є багато, багато сотень типів клітин. Іноді важко фактично побачити конкретну клітину, не забруднивши її іншими клітинами, тому що всі наші тканини насправді є комбінаціями кількох типів клітин.
ХОРХЕ: Чи варто сперечатися за аналогією, якщо ми кажемо, що враховуючи, що кожна клітина має цілий геном, кожна клітина має цілий пісенник, певні типи клітин вибирають для виконання певних симфоній, а механізм, який допомагає регулювати геном, по суті, є провідником оркестр? Цей механізм є диригентом, який визначає, які пісні грати, які ноти виконувати, з якою гучністю їх виконувати, у якому темпі тощо. Чи це розумна аналогія з розумінням регуляторної функції геному?
РІК: Це в тому сенсі, що тоді легко побачити, яким буде результат. Але що ще складніше, хто пише всі нотатки? Хто той композитор, який вклав туди всі ці ноти і все зробив правильно? Композитором для більшості наших клітин і більшості наших генів є ці білкові молекули, які називаються транскрипційними факторами, завдання яких полягає в тому, щоб зв’язуватися з регуляторними елементами генів і надавати їм реостатне налаштування.
У цьому є цікава зморшка, тому що в тих місцях, де зв’язуються ці фактори транскрипції, ми називаємо їх підсилювачами. У цих енхансерних сайтах також завжди є РНК, що виробляється з того місця, де вони зв’язані. Лише нещодавно ми зрозуміли, що ця РНК відіграє важливу роль у регуляції. Просто щоб підсилити це: спосіб, у який ваш iPhone розпізнає ваше обличчя, полягає в тому, що енхансери, які контролюють гени черепної структури обличчя, відрізняються в кожної людини.
Те, що у вас зараз тут, це тріумвірат. У вас є послідовність ДНК. Він розпізнається конкретно складовою молекулою, фактором транскрипції, але йому потрібна ця третя частина, ця молекула РНК. Отже, ДНК, РНК і білок насправді працюють разом у цих регуляторних областях. І чому так важливо приділяти цьому увагу? Тому що саме там відбувається понад 75% усіх генетичних варіацій, пов’язаних із захворюваннями.
ХАННЕ: Щоб не бути занадто музичним, але це звучить майже як акорд, чи не так? Структура з трьох нот грає разом, щоб створити щось більше.
РІК: Саме так.
Програмісти
ХОРХЕ: Однією з найсучасніших областей біології є наша зростаюча здатність намагатися зрозуміти деякі керівні закони того, як визначаються клітинні програми, як визначається доля клітини. Для мене один із захоплюючих кроків вперед у нашому розумінні став результатом роботи Яманаки, за яку він був нагороджений Нобелівська премія, демонструючи, що ви можете перепрограмувати типи клітин, просто піддаючи клітини дії дуже невеликої кількості специфічних факторів транскрипції.
ХАННЕ: Чи можете ви описати, чому саме це стало таким проривом для галузі?
РІК: У мене була маленька роль у цьому фільмі. Виявляється, хоча це дуже велика кількість, невелика кількість факторів транскрипції може ідентифікувати всі регуляторні елементи, які є важливими для ідентичності цієї клітини. І Яманака довів нам це, показавши, що лише чотири з цих факторів можна використати для програмування будь-якої клітини людини чи будь-якої чоловічої клітини на еквівалент ембріональної стовбурової клітини.
Один із способів подумати про це: якщо пісня надто погана, організм не живе. Але якщо це лише трохи, ви дорослішаєте, стаєте дорослим, а потім у вас з’являються всі ці різноманітні хвороби, коли ми старіємо.
ХОРХЕ: І це дивовижно, чи не так? Тому що це означає, що система якимось чином розроблена так, що неймовірна складність витягується з того, що звучить як простота. Чотири транскрипційні фактори, що визначають увесь складний каскад подій, які керують різними типами клітин.
Деяка робота, яку ви виконали, показала, що ці головні фактори транскрипції, по суті, створюють еквівалент ланцюгів, які контролюють гени, необхідні клітині для встановлення та підтримки свого стану. Чи можете ви описати, що ви маєте на увазі під схемами контролю генів?
РІК: У схемах контролю генів є два круті елементи. По-перше, коли головний регулятор знаходить ці підсилювачі та викликає експресію своїх цільових генів, це частина схеми, це результат. Інший елемент, який дуже крутий, полягає в тому, що головні фактори транскрипції також регулюють свою власну експресію. Отже, є зворотний зв’язок. Наприклад, у вас буде електрична діаграма, на якій господарі контролюють свою власну експресію за допомогою власних генів, а потім зв’язуються з цільовим набором генів і контролюють її експресію.
ХОРХЕ: Це досить дико. Це майже як циклічне посилання, де факторами транскрипції є білок, цей білок утворюється з ДНК, закодованої в гені. Транскрипційні фактори є частиною механізму, який сприяє експресії транскрипції генів. Отже, ви кажете, що транскрипційні фактори – білок – допомагають регулювати експресію генів, які створюють транскрипційні фактори.
ХАННЕ: Так. Існує уявний образ усієї цієї симфонії всіх цих маленьких клітинок, знаєте, які співають усі ці різні текстури.
Регуляторний геном і захворювання
ХАННЕ: Що зміниться, коли ми почнемо розуміти, як це все функціонує? Що ми можемо зробити з цими знаннями?
РІК: У цих місцях, де ці головні фактори транскрипції керують ідентичністю кожної клітини, більшість людських варіацій спричиняє захворювання. Понад 75% змін, пов’язаних із захворюваннями, відбуваються в цих енхансерних елементах, які керують ключовими генами.
ХОРХЕ: Гаразд. Так це дико, правда? Коли ми думаємо про мутації, що спричиняють або сприяють хворобі, ми зазвичай думаємо про мутацію, яка відбувається в гені, яка впливає на білок, якимось чином порушує білок і це викликає захворювання.
ХАННЕ: Правильно.
ХОРХЕ: Але ви хочете сказати, що в 75% випадків ця мутація насправді відбувається поза генами, це відбувається в цій некодуючій області геному. Якщо ген є піснею, то справа не в тому, що пісня неправильно відтворюється, а в тому, що вона може гратися надто голосно, чи надто тихо, чи надто повільно, чи надто швидко, але саме це є причиною багатьох захворювань.
РІК: Насправді, один із способів подумати про це: якщо пісня надто погана, організм не живе. Але якщо це лише трохи, ви дорослішаєте, стаєте дорослим, а потім у вас з’являються всі ці різноманітні хвороби, коли ми старіємо.
Уперше ми маємо всі ці моделі того, як ви налаштовуєте пристрій і змушуєте його працювати.
ХОРХЕ: Не створення неправильної версії гена, а отримання неправильної дози гена. Занадто багато або занадто мало.
РІК: Це правильно. Як ви знаходите терапію, яка впорається з цим? Як ви вибірково налаштовуєте чи зменшуєте ген? В принципі, ми можемо зробити це багатьма способами, і ми можемо зробити це за допомогою генної терапії. Ми можемо зробити це за допомогою редагування генів CRISPR. Але найголовніше, що ми виявили за останні кілька років, це те, що кожен із цих генних регуляторних елементів має РНК. РНК є функціональною. Це реостат, який допомагає налаштувати вихід цього гена. Зараз є багато способів лікарські РНК. У нас є ASO (антисмислові олігонуклеотиди), такі як Spinraza для спінальної м’язової атрофії. Ми маємо РНК-інтерференцію. У нас на горизонті є кілька нових маломолекулярних ліків. Якби ви могли подумати про способи програмування препарату, синтетичної РНК, для регулювання РНК-регулятора, регуляторної РНК, у вас є основний спосіб налаштування будь-якого гена в будь-якій клітині, де ця клітина може отримати доступ до цього препарату.
ХАННЕ: Отже, це не просто зовсім інше розуміння того, як виникає хвороба. Але це зовсім інше розуміння того, як ми потенційно можемо лікувати хворобу.
РІК: Саме так. У принципі, зараз ми маємо програмований спосіб розробки препарату, який налаштовує будь-який ген, який нас цікавить. У цей момент люди просто програмують синтетичні молекули РНК для виробництва вакцини від цієї пандемії. Такий, який є настільки хорошим результатом, якого ви могли очікувати від вакцини.
ХОРХЕ: Коли ми думаємо про застосування технології в біології, зазвичай ми намагаємося зробити одну з двох речей. Ми або намагаємося дуже глибоко дослідити біологію та зрозуміти її, підвищуючи рівень її складності, або намагаємося втрутитися. Ми все частіше можемо досліджувати біологію на дуже-дуже глибокому рівні, щоб зрозуміти керівні закони або правила того, як клітини регулюються. І ми це маємо, у нас є все більш витончені інструменти, як ці програмовані методи медицини, де ми можемо націлити РНК дуже, дуже конкретно. Це буде свого роду цей доброчесний цикл між нашою здатністю досліджувати біологію та потім втручатися все більш витонченими способами. І я думаю, що це один із найцікавіших аспектів того, де ми сьогодні знаходимося в цій галузі.
РІК: Я з вами згоден. Зараз ми розвиваємо настільки глибоке розуміння багатьох рівнів складності, що можемо висунути терапевтичні гіпотези, яких ми раніше не бачили. Ми можемо робити це зі швидкістю, про яку ми навіть не уявляли лише кілька років тому. Ця часова відстань між основним відкриттям і терапією, яка з’явилася на людях 10 років тому, становила в середньому 14 років. Тепер можна подумати про те, щоб розробити терапевтичну гіпотезу, засновану на фундаментальній науці, і терапію, яка досягне пацієнта за дев’ять місяців. Ми бачити це з цією новою вакциною.
ХАННЕ: Отже, змінюється не лише те, як ми розуміємо появу хвороби, як ми її лікуємо, а й те, як ми займаємося самою наукою, а потім, як швидко наука може статися та перетворитися на клінічну реальність для пацієнтів.
РНК як компартменталізатор
РІК: Саме так. Але тепер є вишенька на торті, тому що, традиційно, ми думали про фармакологію двояко. Одним з них був вплив препарату на людину. Іншим був вплив людини на препарат. І в цьому останньому сегменті вас турбує розподіл препарату, до яких тканин він потрапляє, до яких тканин він недоступний. Оскільки ми просто припускаємо, що коли ліки потрапляють у клітину, вони дифундують крізь клітину та знаходять свою ціль. У нас є мембранні відсіки, про які ми знали століття.
ХОРХЕ: Що завжди було питанням проникності клітини, вірно? Чи може він пройти через мембрану?
РІК: Так. Чи може він перетинати мембрану і потрапляє він в ядро чи ні? Але лише в останнє десятиліття ми зрозуміли, що в клітинах також є багато немембранних тілець, які називаються біомолекулярні конденсати оскільки вважається, що одна з причин утворення цих тіл полягає в тому, що вони конденсуються так само, як вода конденсується в краплю роси. Але те, що було настільки глибоким у цьому розумінні, полягає в тому, що ці конденсати розділяють білки, ДНК, РНК для певних функцій. І тепер ми зрозуміли, що ви можете розділити від 5 до 10 мільярдів білкових і РНК-молекул у клітині на різні компартменти, де вони функціонують разом зі своїми друзями.
ХАННЕ: Га.
ХОРХЕ: Ми залишаємо сферу біології й переходимо у сферу фізики?
РІК: Ми зробили саме це, тому що поділ фаз вважається рушійною силою. Це фізичне явище, яке описується математикою.
ХАННЕ: Вау.
РІК: Тепер ми дізналися, які найефективніші хіміотерапевтичні препарати зосередження всередині відсіків, де живуть їхні цілі. Вони концентруються в 600 разів над рештою клітини, тому вони мають цільову дію на онкогени, яка в 600 разів перевищує очікувану. Це не тільки говорить нам про те, що є абсолютно нові ідеї, важливі для відкриття та розробки ліків у майбутньому, але це спонукає нас краще зрозуміти, що ці конденсати роблять.
Ось що я маю на увазі під вишенькою на торті. Те, що ми зрозуміли, так це те, що ці відділи конденсату, які функціоналізують клітину таким важливим чином, регулюються РНК. Їх утворення може стимулюватися РНК. Якщо ви виробите занадто багато РНК, ви підніміть реостат до 11, він розчинить конденсат. Отже, раптом ми розуміємо, що вихід РНК на будь-якій ділянці всередині клітини може налаштувати функцію будь-чого, посилюючи або розчиняючи ті конденсати, де ця функція відбувається. І це, на мою думку, дуже важливо, тому що це ще один спосіб використання програмованої РНК, синтетичної молекули РНК, для налаштування функції клітини, яка стала дисфункціональною. Уперше ми маємо всі ці моделі того, як ви налаштовуєте пристрій і змушуєте його працювати.
ХАННЕ: Ще одна ручка для набору.
РІК: Але як тоді його вимкнути? Виявляється, коли ви створюєте таку довгу РНК, це просто великий рядок негативних зарядів, який розчиняє конденсат і вимикає ген. Саме так регулюються гени. Ви налаштовуєте конденсат за допомогою РНК, а потім закриваєте його за допомогою продукту РНК, який утворюється, коли ген повністю транскрибується.
ХАННЕ: Супер круто. Тож справді вимикач і ввімкнення.
РІК: Це вимикач/увімкнення, якого ніхто не очікував. І це знову означає, що якщо у вас є програмований препарат, у вас є новий спосіб націлювання на клітинні функції, які не функціонують, нове рішення для терапевтичної проблеми.
ХОРХЕ: Сміттєва ДНК однієї людини — це складний механізм регулювання генома іншої людини.
ХАННЕ: Або кожного чоловіка.
Опубліковано 15 липня 2022 р
Технології, інновації та майбутнє за словами тих, хто їх будує.
- Андреессен Горовиц
- Біо та наука
- Біткойн
- blockchain
- відповідність блокчейну
- блокчейн-конференція
- coinbase
- coingenius
- Консенсус
- криптоконференція
- криптографічне видобування
- криптовалюта
- Децентралізований
- Defi
- Цифрові активи
- Ефіріума
- навчання за допомогою машини
- не замінний маркер
- plato
- платон ai
- Інформація про дані Платона
- Платоблокчейн
- PlatoData
- platogaming
- Багатокутник
- доказ ставки
- W3
- зефірнет